Цитофлавин при тотальной внутривенной анестезии
А.М.Овезов, С.В.Брагина, П.В.Прокошев
Ключевые слова: тотальная внутривенная анестезия, цитофлавин, кардиопротекция, нейропротекция, безопасность анестезии, посленаркозная реабилитация.
Введение. Одним из приоритетных направлений современной анестезиологии является оптимизация анестезиологического пособия в различных областях хирургии. При этом серьёзное значение придается ранней посленаркозной активизации пациентов, ключевыми моментами которой являются уменьшение фармакологической нагрузки (либо применение препаратов, соответствующих концепции «fast track anesthesia») и сокращение сроков послеоперационной искусственной вентиляции легких (ИВЛ) с ранней экстубацией трахеи (разумеется, при наличии соответствующих показаний).
Не менее важным аспектом повышения качества анестезиологического обеспечения является профилактика и ранняя коррекция проявлений хирургического стресса, т.е. — органопротекция, носящая мультимодальный характер [7, 13–15].
С этих позиций наше внимание привлек отечественный препарат цитофлавин (НТФФ «ПОЛИСАН», Санкт-Петербург), обладающий антиоксидантным, кардиопротективным, метаболотропным и нейротропным свойствами [1, 3]. В литературе последних лет обосновано использование цитофлавина в кардиоанестезиологии [5, 6], показана целесообразность назначения препарата при острой цереброваскулярной ишемии [1, 3, 10] и для восстановления после длительных абдоминальных операций [9], рекомендуется его применение в комплексной интенсивной терапии [1, 2]. Однако мы не обнаружили работ, посвященных изучению возможности использования органопротективных и нейрометаболических свойств цитофлавина при наиболее распространенных типах операций с позиций доказательной медицины.
Цель исследования — определение влияния отечественного препарата цитофлавин на течение тотальной внутривенной анестезии при операциях средней продолжительности (на примере лапароскопической холецистэктомии).
Материал и методы . Дизайн исследования — двойное слепое, контролируемое, рандомизированное, клиническое, проспективное. Обследовано 30 пациенток с хроническим калькулезным холециститом, оперированных в абдоминальном отделении МОНИКИ им. М.Ф.Владимирского в 2009 г. Всем больным была выполнена лапароскопическая холецистэктомия в условиях тотальной внутривенной анестезии (ТВА). Физический статус пациенток — ASAII– ASAIII, операционный риск по МНОАР — II–III степени, возраст — от 19 до 79 лет. Критериями исключения из исследования были: мужской пол (с учетом показанной F.F.Buchanan и соавт. (2006) зависимости продолжительности периода реадаптации от пола [12]), отказ больной от участия в исследовании, физический статус класса ASAIV, переход на открытую операцию, наличие в анамнезе поливалентной аллергии, декомпенсированного сахарного диабета, острого нарушения мозгового кровообращения, эпилепсии, алкоголизма, органического поражения центральной нервной системы. Проведение анестезиологического пособия обеспечивала одна и та же бригада врачей для исключения так называемого «человеческого фактора».
Непосредственно перед операцией пациенток случайным образом разделяли на: группу А — контрольная (n=15) и группу Б — основная (n=15). В качестве контрольного препарата использовали эссенциале, дающий схожую окраску в растворе. Анестезиолог получал готовый раствор в предоперационной (всегда одинаковый флакон с жидкостью одного цвета и одного объёма), не располагая информацией о его составе. Инфузию раствора эссенциале (20 мл, разведенного на растворе глюкозы 5% — 250 мл) или цитофлавина (20 мл, разведенного таким же образом) начинали сразу после наложения карбоксиперитонеума со скоростью 4,5 мл/мин, согласно рекомендациям производителя [3], параллельно с обычной инфузионной терапией.
ТВА всем больным проводили по стандартной схеме: премедикация: реланиум 10 мг внутримышечно за 30 мин до подачи пациентки в операционную, кеторолак 2,0 внутримышечно — в операционной; индукция: пропофол 1,5–2 мг/кг, фентанил 2,5–3 мкг/кг, миоплегию осуществляли введением эсмерона 0,6 мг/(кг•ч); поддержание анестезии — ИВЛ: O2 (Fi=40%)+воздух, внутривенная инфузия фентанила 3–5 мкг/ (кг•ч) и пропофола 5–7 мг/(кг•ч).
Объём мониторинга: электрокардиография (ЭКГ), частота сердечных сокращений (ЧСС), неинвазивное артериальное давление — систолическое (АДс), диастолическое (АДд) и среднее (АДср), пульсоксиметрия (SpO2), капнография (EtCO2), температура тела (монитор Nihon Kohden BSM 2301, Япония). Глубину угнетения сознания оценивали с помощью компьютерной обработки монополярной электроэнцефалограммы, определяя её частотный спектр и информационную насыщенность (ИНЭЭГ) [8]. Полученные результаты фиксировали в виде электронной наркозной карты с последующим аудитом критических инцидентов (КИ) по следующим критериям: SpO2<95%; 90<АДс>160 мм рт. ст.; 60<ЧСС>100 мин–1; 25<ИНЭЭГ>55%. Рассчитывали частоту критических инцидентов (ЧКИ) и индекс частоты критических инцидентов (ИЧКИ) [4]. Осуществляли лабораторный контроль Hb, Ht, гликемии, электролитов, лактата, КОС и газов крови (анализатор Stat Profile Ultra — 10C, США).
Результаты исследования регистрировали на 10 этапах (контрольных точках для ЧКИ) операции и анестезиологического пособия: I — поступление в операционную; II — после интубации и перевода на ИВЛ; III — разрез кожи; IV — начало инсуффляции СО2; V — выделение желчного пузыря; VI — холецистэктомия; VII — конец операции; VIII — экстубация; IX — 5-я минута после экстубации; X — 10-я минута после экстубации.
Кроме того, с момента окончания операции фиксировали в секундах: Т1 — время пробуждения, Т2 — время до экстубации, Т3 — время ориентации, Т4 — время до готовности к переводу из операционной (достижение 9–10 баллов по шкале J.Aldrete [11]).
Статистическую обработку (описательная статистика, попарный t-критерий для зависимых выборок, критерий Крускалла—Уоллиса) полученных результатов выполняли с помощью пакета программ Analysis ToolPak — VBA (MS Excel 2007) и модульной программы анализа и обработки данных AtteStat 1095. Нормальность распределения определяли тестом Шапиро—Уилка. Данные представлены в виде M±m.
Статистически достоверным считали значение p<0,05.
Результаты и обсуждение. Как показано в табл. 1, группы были репрезентативны по возрасту, массе тела, физическому статусу по ASA, продолжительности операции и анестезии, потребности в препаратах для проведения ТВА и в объёме инфузионной терапии.
В табл. 2 приведены динамические значения некоторых мониторированных параметров, из которых обращают на себя внимание: достоверное снижение АД к моменту разреза кожи в обеих группах с последующим повышением до исходного уровня, а также уменьшение ЧСС на основных этапах оперативного вмешательства, более выраженное и статистически значимое в основной группе. Уровень SpO2 достоверно повышался на фоне ИВЛ в обеих группах, однако, если в группе Б после восстановления спонтанной вентиляции он практически соответствовал исходному, то в группе А на VIII–X этапах сатурация была ниже исходной (p<0,05).
Характеризуя период посленаркозной реабилитации, отметим, что после экстубации у больных группы А отмечали повышение АДср на 13,5% (p<0,05) и ЧСС — на 14,7% (p<0,05), при снижении SpO2 на 2,7% (p<0,05) от первоначальных значений. В группе Б гипердинамической реакции сердечно-сосудистой системы не наблюдали, SpO2 оставалась стабильной, а ЧСС была достоверно ниже, чем в контрольной группе в течение всего периода реадаптации на 10,1–14,9%.
При сравнении групп между собой выявлена разница в средних значениях ЧСС (выше на 13–18%, p<0,05) на различных этапах исследования и SpO2 (ниже на 2%, p=0,03) на основном этапе операции в контрольной группе.
Таким образом, гемодинамический профиль течения тотальной внутривенной анестезии в обеих группах носил однонаправленный характер, однако в основной группе средние значения изученных параметров были менее вариабельны, отмечались отсутствие тахикардии и стабильность уровня кислородного насыщения (SpO2), что в совокупности подтверждает наличие антигипоксического, отрицательного хронотропного и кардиопротекторного эффектов цитофлавина, описанного ранее [1, 2, 5, 6].
При эквивалентной потребности в пропофоле и фентаниле (см. табл. 1) уровень угнетения сознания был одинаков в обеих группах до окончания операции (рисунок). Интраоперационные колебания ИНЭЭГ в пределах от (41,3±4,7) до (53,1±2,7)% соответствовали понятию «адекватная анестезия» в обеих группах и были достоверно ниже исходных. Однако после прекращения подачи анестетика, на VII этапе, ИНЭЭГ в группе Б повысилась до (65,8±5,6)% с (44,7±3,5)%, p1<0,001, тогда как в контрольной группе она оставалась неизменной — (48,5±6,4)%.
Таблица 1
Общая характеристика групп (M±m)
Показатели |
Группа А (n=15) |
Группа Б (n=15) |
Возраст, годы Масса тела, кг Физический статус по ASA, %: Время, ч: |
48,3±4,5 78,5±3,9
7,4±0,8 |
50,3±4,0 78,5±3,1
7,2±1,0 |
П р и м е ч а н и е . Везде p>0,5 между группами.
Такая межгрупповая разница (р=0,028) в степени угнетения сознания обусловила более быстрое течение периода посленаркозной реабилитации у пациенток основной группы: время пробуждения у них было короче в 2 раза (р=0,0018), а экстубация трахеи произведена быстрее в 1,6 раза, (р=0,0363) (табл. 3). По-видимому, именно нейрометаболический эффект цитофлавина [1, 3, 9, 10] обусловил более раннее восстановление ориентации больных по сравнению с контрольной группой и более быстрое достижение ими готовности к переводу в палату, т.е. 9–10 баллов по шкале Алдрета (в 1,6 раза, р=0,0298 и 0,0073 соответственно).
При оценке частоты критических инцидентов было обнаружено, что интраоперационная ЧКИ в группе А составила в среднем 0,66±0,11 на этап исследования, а в группе Б — 0,36±0,06 (р=0,028); а ИЧКИ — 2,62 и 1,44 в 1 ч соответственно.
Та б л и ц а 2
Динамика АД, ЧСС и SpO2 на этапах исследования (M±m)
Этап |
Группа |
Показатели |
||||
АДс, мм рт. ст. |
АДд, мм рт. ст. |
АДср, мм рт. ст. |
ЧСС, мин–1 |
SpO2, % |
||
I |
А |
137,6±8,2 |
74,8±4,2 |
96,0±5,0 |
89,6±4,2 |
97,7±0,5 |
Б |
141,3±8,2 |
80,8±2,6 |
98,1±5,1 |
84,6±3,3 |
97,0±0,9 |
|
II |
А |
125,6±8,3 |
79,3±8,2 |
98,7±8,2 |
97,1±4,8* |
99,4±0,2* |
Б |
128,8±5,8* |
76,0±4,1 |
90,7±4,7 |
85,1±3,4 |
99,9±0,1* |
|
III |
А |
108,3±5,4* |
61,4±3,6* |
79,1±3,5* |
84,0±4,2 |
99,0±0,3* |
Б |
117,5±6,5* |
73,2±5,3# |
86,4±5,7 |
76,3±3,2* |
99,9±0,1* |
|
IV |
А |
117,8±6,3* |
68,5±6,3 |
85,7±5,6 |
88,6±5,1 |
99,2±0,3* |
Б |
126,2±6,3* |
76,1±4,9 |
90,2±5,2* |
72,6±2,8*# |
99,9±0,1* |
|
V |
А |
126,3±7,4 |
78,7±4,7 |
95,3±5,6 |
79,1±5,7 |
98,9±0,4 |
Б |
132,4±5,0 |
82,5±5,4 |
100,9±5,5 |
74,0±3,6* |
100,0±0,0* # |
|
VI |
А |
131,7±5,3 |
79,1±3,3 |
92,5±3,2 |
86,6±4,7 |
99,3±0,2* |
Б |
130,8±5,1 |
78,3±4,7 |
95,0±5,4 |
72,0±2,0* # |
99,7±0,2* |
|
VII |
А |
132,5±6,5 |
80,2±3,1 |
99,2±4,0 |
85,3±5,0 |
98,9±0,6 |
Б |
140,9±4,7 |
81,3±1,6 |
103,6±2,4 |
76,8±3,2* |
99,7±0,2* |
|
VIII |
А |
149,9±8,6 |
88,1±3,1* |
109,9±7,2* |
102,8±4,3* |
95,1±1,0* |
Б |
143,0±3,6 |
81,3±2,6 |
97,1±1,9 |
87,5±4,6 # |
97,1±1,0 |
|
IX |
А |
137,3±6,0 |
78,5±1,9 |
95,4±2,8 |
91,1±3,9 |
95,0±1,0* |
Б |
139,8±3,6 |
81,2±3,4 |
100,5±4,7 |
82,8±2,3# |
95,8±1,0 |
|
X |
А |
134,6±4,8 |
81,1±3,7 |
99,2±4,4 |
87,4±2,5 |
95,3±0,7* |
Б |
136,4±4,1 |
78,5±3,3 |
96,9±4,6 |
82,1±2,3 |
95,7±0,8 |
|
* p<0,05 внутри групп по отношению к I этапу.
# p<0,05 между группами на этапах исследования.
В течение периода выхода из наркоза средняя ЧКИ в группе А составила 0,7±0,24, в группе Б — 0,3±0,06 (p>0,05); ИЧКИ — 5,2 и 3,6 в 1 ч. Следовательно, применение цитофлавина позволило повысить безопасность ТВА при лапароскопической холецистэктомии. Анализ структуры КИ показал, что это произошло в основном за счет снижения их количества со стороны АДс и ЧСС, как интраоперационно, так и в период посленаркозной реабилитации.
Оценка до- и послеоперационных лабораторных данных показала наличие их незначительных, в пределах нормы, колебаний значений внутри групп и отсутствие статистически значимой межгрупповой разницы.
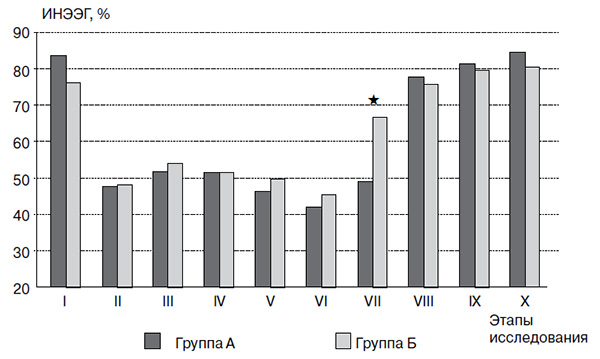
Динамика ИНЭЭГ на этапах исследования в группах.
* — p<0,05 между группами.
Таблица 3
Временные характеристики восстановительного периода
Группа |
Т1, мин |
Т2, мин |
Т3, мин |
Т4, мин |
А (n=15): Б (n=15): M р |
13,68 3,46 1,76
6,74 1,46 0,74 0,0018 |
23,35
15,00 0,0363 |
24,51
15,58 0,0298 |
32,11
19,92 0,0073 |
Примечание. ДИ — доверительный интервал c р=0,95 (±);±m — стандартная ошибка.
Резюмируя обсуждение результатов, полученных в настоящем исследовании, проведенного в соответствии с критериями доказательной медицины, отметим перспективность дальнейшего изучения возможности применения цитофлавина при различных вариантах анестезиологического обеспечения операций различной продолжительности, так как, на наш взгляд, накопление сведений о положительных свойствах препарата способно расширить показания к его назначению в ближайшем будущем.
Выводы.
- При одинаковой продолжительности и однотипности оперативного вмешательства выявлена равная потребность в препаратах для тотальной внутривенной анестезии как при использовании цитофлавина, так и в контрольной группе.
- Применение цитофлавина благоприятно влияет на течение тотальной внутривенной анестезии при операциях средней продолжительности, оказывая кардиопротективное действие и стабилизируя параметры гемодинамики, в большей степени частоту сердечных сокращений.
- Применение отечественного препарата «Цитофлавин» достоверно уменьшает интраоперационную частоту критических инцидентов в 1,8 раза и сокращает их количество в период посленаркозной реабилитации в 2,3 раза, повышая безопасность анестезиологического пособия.
- Использование цитофлавина при тотальной внутривенной анестезии положительно влияет на течение периода посленаркозной реабилитации при лапароскопической холецистэктомии, оказывая нейропротективное действие и достоверно сокращая время пробуждения в 2 раза, а сроки экстубации, ориентированности и готовности больных к переводу — в 1,6 раза.
- Афанасьев В. В. Цитофлавин в интенсивной терапии: Пособие для врачей.—СПб., 2005.—36 с.
- Багненко С.Ф., Батоцыренов Б. В., Горбачев Н. Б. и др. Применение цитофлавина в коррекции метаболических нарушений у больных с разлитым перитонитом в послеоперационном периоде // Вестн. интенс. тер.—2006.—№ 3.—С. 29–32.
- Инструкция по медицинскому применению препарата Цитофлавин® (дата введения 23 декабря 2005 г. по приказу Федеральной службы по надзору в сфере здравоохранения и социального развития).
- Казакова Е.А. Внутренний медицинский аудит на основе регистрации критических инцидентов в отделении анестезиологии многопрофильной клиники: Автореф. дис. … канд.
мед. наук.—М., 2007.—24 с.
- Надирадзе З.З., Бахарева Ю.А., Каретников И.А. Цитофлавин как дополнительный метод защиты миокарда при операциях с искусственным кровообращением // Общ. реаниматол.—2006.—№ 3.—С. 28–32.
- Николаев А.А. Изменения гемодинамики при использовании цитофлавина во время операций коронарного шунтирования на работающем сердце: Автореф. дис. … канд. мед. наук.— СПб., 2005.—24 с.
- Овечкин А.М. Хирургический стресс-ответ, его патофизиологическая значимость и способы модуляции // Регионарная анест. и лечение острой боли.—2008.—№ 2.—С. 49–62.
- Петров О.В. Информационные методы оценки состояния и защиты ЦНС при хирургических операциях: Автореф. дис. … д-ра биол. наук.—М., 1997.—33 с.
- Синьков С.В., Миндияров А.Ю. Влияние цитофлавина на восстановление после общей анестезии при длительных абдоминальных операциях // Клин. и эксперим. исследования.—2006.—№ 1 (7).—С. 10–14.
- Юденкова О., Жуков В. Применение цитофлавина в первые часы развития острой цереброваскулярной ишемии // Врач.—2006.—№ 5.—С. 67–70.
- Aldrete J.A. The post-anesthesia recovery score revisited // J.
Clin. Anesth.—1995.—Vol. 7.—Р. 89–91.
- Buchanan F.F., Myles P.S., Kate Leslie K. et al. Gender and recovery after general anesthesia combined with neuromuscular blocking drugs // Anesth. Analg.—2006.—Vol. 102.—P. 291–297.
- Haller G., Stoelwinder J., Myles P.S., McNeil J. Quality and safety indicators in anesthesia // Anesthesiology.—2009.—Vol. 110.— Р.1158–1175.
- Lubarsky D.A. Fast-track in the postanesthesia care unit: unlimited possibilities // J. Clin. Anesth.—1996.—Vol. 8.—Р.70–72.
- Papadakos P.J., Ritzel G.A. FAST TRACK: What Is It? // Anesthesiol.

