ОБЩИЕ
ЗАКОНОМЕРНОСТИ ГЕМОДИНАМИЧЕСКИХ РЕАКЦИЙ
НА БЫСТРОЕ ИЗМЕНЕНИЕ ВНУТРИБРЮШНОГО ДАВЛЕНИЯ
Бутров А.В., Губайдуллин Р.Р.
Кафедра
анестезиологии и реаниматологии РУДН
Список сокращений
АДд – артериальное давление диастолическое
АДс – артериальное давление систолическое
АДср – артериальное давление среднее
ВБГ – внутрибрюшная гипертензия
ВБД – внутрибрюшное давление
ДНЛЖ – давление наполнения левого желудочка
ОПСС – общее периферическое сопротивление сосудов
СИ – сердечный индекс
УИ – ударный индекс сердца
ЧСС – частота сердечных сокращение
Введение
Патологических состояний в абдоминальной хирургии, связанных с изменением режима ВБД, известно много: кишечные непроходимости различного генеза, перитониты, асцит, онкологические заболевания и др. [7,8,9,10,13]. При этом именно повышение ВБД играет в патогенезе расстройств жизненно важных систем организма, если не ведущую роль, то конкурирует с ключевыми патогенными факторами [3,4,5,11,12,15,16].
Несмотря на разнообразие отмеченных клинических ситуаций, они имеют общий патогенный фактор – повышенное абдоминальное давление, следовательно, могут иметь общие механизмы развития детерменированных симптомов и синдромов. Повышение ВБД может быть на разных этапах лечения: у больных с кишечной непроходимостью – до операции, у больных, оперированных по поводу вентральных грыж, в послеоперационном периоде, при лапароскопиях – интраоперационно. Выделение повышенного внутрибрюшного давления как основного исследуемого патогенетического фактора у разных категорий больных, действующего на различных этапах лечения, позволяет объективизировать закономерности влияния повышенного ВБД на работу сердца и сосудов.
В настоящее время развитие диагностической аппаратуры, возможностей интраоперационного мониторинга позволяет достаточно точно оценить изменения жизненно важных функций организма в ответ на действие того или иного патогенного фактора. Вместе с тем, применение автоматизированных систем накопления и анализа информации с использованием высоких статистик обеспечивает высокую доказательность исследований.
Цель
Показать, что при быстрых, в течение минут, колебаниях ВБД изменения гемодинамического профиля носят типичный характер и мало зависимы от причины, вызвавших эти колебания.
Материал и методы
Для исследования воздействия повышения внутрибрюшного давления на кровообращение были выбраны 3 основные исследуемые группы больных – больные с холециститами, оперируемые лапароскопически (I группа), больные с большими вентральными грыжами, у которых применялись «натяжные» способы закрытия дефекта (II группа) и больные с кишечной непроходимостью (III группа). Повышенное ВБД и изменения ВБД диагностировались на основании данных, полученных с ипользованием зонда для желудочной тонометрии и, или, при прямом измерении ВБД во время лапароскопических манипуляций. Исследования проводились, если фиксировалось изменение давления >10 мм. рт. ст. [14]. Для стандартизации условий выполнялась аналогичная техника анестезии во всех группах.
I основная исследуемая группа включала больных с холециститами, оперированных лапароскопически. Наложение пневмоперитонеума для выполнения лапароскопических манипуляций сопровождалось повышением ВБД до 10-12 мм рт. ст., что регистрировалось манометром лапароскопического оборудования. Контрольная группа состояла из больных с желчекаменной болезнью, оперированных лапаротомно. Больные I основной и ее контрольной групп аналогично распределены по степеням операционно-анестезиологического риска МНОАР-89, ASA, а также шкале кардиального риска Гольдмана.
Больные с большими вентральными грыжами составили II основную исследуемую группу. За большие вентральные грыжи принимались дефекты брюшной стенки или грыжевые выпячивания, имевшие от 16 до 25 см в наибольшем диаметре [2]. Однозначность влияния изучаемого фактора – ВБД определялась тем, что использовались «натяжные» методы закрытия дефектов передней брюшной стенки. Факт повышения ВБД подтверждался инструментально при измерении давления желудочным датчиком – >10 мм. рт. ст. [6] непосредственно после операции. Объективность результатов исследования подтверждена сравнением данных, полученных в II основной и ее контрольной группах. Контрольную группу составили больные с малыми вентральными грыжами (размеры грыжевого выпячивания менее 5 см). Пациенты II основной и ее контрольной групп сопоставимы по возрасту и полу, а также имеют аналогичную структуру сопутствующей патологии.
Больные, имеющие диагноз кишечная непроходимость составили III исследуемую группу больных. Состояние пациентов перед операцией оценивалось по шкале APACHE II. В предоперационном периоде проводился необходимый набор лабораторного и инструментального исследования. Предоперационная подготовка больных с кишечной непроходимостью заключалась в инфузионной терапии, направленной на коррекцию волемических нарушений и нормализацию кислотно-основного и электролитного состояния организма. К III основной исследуемой группе подобрана контрольная группа, которую составили пациенты с перитонитами различного генеза, как правило, оперируемые повторно. Обе группы сопоставимы по полу, возрасту, тяжести состояния – по шкале APACHE II (перед исследованием 18 +/-3 и 19+/-2 соответственно), степени операционного риска по ASA и МНОАР-89. Данные группы отличались уровнем предоперационного ВБД, которое измерялось желудочным датчиком [7,13]. У пациентов с перитонитами ВБД было менее 10 мм рт. ст.
У всех больных исследования проводились на 3 этапах: перед операцией, интраоперационно и в послеоперационном периоде. Сама операция являлась определяющим фактором изменения ВБД в 3 основных группах. – Больные, оперируемые лапароскопически, имели интраоперационное повышение ВБД, за счет введения какого-то объема газа внутрь замкнутого абдоминального пространства. У пациентов с большими вентральными грыжами ВБГ обуславливалась вправлением грыжевого содержимого в брюшную полость и уменьшением объема абдоминального пространства за счет использования «натяжных» методов закрытия дефекта брюшной стенки. У больных с кишечной непроходимостью подъему ВБД способствовало скопление газа и жидкости внутри пищеварительной трубки. В последнем случае лапаротомия, ликвидируя абдоминальный компартмент, т.е. обеспечивая достаточное сообщение брюшной полости с внешней средой, выравнивала ВБД и атмосферное давление.
Состояние центральной гемодинамики исследовалось аппаратно-программным комплексом РЕОДИН 500 НТЦ МЕДАСС по следующим параметрам: СИ; УИ; ОПСС; ДНЛЖ; ЧСС. СИ определялся также методом доплерометрии аппаратом "ИСКН". Измерялась линейная скорость кровотока над дугой аорты. При этом минутный объем кровообращения вычислялся по формуле: МОК = Vлин.*SA*60 /103, где Vлин – средняя линейная скорость кровотока (см/сек) в восходящей части дуги аорты, SА – площадь поперечного сечения дуги аорты (см2). SА определялась по номограмме Фрухта, учитывающей возраст, пол и вес [1]. ЧСС, АДс, АДд и АДср измеряли тахоосцилографическим методом на мониторах «Cardiocap» и «Dinamap-plus». Итоговая обработка результатов проведена с использование пакета программ для статистических исследований: "Statistica v5.0", "Excel 8.0".
Результаты и их обсуждение
В случае пациентов, оперируемых лапароскопически (I основная исследуемая группа, n=48), увеличение ВБД, фиксируемое манометром эндоскопического оборудования, равнялось 11,8±0,16 мм рт. ст. Последнее интерпретируется как степень II ВБГ. Продолжительность острого повышения ВБД, обусловленного наложением пневмоперитонеума, составляла 52±7 мин. Изменения параметров гемодинамики, связанных с подъемом ВБД во время лапароскопических холецистэктомий, представлены в таблице 1. Наполнение брюшной полости газом и, как следствие, повышение ВБД приводило к снижению СИ, ДНЛЖ и УИ с фоновым увеличением ОПСС. Изменения параметров АД характеризовалось также тенденцией к возрастанию. Результаты измерений у пациентов, оперированных лапароскопически достоверно отличались от контрольных параметров и от исходных значений (р<0,05).
Таблица 1.
Гемодинамический профиль во время лапароскопических (1, n1=48, M±m) и лапаротомных холецистэктомий (2, n2=41, M±m)|
|
ЧСС, Мин-1 |
АДс, Мм рт. Ст. |
АДд, мм рт. ст. |
АДср, мм рт. ст. |
СИ, Л/мин∙м2 |
УИ, мл/м2 |
ОПСС, Дин∙с/ см5∙м2 |
ДНЛЖ, мм рт.ст. |
|
| Дооперацион-ные
значения |
1 |
79,7 ±1,8 |
135,1 ±2,6 |
80,4 ±1,8 |
106,3 ±2,1 |
2,89 ±0,07 |
40,3 ±1,4 |
2707 ±36 |
11,4 ±0,4 |
| 2 |
76,4 ±2,3 |
139,4 ±2,2 |
82,7 ±2,3 |
109,2 ±2,2 |
2,90 ±0,06 |
38,5 ±1,5 |
2666 ±41 |
12,0 ±0,4 |
|
| После
наложения пневмопер. |
1 |
92,1 ±2,7* |
147,7 ±2,7* |
88,2 ±3,1* |
114,7 ±1,9* |
2,69 ±0,08* |
31,3 ±1,9* |
3201 ±31* |
9,5 ±0,4* |
| После
лапаротомии |
2 |
85,6 ±3 |
138,3 ±3,1 |
79,4 ±2,7 |
103,3 ±2 |
2,88 ±0,07 |
36,8 ±1,8 |
2791 ±39* |
11,3 ±0,33 |
| Перед ликвидацией Пневмпер. |
1 |
87,0 ±2,8* |
149,6 ±4,5* |
92,1 ±3,9* |
117,7 ±3,0* |
2,45 ±0,10* |
27,3 ±1,8* |
3287 ±47* |
8,3 ±0,39* |
| Перед наложением швов |
2 |
77,9 ±3,3 |
130,5 ±3,9 |
74,7 ±4,3 |
95,2 ±3,5 |
2,97 ±0,09 |
38,9 ±1,6 |
2241 ±39* |
12,1 ±0,31 |
| После заверше-ния опреации |
1 |
82,5 ±3 |
141,4 ±3,6 |
82,8 ±2,9 |
113,4 ±2,5 |
2,91 ±0,08 |
38,1 ±2,1 |
2801 ±51* |
10,6 ±0,37 |
| 2 |
78,9 ±3,1 |
140,4 ±2,9 |
84,5 ±2,7 |
106,1 ±2,8 |
2,79 ±0,12 |
36,5 ±1,7 |
2710 ±40 |
11,3 ±0,3 |
|
Примечание: звездочками отмечена достоверность различий по
отношению к исходным данным (р<0,05), жирным шрифтом выделены
значения показателей, имеющие достоверные различия между группами
(р<0,05).
Таким образом, наложение пневмоперитонеума, или обусловленное этим острое повышение ВБД, ведет к гиподинамическому ответу кровообращения (снижение СИ и УИ), на фоне увеличения ОПСС, АД, ЧСС, снижению ДНЛЖ. Снятие пневмоперитонеума приводило к обратным изменениям.
Как отмечалось, применение «натяжных» методов при пластике больших дефектов брюшной стенки приводит к подъему ВБД. Это связано с тем, что пластика местными тканями грыжевых ворот послеоперационных вентральных грыж, уменьшает объем брюшной полости. Увеличению ВБД способствует и вправление содержимого грыжевого мешка в брюшную полость. Измерения ВБД, проведенные у больных с большими вентральными грыжами в послеоперационном периоде (II основная исследуемая группа, n=42), показали наличие ВБГ. Пик последней соответствовал II степени ВБГ: 10,8 ±1,5 мм рт. ст.
Таблица 2.
Гемодинамические показатели оперированных больных с большими (1) и малыми (2) вентральными грыжами (n1=42, n2=30, М±m)
|
|
ЧСС, Мин-1 |
Адс, мм рт. ст. |
АДд, мм рт. ст. |
АДср, мм рт. ст. |
СИ, Л/мин∙м2 |
УИ, мл/м2 |
ОПСС, дин∙с/ см5∙м2 |
ДНЛЖ, мм рт.ст. |
|
| Перед операцией |
1 |
73,7 ±1 |
140,3 ±2,1 |
84,8 ±1,3 |
106,3 ±2,1 |
2,93 ±0,052 |
39,7 ±1,04 |
2717 ±26 |
13,2 ±0,36 |
| 2 |
75,2 ±1,1 |
136,9 ±1,8 |
83,3 ±1,4 |
102,9 ±1,7 |
2,91 ±0,053 |
41,2 ±1,05 |
2656 ±26,3 |
12,5 ±0,41 |
|
| После операции |
1 |
88,3 ±1,4* |
153,6 ±2,1* |
89,2 ±1,3* |
114,7 ±1,9* |
2,18 ±0,055* |
28,7 ±1,09* |
3220 ±32,8* |
10,1 ±0,50* |
| 2 |
78,8 ±1,2 |
143,6 ±2,0 |
85 ±1,1 |
105,6 ±2,1 |
2,61 ±0,049 |
37,3 ±0,99 |
2909 ±18,6 |
12,3 ±0,4 |
|
Примечание: звездочками отмечена достоверность различий по отношению к исходным данным (р<0,05), жирным шрифтом выделены значения показателей, имеющие достоверные различия между группами (р<0,05).
По результатам измерений состояния гемодинамики у больных, оперированных по поводу больших вентральных грыж, видно, что иcходные данные, как видно из таблицы 2, достоверно не отличались от контрольных значений. Оперативное лечение и, как следствие, острая ВБГ у пациентов II основной группы привели к значимому возрастанию ЧСС, показателей АД, ОПСС и снижению параметров, отражающих производительность сердца и преднагрузку. Подчеркнем, что на послеоперационном этапе все гемодинамические показатели достоверно отличались от исходных параметров и группы сравнения.
У больных с кишечной непроходимостью (III группа) ВБГ определяется переполненным газом и жидкостью кишечником, т.е. несоответствием объема абдоминального компартмента его содержимому. Во время операции брюшная полость непосредственно после лапаротомии и до сшивания краев раны не замкнута. Следовательно, лапаротомия в этом случае обеспечивает выравнивание ВБД с атмосферным. Измерения ВБД перед операцией у больных с кишечной непроходимостью (III основная исследуемая группа, n=51) показали наличие ВБГ в среднем 13,9±0,6 мм рт. ст., что соответствовало II степени по классификации Burch. Всем больным выполнялась срединная лапаротомия, что и обеспечивало быстрое выравнивание внутрибрюшного и атмосферного давления.
В таблице 3 представлены данные, полученные при исследовании гемодинамики у больных с кишечной непроходимостью в периоперационном периоде.
Таблица 3.
Гемодинамический профиль в периоперационном периоде у больных с кишечной непроходимостью (1, n1=51, M±m) и контроля (больные с перитонитами без повышения ВБД) (2, n2=39, M±m)|
|
ЧСС, Мин-1 |
Адс, мм рт. ст. |
АДд, мм рт. ст. |
АДср, мм рт. ст. |
СИ, Л/мин∙м2 |
УИ, мл/м2 |
ОПСС, дин∙с/ см5∙м2 |
ДНЛЖ, мм рт.ст. |
|
| Перед операцией |
1 |
91,7 ±3,2 |
151,4 ±5,6 |
91,4 ±4,8 |
106,3 ±5,0 |
2,41 ±0,11 |
29,2 ±1,7 |
3490 ±56 |
10,4 ±0,4 |
| 2 |
78,1 ±2,3 |
128,5 ±4,9 |
74,2 ±4,7 |
93,3 ±4,3 |
2,88 ±0,10 |
38,3 ±1,4 |
2449 ±51 |
13,7 ±0,5 |
|
| После лапаротомии |
1 |
84,1 ±2,7* |
128,8 ±6,1* |
71,7 ±6,2* |
90,6 ±4,8* |
2,79 ±0,13* |
42,7 ±2,1* |
2578 ±61* |
12,1 ±0,5* |
| 2 |
81,6 ±3,0 |
132,1 ±5,3 |
72,5 ±5,8 |
91 ±4,0 |
2,91 ±0,09 |
40,1 ±2,0 |
2372 ±53 |
12,8 ±0,4 |
|
Примечание: звездочками отмечена достоверность различий по
отношению к исходным данным (р<0,05), жирным шрифтом выделены
значения показателей, имеющие достоверные различия между группами
(р<0,05).
Как
показывает табл. 3, исходный гемодинамический профиль, на высоте
ВБГ, мог характеризоваться как гиподинамический с повышенным ОПСС.
В предоперационном периоде отмечалась также тахикардия и относительное
снижение ДНЛЖ. Повышенными также были параметры АД. Снижение ВБД
13,9±0,6 мм рт. ст. до 0, т.е.
атмосферного, у больных с кишечной непроходимостью обуславливало
увеличение производительности сердца – УИ и СИ с возрастанием преднагрузки
(ДНЛЖ), на фоне снижения ОПСС, параметров АД и уменьшения ЧСС.
Типичность и симметричность относительно условий: нормальное ВБД – ВБГ – декомпрессия, изменения параметров кровообращения у клинически разных групп больных определили необходимость дальнейшего обоснования.
Диаграммы рис. 1-3 отражают состояние центральной гемодинамки при неизменных факторах, влияющих на кровообращение, кроме колебания ВБД.Как видно из рис.1-3 , острое повышение ВБД определяет характерные изменения состояния кровообращения – снижение насосной функции сердца (СИ) и ДНЛЖ с увеличением ОПСС. Быстрое снижение ВБД, также ведет к типичным изменениям, противоположным тем, которые возникают в ответ на повышение ВБД. На рис. 1-3 отображены диаграммы различных клинических ситуаций, при которых имеются быстрые колебания ВБД. Однако, не смотря на различие клинических условий, направленность и относительная симметричность изменений параметров гемодинамики не нарушается в ряду – нормальное ВБД-острая ВБГ-декомпрессия.
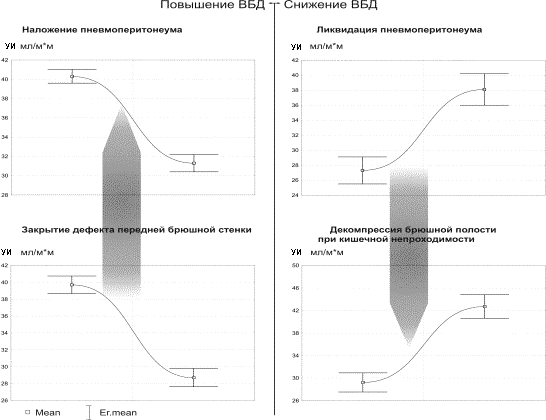
Рис.1. Изменения УИ относительно условий: острая ВБГ-декомпрессия
брюшной полости в различных клинических ситуациях
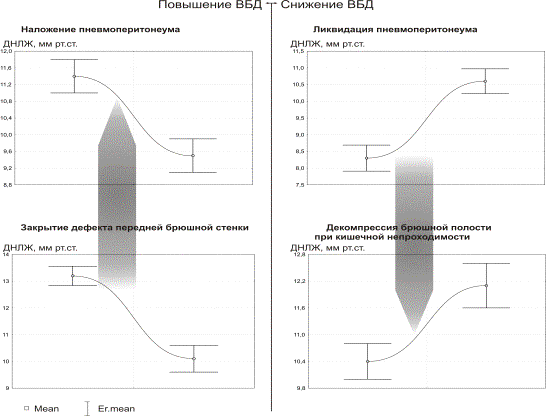
Рис. 2. Изменения ДНЛЖ относительно условий:
острая ВБГ-декомпрессия брюшной полости в различных клинических
ситуациях
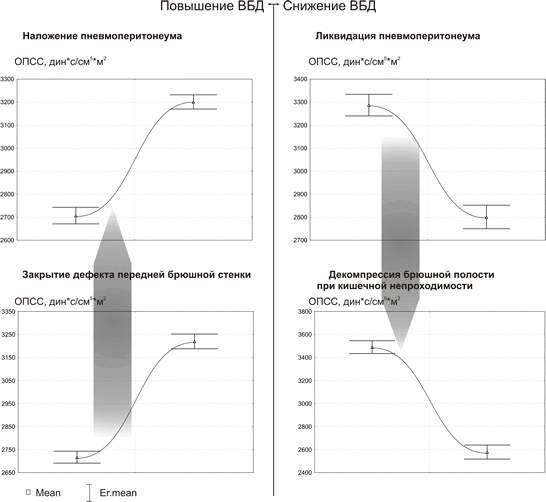
Рис. 3.
Изменения ОПСС относительно условий: острая
ВБГ-декомпрессия брюшной полости в различных клинических ситуациях
В
заключении представим общую картину того, каким образом быстрые
изменения ВБД могут влиять на гемодинамику.
Рост давления в брюшной полости замедляет кровоток по нижней
полой вене и уменьшает венозный возврат. Кроме того, высокое ВБД
оттесняет диафрагму вверх и увеличивает среднее внутригрудное давление,
которое передается на сердце и сосуды. Повышенное внутригрудное
давление уменьшает градиент давлений на миокард и ограничивает диастолическое
заполнение желудочков. Увеличивается давление в легочных капиллярах.
Еще больше страдает венозный возврат и уменьшается ударный объем.
СИ снижается, несмотря на компенсаторную тахикардию. ОПСС растет
по мере увеличения ВБД. Происходит это вследствие прямого сдавливания
обширного сосудистого ложа, а также рефлекторно в ответ на снижение
СИ. При декомпрессии брюшной полости происходят обратные описанным
выше изменения.
Выводы
1) Имеются однонаправленные изменения гемодинамических параметров в ответ на острое повышение внутрибрюшного давления при хирургическом лечении больных с большими вентральными грыжами и при лапароскопиях. Эти изменения выражаются в снижении СИ и ДНЛЖ, повышении ОПСС, АД и ЧСС.
2) Реакция гемодинамики на декомпрессию брюшной полости при хирургическом лечении больных с кишечной непроходимостью и снятии пневмоперитонеума имеет также однонаправленный и аналогичный характер. Изменения противополжны тем, которые наблюдаются при остром повышении ВБД: возрастает СИ и ДНЛЖ, снижается ОПСС, АД и ЧСС.
3) при быстрых, в течение минут, колебаниях ВБД изменения гемодинамического профиля носят типичный характер и мало зависимы от причины, вызвавших эти колебания.
Литература
- Инструментальные методы исследования сердечно-сосудистой системы: Справочник/Т.С.Виноградова, Ф.Д.Акулова, З.Б.Белоцерковский и др.; Под ред. Т.С. Виноградовой. - М.: Медицина, 1986. - С. 340-386.
- Черенько М.П., Влигура Я.С., Яцентюк М.Н., Шпита П.А., Игнатовский Ю.В., Фелештинский Я.П. Брюшные грыжи. – Киев: Здоровья, 1995, - 260с.
- Barnes GE, Laine GA, Giam PY, Smith EE, Granger HJ. Cardiovascular responses to elevation of intra-abdominal hydrostatic pressure. Am J Physiol 1988; 248: R208-R213
- Bloomfield J-GL, Ridings PC, Blocher CR, Marmarou A, Sugerman HJ (1997) A proposed relationship between increased intra-abdominal pressure, intrathoracic, and intracranial pressure. Crit Care Med 25: 496-503.
- Сullen DJ, Coyle JP, Teplick R, Long MC. Cardiovascular, pulmonary, and renal effects of massively increased intra-abdominal pressure in critically ill patients. Crit Care Med, 1989; 17:118-121
- Lacey SR, Bruce J, Brooks SP, Griswald J, Ferguson W, Alien JE, Jewett TC, Karp MP, Cooney DR (1987) The different merits of various methods of indirect measurement of intraabdominal pressure as a guide to closure of abdominal wall defects. J Ped Surg 22: 1207-1211.
- Malbrain MLNG (1999) Abdominal pressure in the critically ill: measurement and clinical relevance. Intensive Care Med 25: 1453-1458.
- Malbrain MLNG (2000) Abdominal pressure in the critically ill. Curr Opinion Crit Care 6: 17-29.
- Malbrain MLNG (2001) Intra-abdominal pressure in the ICU: Clinical Tool or toy? In: Vincent JL (ed) Yearbook of intensive care and emergency medicine. Springer-Verlag, Berlin, pp 547-585.
- Savino JA, Cerabona T, Agarwal N, Byrne D. Manipulation of ascitic fluid pressure in cirrhotics to optimize hemodynamic and renal function. Ann Surg, 1988; Vol. 208, 4: 504-511
- Smith I., Benzie R.J., Gordon N.L.M., Kelman G.R., Swapp G.H. Cardiovascular effects of peritoneal insufflation of carbon dioxide for laparoscopy.//Brit. Med. J., N 3, p.410-411, 1971.
- Sugerman HJ, Bloomfield GL, Saggi BW. Multisystem organ failure secondary to increased intraabdominal pressure. Infection. 1999; 27:61-66
- Sugrue M (1995) Intra-abdominal pressure. Clin Int Care 6: 76-79.
- Sugrue M, Hilman KM (1998) Intra-abdominal hypertension and intensive care. In: Vincent JL (ed) Yearbook of intensive care and emergency medicine. Springer-Verlag, Berlin, pp 667-676.
- Wachsberg RH, Sebastiano LL, Levine CD Narrowing of the upper abdominal inferior vena cava in patients with elevated intraabdominal pressure. Abdom Imaging 1998 Jan-Feb;23(1):99-102
- Windberger
UB, Auer R, Keplinger F, Langle F, Heinze G, Schindl M, Losert
UM (1999) The role of intra-abdominal pressure on splanchnic
and pulmonary hemodynamic and metabolic changes during carbon
dioxide pneumoperitoneum. Gastrointest Endosc 49: 84-91.

