ДЕПАРТАМЕНТ ЗДРАВООХРАНЕНИЯ ПРИ ПРАВИТЕЛЬСТВЕ СВЕРДЛОВСКОЙ ОБЛАСТИ.
ГОРОДСКОЕ УПРАВЛЕНИЕ ЗДРАВООХРАНЕНИЯ ГОРОДА ЕКАТЕРИНБУРГА.
УРАЛЬСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ.
ДЕТСКАЯ ГОРОДСКАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА № 9.
ИНСТРУКТИВНО-МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
ПО ОКАЗАНИЮ ПОМОЩИ ДЕТЯМ С ТЕРМИЧЕСКОЙ ТРАВМОЙ.
г. ЕКАТЕРИНБУРГ 2002
Методические рекомендации составлены на кафедре анестезиологии и реаниматологии ФПК и ПП УГМА (зав. кафедрой д.м.н., профессор Егоров В.М.) и детской хирургии (зав. кафедрой к.м.н., доцент. Цап Н.А.) Уральской государственной медицинской академии.
Инструктивно-методические рекомендации содержат сведения о патогенезе, лечении и прогнозе ожоговой болезни у детей. В брошюре подробно излагается концепция интенсивной терапии, основы этапного хирургического лечения детей с термической травмой.
Составители: к.м.н. Насонова Н.П., Штукатуров А.К.(заведующий ожоговым центром), к.м.н. Марковская О.В., Сайтгалин Г.З., Салистый П.В., Гриценко Д.А.
«Согласовано»: Рецензент, главный Анестезиолог Департамента здравоохранения при правительстве Свердловской области, к.м.н., Левит А.Л., 1. 11. 2001 г.
«Утверждаю»: Главный анестезиолог города Екатеринбурга, Доктор медицинских наук, профессор Руднов В.А., 1. 11. 2001 г.
ВВЕДЕНИЕ
Значение проблемы успешного лечения ожоговой травмы в детском возрасте трудно переоценить. Анализ детского травматизма выявляет растущую роль термической травмы, а проблема ее лечения сложная и требует дифференцированного подхода и комплексного приложения сил многих специализированных служб (Лисицин К.М., Вихриев Б.С. 1984; Алексеев А 1998).
К сожалению, большинство пострадавших детей до сих пор поступают не в специализированные ожоговые центры, а получают интенсивную терапию в стационарах общего профиля в ЦРБ. У большинства погибших от термических поражений детей смерть можно было предотвратить, используя на первом этапе (в ЦРБ, в неспециализированной клинике) весь комплекс лечебных мероприятий, направленный на компенсацию расстройств гомеостаза (Фурман В. 1993; Балох Д., Бензер А 1997).
Целесообразность лечения детей с тяжелой термической травмой в ЦРБ, где лечение не всегда полноценно, а лабораторный контроль недостаточен, сомнительна. Исследования, проведенные в области изучения патогенеза ожогового шока доказывают возможность транспортировки детей в первые сутки после ожога, если они осмотрены детским анестезиологом и комбустиологом на месте и начата противошоковая терапия, которую можно продолжить при транспортировке.
Детский ожоговый центр создан на базе ожогового отделения ДГКБ № 9 и в своей работе непосредственно подчиняется главному врачу. Центр является базой кафедры Анестезиологии и реаниматологии ФПК и ПП УГМА и детской хирургии УГМА. В состав детского ожогового центра входят ожоговое отделение для детей на 20 коек и 4 реанимационные койки в составе отделения реанимации.
На детский ожоговый центр возлагается решение следующих задач:
1. Организация специализированной помощи детям с ожогами и их последствиями в г. Екатеринбурге и Свердловской области.
2. Оказание экстренной плановой стационарной специализированной медицинской помощи детям с термическими поражениями и их последствиями.
3. Оказание лечебно-консультативной помощи больным с ожоговой травмой в Свердловской области по лечению тяжелобольных, их перевод на лечение в ожоговый центр силами Центра медицины катастроф и неотложных состояний.
4. Разработка и внедрение в практическую деятельность методов диагностики, лечения и реабилитации детей с термическими поражениями.
5. Анализ ожогового травматизма в области и разработка рекомендаций по его профилактике.
6. Экспертная оценка организации и качества оказания медицинской помощи в районах и городах области.
7. Проведение диспансеризации лиц, перенесших глубокие и обширные, а также обширные поверхностные ожоги, выполнение у них реконструктивно - восстановительных хирургических вмешательств.
ЭТАПЫ ПОМОЩИ ДЕТЯМ С ТЕРМИЧЕСКОЙ ТРАВМОЙ
В ГОРОДЕ ЕКАТЕРИНБУРГЕ
1 этап - Первая медицинская помощь (скорая помощь, травмпункт, приемные отделения медицинских учреждений, детские хирургические кабинеты поликлиник). Транспортировка бригадой реанимации и интенсивной терапии.
2 этап - Специализированная медицинская помощь - детский ожоговый центр ДГКБ №9.
3 этап - Реабилитация и диспансерный учет (детский ожоговый центр ДГКБ №9, хирурги поликлиник, санаторно-курортное лечение).
ЭТАПЫ ПОМОЩИ ДЕТЯМ С ТЕРМИЧЕСКОЙ ТРАВМОЙ
В СВЕРДЛОВСКОЙ ОБЛАСТИ
1 этап - Первая медицинская помощь (скорая помощь, приемные отделения медицинских учреждений, травмпункты, хирургические кабинеты поликлиник).
2 этап - Квалифицированная помощь (общехирургические и реанимационные отделения ЦРБ и ЦГБ). Транспортировка в детский ожоговый центр ДГКБ №9 (ЦМК и НС).
3 этап - Специализированная медицинская помощь - детский ожоговый центр ДГКБ №9.
4 этап - Реабилитация и диспансерный учет (детский ожоговый центр ДГКБ №9, хирурги поликлиник ЦРБ, педиатры, врачи санаториев).
ОРГАНИЗАЦИЯ ПОМОЩИ ОБОЖЖЕННЫМ В ЦРБ
При поступлении ребенка с термической травмой в ЦРБ начинаются противошоковые мероприятия, возглавляемые заведующим хирургическим отделением или ответственным дежурным врачом, который обязан при поступлении больного немедленно сообщить по телефону в детский ожоговый центр о поступлении тяжело обожженного и получить рекомендации по проведению терапии и дальнейшей тактике лечения.
Вопрос о целесообразности вызова консультантов на место решается специалистом детского ожогового центра и осуществляется Центром медицины катастроф и неотложных состояний (ЦМК и НС).
ОЖОГОВЫЙ ШОК У ДЕТЕЙ.
СОВРЕМЕННОЕ СОСТОЯНИЕ ВОПРОСА.
Ожоговый шок у детей вызывает комплекс патологических изменений, охватывающий практически все жизненно-важные системы. Патологический процесс, в котором ожоговая рана и обусловленные ей висцеральные изменения находятся во взаимосвязи и взаимодействии, представляет собой нозологическую форму, которую принято называть ожоговой болезнью.
Ни одна из многочисленных классификаций ожоговой болезни не является достаточно обоснованной патогенетически, однако, с патофизиологической точки зрения не следует отделять ожоговую болезнь от других состояний, в основе которых лежит синдром системного воспалительного ответа (ССВО). Более того, ожоговая болезнь является наиболее яркой и наиболее точной моделью ССВО. Таким образом, следует разделять ожоговую болезнь на следующие стадии:
- Стадия ожогового шока
- Стадия реперфузионного повреждения тканей
- Стадия локального или генерализованного системного воспалительного ответа
- Стадия полиорганной дисфункции
- Восстановительный период
Стадия ожогового шока.
Современные исследователи отмечают 3 степени шока: легкую (шок первой степени), тяжелую (шок второй степени) и крайне тяжелую (шок третьей степени).
Течение ожогового шока у детей имеет ряд особенностей. Признаки шока проявляются при площади поражения 5-7% поверхности тела. При неадекватной противошоковой терапии возможно развитие рефрактерного шока (устойчивого к инфузионной и инотропной поддержке), длительность которого зависит от характера проводимой терапии и особенностей детского организма.
Причиной тяжести состояния служит слабое противостояние действию тепла, иные, чем у взрослых соотношения между массой тела и площадью кожного покрова, приходящегося на единицу массы. Незавершенность роста, недоразвитие некоторых органов, слабость компенсаторных и защитных механизмов делает организм ребенка несостоятельным перед теми повышенными требованиями, которые вызывает термическое повреждение.
В стадии ожогового шока значительно нарушается целостность энтерогематического барьера, что может служить причиной септического течения ожоговой болезни в связи с транслокацией микрофлоры желудочно-кишечного тракта через эрозии и стрессовые язвы Курлинга в систему кровообращения.
У детей отмечается более выраженная, чем у взрослых плазмопотеря на 1 кг массы тела, развитие дегидратации с изменением функции выделительных систем и сдвигом осмолярности плазмы крови.
Депонирование крови в малом круге кровообращения с увеличением транскапиллярного транспорта жидкости в интерстициальную ткань легких с развитием дыхательной недостаточности также является отличительным признаком течения ожогового шока у детей.
При ожогах до 15% поверхности тела изменения, происходящие в трахеобронхиальном дереве, обратимы. При ожогах, превышающих по площади 15%, запускаются “порочные круги”, начинается отек, разрыв капилляров, газообмен становится недостаточным, возникают застойные и воспалительные изменения.
Характерной чертой современного ожогового шока у детей является отягощенный преморбидный фон. Так, по данным ряда авторов (Нуштаев И., Нуштаев А. 1997) и собственным наблюдениям количество детей с отягощенным преморбидным фоном за последние 5 лет увеличилось в 3 раза и составляет 54-56% среди поступивших в отделение реанимации.
ПАТОГЕНЕЗ ОЖОГОВОГО ШОКА
С современной патофизиологической точки зрения ожоговый шок наиболее часто рассматривается как гиповолемический. Гиповолемия и связанная с ней гемоконцентрация в значительной мере изменяют динамическую вязкость крови и условия ее прохождения через микроциркуляторное русло. Не корригируемая гиповолемия за счет снижения венозного возврата крови приводит к гипотонии, что, в свою очередь, нарушает адекватную перфузию тканей, возникает органная гипоксия (Альес В.Ф., Андреев А.Г., Ульянова Г.И., Гранова Л.В., Астамиров М.К. 1998).
Ухудшение микроциркуляторной перфузии, наблюдающееся в период шока, сопровождается гипоксией - аноксией, циркуляторным спазмом, микротромбозом, накоплением органических кислот, продуктов перекисного окислениея липидов (ПОЛ) и прямым повреждением тканей.

Рис. 1. Частота дисфункции ЖКТ в зависимости от длительности шока
При продолжительности шока до 20 часов не выявлено симптомов дисфункции желудочно-кишечного тракта ни у одного пациента, в то время как при шоке длительностью более 60 часов патологические симптомы выявлены у 49,3% детей.

Рис. 2. Частота развития печеночной дисфункции в зависимости от продолжительности шока.
Меньшая продолжительность шока ведет и к меньшему повреждению гепатоцитов: дисфункция развивается реже, если продолжительность шока менее 20 часов (9,5% случаев).
Длительность ожогового шока зависит не только от возраста пострадавшего, площади и глубины поражения. На его продолжительность оказывают влияние самые разнообразные факторы: качество и объем инфузионной терапии, наличие или отсутствие протезирования жизненно-важных функций, и длительность догоспитального времени. В этой связи ведущая роль отводится максимально ранней госпитализации в специализированный центр.
Частота осложнений ожоговой болезни в зависимости от сроков госпитализации в специализированный центр представлена в таблице 1.
Таблица 1.
ЧАСТОТА ОСЛОЖНЕНИЙ В ЗАВИСИМОСТИ ОТ ВРЕМЕНИ
НАЧАЛА ОКАЗАНИЯ СПЕЦИАЛИЗИРОВАННОЙ ПОМОЩИ
ОСЛОЖНЕНИЯ |
НАЧАЛО СПЕЦИАЛИЗИРОВАННОЙ ПОМОЩИ |
||
До 24 часов, |
25-48 часов, |
> 48 часов, |
|
Сепсис, % |
44 19,7% |
76 55,8% |
76 66,6% |
ОРДС, % |
114 51,1% |
96 70,5% |
76 66,6% |
СПОН, % |
142 63,6% |
100 77,9% |
114 100% |
Пневмония, % |
23 10,3% |
14 10,2% |
12 10,5% |
С увеличением времени, потребовавшегося на госпитализацию в специализированный центр, как правило, растет количество осложнений. Так, отсрочка с госпитализацией на 1 сутки ведет к повышению вероятности развития сепсиса в 2,8 раза, ОРДС в 1,3 раза, а СПОН в 1,2 раза. Задержка на двое и более суток повышает вероятность развития сепсиса в 3,3 раза, ОРДС в 1,3 раза и СПОН в 1,6 раз.
Стадия реперфузионного повреждения тканей.
Вслед за стадией ожогового шока наступает период, когда из спазмированных ранее сосудов в центральный кровоток попадают метаболиты, накопившиеся за время шока. В настоящее время известно уже около 200 таких веществ. Основными из них являются:
Цитокины - низкомолекулярные белки, чья биологическая активность осуществляется через специфические рецепторы , расположенные на клеточных мембранах. Наиболее значимыми являются фактор некроза опухоли (TNF) и интерлейкины 1,6, 10. Они способны оказывать как местное так и дистальное воздействие (на отдаленные органы и ткани). Общим для всей группы является усиление адгезии и агрегации лейкоцитов, а также гиперкатаболический и гипердинамические эффекты. Именно цитокины являются медиаторами первого ряда, которые сами способны вызывать каскады гуморальных реакций.
Основными цитокинами, отвечающими за стимуляцию системного ответа в острой фазе являются интерлейкин - 1, интерлейкин 6 и фактор накроза опухоли, при этом интерлейкин - 6 играет доминирующую роль. Первичное действие цитокинов направлено на изменение генного ответа . TNF и интерлейкин - 1 показали способность к прямому транскрипционному воздействию на продукцию интерлейкина - 6. В других случаях было отмечено синергичное действие интерлейкина - 1 и 6 , приводящее к развитию максимального ответа на повреждение. Под воздействием высоких концентраций цитокинов фактора некроза опухоли, интерлейкинов –1 и 6 , интерферона - гамма у экспериментальных животных происходили существенные изменения в общем пуле свободных аминокислот плазмы . При этом установлена зависимость между уровнями цитокинов и ряда аминокислот - аргинина, орнитина,глутамина, фенилаланина, пролина, аланинa - а также выраженностью катаболизма, расстройствами кислородного транспорта,функциональными нарушениями в жизненно важных органах .
Эйкосаноиды - продукты распада арахидоновой кислоты. К ним относят тромбоксаны , лейкотриены, эпоксиды. Совокупные эффекты характеризуются развитием бронхоконстрикции,повышенной проницаемостью мембран, микротромбозом, адгезией, агрегацией , дегрануляцией лейкоцитов.
Оксид азота ( NO ) - эндотелий-расслабляющий фактор, вазодилататор воздействующий через систему гуанилатциклазы и вызывающий вазоплегию, часто сопровождающую клинику рефрактерного шока.
Интерфероны - низкомолекулярные белки , активирующие эндотелий, способствуют выбросу других цитокинов, образованию факторов роста.
Фактор активирующий тромбоциты - усиливает агрегацию тромбоцитов и нейтрофилов. Он способствует освобождению оксидантов, образованию продуктов цикло- и липооксигеназы в метаболизме арахидоновой кислоты. Непосредственное воздействие приводит к вазоконстрикции и дилатации, повышению проницаемости легочных и системных сосудов.
Фибронектин - белок, существующий в двух основных формах. Тканевая - обеспечивает непроницаемость волокон и соединений клеток. Циркулирующая - вызывает адгезию частиц, подлежащих уничтожению, к макрофагам и эндотелию.
Кислородные радикалы - повреждают эндотелиальную мембрану,клетки легочного интерстиция, участвуют в образовании хемотаксического липида , притягивающего лейкоциты .
Все перечисленные и многие другие вещества являются факторами, обусловливающими развития СПОН при термической травме.
Стадия локального или генерализованного системного воспалительного ответа.
Высвобождающиеся стресс - детерминированные протеины обладают цитотоксическим эффектом. Происходит запуск синдрома системного воспалительного ответа и под воздействием провоспалительных факторов разыгрывается так называемый “цитокиновый шторм”. Суммарные эффекты, оказываемые медиаторами повреждения, формируют генерализованную системную воспалительную реакцию или синдром системного воспалительного ответа - ССВО. Клиническими критериями развития ССВО являются следующие:
- температура тела больше 38oС или менее 36oС
- частота сердечных сокращений более 90 в минуту
- частота дыханий более 20 в минуту или артериальная гипокапния менее 32 мм рт ст
- лейкоцитоз более 12 000 в мм или лейкопения менее 4 000 в мм, или наличие более 10 % незрелых форм нейтрофилов
Выделяют три стадии развития ССВО : Стадия 1. - Локальная продукция цитокинов в ответ на травму или инфекцию. Цитокины способны выполнять ряд защитных функций, участвуя в процессах заживления ран и защиты клеток организма от патогенных микроорганизмов. Стадия 2. Выброс малого количества цитокинов в системный кровоток. Даже малые количества медиаторов способны активизировать макрофаги, тромбоциты, продукцию гормона роста. Развивающаяся острофазовая реакция контролируется провоспалительными медиаторами и их эндогенными антагонистами, такими как антагонисты интерлейкина -1, 10, 13, фактора некроза опухоли. За счет баланса между цитокинами, антагонистами медиаторных рецепторов и антителами в нормальных условиях создаются предпосылки для заживления ран, уничтожения патогенных микроорганизмов, поддержания гомеостаза. Стадия 3 . Генерализация воспалительной реакции. В том случае, если регулирующие системы не способны поддерживать гомеостаз, деструктивные эффекты цитокинов и других медиаторов начинают доминировать, что приводит к нарушению проницаемости и функции эндотелия капилляров, формированию отдаленных очагов системного воспаления, развитию моно- и полиорганной дисфункции.
ССВО представляет собой симптомокомплекс, характеризующий выраженность воспалительной реакции в системе эндотелиоцитов, а, следовательно, и направленность воспалительного ответа на повреждение. Ряд исследований подтвердил, что основу патогенеза ПОН составляет именно диссеминированная воспалительная реакция, сопровождающаяся активацией и выбросом большого количества биологически активных соединений.
Стадия полиорганной дисфункции.
Впервые термин ”полиорганная недостаточность” (ПОН) вошел в клиническую практику после публикации работы N.Тylney и сотр. (1973) ”Последовательная системная недостаточность после разрыва аневризмы брюшной аорты. Нерешенная проблема послеоперационного лечения”. Позже А.Baue (1975), а далее B.Eisman (1977) и D. Fry (1980-1982) окончательно сформировали особенности этого состояния.
В нашей стране большой вклад в изучение патогенеза и разработку методов диагностики, профилактики и лечения ПОН внесли Е.С.Золотокрылина, Ю.Н.Шанин, А.П.Зильбер, В.Л.Кассиль, В.А. Гологорский, Б.Р.Гельфанд, О.А. Долина, Р.Н. Лебедева и другие. Сегодня мы понимаем под ПОН тяжелую неспецифическую стресс - реакцию организма.
ПОЛИОРГАННАЯ НЕДОСТАТОЧНОСТЬ ( ПОН ) - недостаточность двух и более функциональных систем, универсальное поражение всех органов и тканей организма агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной недостаточности - легочной, сердечной, почечной и т.д. Основной особенностью ПОН является неудержимость развития повреждения органа жизнеобеспечения или системы до такой глубины, после достижения которой приходиться констатировать неспособность органа функционировать в интересах поддержания жизненно важных функций вообще и сохранения своей структуры в частности. Непосредственными факторами, определяющими выраженность полиорганной дисфункции, являются различная способность органов противостоять гипоксии и снижению кровотока, характер шокового фактора и исходное функциональное состояние самого органа.
По данным северо-американских исследователей ПОН уже в течение 20 лет остается основной причиной смерти среди пациентов палат интенсивной терапии и реанимации хириргических стационаров и занимает около 75-80 % общей летальности. При этом средняя длительность пребывания больного с ПОН в хирургических палатах интенсивной терапии составляет 21 день, а затраты на лечение порядка 85 000 американских долларов. Общие финансовые вложения у выживших и прошедших реабилитацию пациентов приближаются к сумме в 300 000 американских долларов.
В развитии синдрома ПОН выделяют три основных фазы: 1. Индукционную фазу , результатом которой является синтез целого ряда гуморальных факторов, запускающих реакцию системного воспалительного ответа; 2. Каскадную фазу , сопровождающуюся развитием острого легочного повреждения, активацией каскадов калликреин - кининовой системы, системы арахидоновой кислоты, свертывающей системы крови и других; 3. Фазу вторичной аутоагресии , предельно выраженной органной дисфункции и стабильного гиперметаболизма, в которую организм больного теряет способность к самостоятельной регуляции гомеостаза. Инициирующий фактор, запускающий выброс медиаторов системного воспаления может быть самым разным по происхождению - это инфекция, травма, ишемия, кровопотеря, ожоги.
Таблица 2.
СТРУКТУРА ОРГАННОЙ ДИСФУНКЦИИ У ДЕТЕЙ С ТЕРМИЧЕСКОЙ ТРАВМОЙ
CИСТЕМЫ |
S до 20% |
S 21-30% |
S 31-40% |
S > 40% |
Всего |
Респираторная |
54 45,0% |
72 60,0% |
99 85,3% |
113 96,5% |
338 71,4% |
С\сосудистая |
63 52,5% |
81 67,5% |
90 77,5% |
104 88,8% |
338 71,4% |
ЦНС |
33 27,5% |
49 40,8% |
61 52,5% |
68 58,1% |
211 44,6% |
Почки |
36 30,0% |
48 40,0% |
67 57,7% |
73 62,4% |
224 47,3% |
Печень |
21 17,5% |
19 15,8% |
34 29,3% |
59 50,4% |
207 43,7% |
ЖКТ |
27 22,5% |
44 36,6% |
76 65,5% |
76 64,9% |
223 47,1% |
Гемостаз |
21 17,5% |
21 17,5% |
32 27,5% |
66 56,4% |
140 29,5% |
Осложнения: |
|
|
|
|
|
При изучении структуры ПОН у детей с термической травмоймы обнаружили следующее: из исследованных 473 пострадавших у 338 пациентов (71,4%) мы диагностировали развитие сердечно-сосудистой дисфункции и у такого же количества – респираторной. На втором месте по частоте развития находятся дисфункция центральной нервной системы, острая почечная недостаточность, острый токсический (или гипоксический) гепатит и дисфункция ЖКТ, связанная с СКН и гиперметаболизмом. На их долю приходится соответственно 44,6%, 47,3%, 43,7% и 47,1%.
На третьем месте по частоте развития находятся патология системы гемостаза (29,5% случаев). Следует отметить, что площадь поражения является одним из определяющих факторов развития СПОН. Так, при поражениях от локальных до распространенных частота развития недостаточности со стороны различных систем возрастает в 2-3 раза.
Наиболее тяжелое проявление ПОН – развитие Острого респираторного дистресс-синдрома (ОРДС) . ОРДС - это неспецифическое поражение легких, связанное с повреждением эндотелия активными медиаторами, приводящее к прогрессирующей кислородозависимой гипоксии, возникающей вследствие снижения легочного комплайнса, блока диффузии кислорода через альвеоло-капиллярную мембрану, венозно-артериального шунтирования крови и требующая в большинстве случаев ИВЛ и других методов коррекции кислородо-транспортной функции крови (Шанин В.Ю. 1997; Альес В.Ф., Андреев А.Г., Астамиров М.К. 1998).
Данные, полученные при изучении окислительно - восстановительных реакций на клеточном уровне, позволяют высказать предположение о ферментативных сдвигах в цикле Кребса, ведущих к нарушению внутриклеточного транспорта кислорода ( Doughty L . A ., Kaplan S . S ., Carcillo J . A . 1996). При этом у большинства обожженных, начиная с первых часов шока и на
всем его протяжении, растет потребление О2 от 120 до 200% по отношению к уровню здорового человека. Несмотря на это, кислородный запрос организма при ожоговом шоке остается неудовлетворенным, о чем свидетельствует накопление в крови пировиноградной и молочной кислот, развитие компенсированного или некомпенсированного ацидоза ( Luce P . V . 1998).
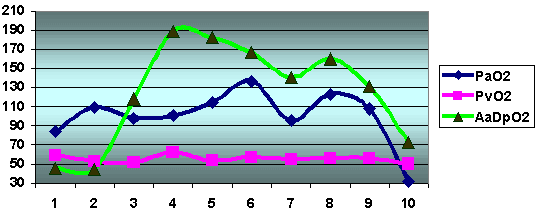
Рис.3. Транспорт кислорода через альвеоло-капиллярную мембрану при ОРДС.
Как видно из представленного рисунка, нарушение транспорта кислорода через альвеоло-капиллярную мембрану нарастрает постепенно. В период ожогового шока (первые-вторые сутки) альвеоло-артериальная разность по кислороду ( AaDpO 2) находится в пределах нормы. С третьих по пятые сутки – в период реперфузионного повреждения тканей AaDpO 2 растет. Второй пик данного показателя отмечается в срок с седьмых по девятые сутки, что соответствует разгару проявлений ПОН. Те же тенденции отмечены нами и при исследовании парциального напряжения кислорода в артерии (РаО2) и не обнаружены в вене (PvО2).
Сердечно-сосудистая система, в наибольшей степени страдающая у детей в состоянии ожогового шока, является основным звеном в патогенезе нарушений транспорта кислорода. Находясь в тесной связи с дыхательной, сердечно-сосудистая система ответственна не только за насосную функцию. В основе дисфункции сердечно-сосудистой системы лежит нарушение как доставки, так и потребления кислорода.
Гемодинамический профиль каждого конкретного больного определялся взаимодействием ряда факторов: фоновым состоянием и типом системы кровообращения (гипокинетическим, эукинтическим и гиперкинетическим), тяжестью травмы и длительностью догоспитального времени, объемом и характером предшествующей терапии, глубиной и локализацией ожога (в области так называемых «шокогенных» зон или вне их).
Почечная дисфункция у детей с термической травмой находится на третьем месте - 47,3% пострадавших. Угнетения выделительной функции почек затрудняет поддержание нормального уровня концентрации водородных ионов в крови.
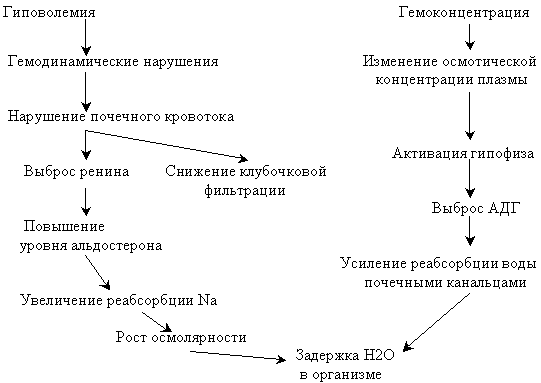
Рис. 4 ПАТОГЕНЕЗ НАРУШЕНИЯ ФУНКЦИИ ПОЧЕК ПРИ ОЖОГОВОМ ШОКЕ
Задержка жидкости в организме (в интерстициальной ткани) приводит к уменьшению экскреции ионов водорода с мочой, формируются нарушения КОС. При легком течении шока сдвиги в системе КОС ограничиваются увеличением дефицита оснований и некоторым снижением содержания углекислоты в крови при нормальном уровне рН, то в более тяжелых случаях буферные системы не в состоянии компенсировать увеличение концентрации водородных ионов, происходит сдвиг рН в кислую сторону. Чем тяжелее шок, тем более выражено снижение щелочного резерва, тем более выражен ацидоз ( Reinhart K ., Hanneman L ., Meir - Hellmann A ., Specht M . 1994).
Степень изменения КОС - не только показатель тяжести ожогового шока. От уровня рН крови во многом зависят все обменные процессы организма, являющиеся ферментативными. Следовательно, постоянство рН крови представляет собой непременное условие борьбы с ожоговым шоком.
В настоящее время доказана патогенетическая роль усиления свободно-радикального перекисного окисления липидов при многих патологических процессах, особенно у больных в “критических” ситуациях, у которых свободно-радикальные процессы протекают наиболее интенсивно, а защитные механизмы, направленные на связывание токсических метаболитов, снижены.
Индукторами этих процессов способны выступать токсины, находящиеся в организме. Известна их роль в повышении общего периферического сопротивления сосудов и нарушении микроциркуляции, а также в нарушении сократительной способности миокарда, в уменьшении сердечного выброса. Накопление перекисей благоприятствует тромбообразованию, способствует диссеминированному внутрисосудистому свертыванию крови, свойственных шоковому процессу.
ДИАГНОСТИКА ОЖОГОВОГО ШОКА.
С целью диагностики ожогового шока мы рекомендуем использовать таблицу Попова А.А. в модификации Екатеринбургского детского ожогового центра, которая отражает комплексный подход к определению состоятельности всех жизненно-важных систем организма.
Таблица 3.
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ОЖОГОВОГО ШОКА
Признаки |
Шок 1 степени |
Шок 2 степени |
Шок 3 степени |
| 1. Нарушения поведения или сознания. | Возбуждение | Чередование возбуждения и оглушения | Оглушение – сопор – кома |
| 2. Изменения гемодинамики. А) ЧСС Б) АД В) ЦВД Г) микроциркул. |
|
|
|
| 3. Дизурические расстройства. | Умеренная олигурия. | Олигурия. | Выраженная олиго- или анурия |
| 4. Гемоконцентрация. | Гематокрит до 43% | Гематокрит до 50% | Гематокрит выше 50% |
| 5. Метаболические расстройства (ацидоз) | ВЕ 0 - -5 ммоль\л | ВЕ-5 - -10ммоль\л | ВЕ > -10 ммоль\л |
| 6.Расстройства функции ЖКТ. А) Рвота Б) Кровотечения из ЖКТ |
|
|
|
Вышеуказанные симптомы, выявленные в первые двое суток после ожога, позволяют с уверенностью диагностировать шок, но отсутствие некоторых перечисленных признаков не может быть основанием для исключения шока. В равной мере нет четких критериев и для определения степени тяжести шока. Следует учитывать признаки, при первом осмотре говорящие о тяжелом течении ожогового шока: общую площадь ожога более 30%, симптомы поражения органов дыхания, многократную рвоту, нельзя игнорировать и отягощенный преморбидный фон, отрицательно влияющий на прогноз ожоговой болезни.
Проследим, какое влияние оказывает сопутствующая патология на течение ожоговой болезни при поражении различной тяжести (табл. 4).
Таблица 4.
ВЛИЯНИЕ ОТЯГОЩЕННОГО ПРЕМОРБИДНОГО ФОНА
НА ХАРАКТЕР ТЕЧЕНИЯ ОЖОГОВОЙ БОЛЕЗНИ
( S поражения до 20%)
Осложнения |
Больные с отягощенным фоном |
Больные с неотягощенным фоном |
СПОН, % |
60,8% |
47,0% |
Пневмония, % |
17,4% |
4,3% |
C епсис, % |
30,4% |
17,6% |
ОРДС, % |
52,2% |
35,3% |
В таблице представлена частота развития осложнений ожоговой болезни у детей с отягощенным и неотягощенным преморбидным фоном. Данные таблицы демонстрируют, что у детей с отягощенным фоном, получивших ожог площадью до 20% поверхности тела, в 4 раза чаще развивается пневмония, в 1,8 раз чаще – сепсис и в 1,5 раза чаще - ОРДС.
В таблице 5 представлены дети с поражением 31-40% поверхности тела.
Таблица 5.
ВЛИЯНИЕ ОТЯГОЩЕННОГО ПРЕМОРБИДНОГО ФОНА
НА ХАРАКТЕР ТЕЧЕНИЯ ОЖОГОВОЙ БОЛЕЗНИ
(S поражения 31-40%)
|
Осложнения |
Больные с отягощенным фоном |
Больные с неотягощенным фоном |
СПОН, % |
95,6% |
76,4% |
Пневмония, % |
13,0% |
0% |
C епсис, % |
60,8% |
41,2% |
ОРДС, % |
82,6% |
64,7% |
Пациенты с отягощенным преморбидным фоном, получив поражение площадью 31-40% поверхности тела в 3 раза чаще переносят пневмонию, в 1,5 раза чаше – сепсис и в 1,3 раза – ОРДС.
Дети дошкольного возраста тяжело переносят ожоги меньшей площади, особенно те из них, начало противошоковой терапии у которых запоздало.
ПРОТИВОШОКОВЫЕ МЕРОПРИЯТИЯ НА ДОГОСПИТАЛЬНОМ ЭТАПЕ.
- Прекращение температурного воздействия.
- Обливание пораженного участка струей холодной воды.
- Наложение стерильных повязок с противоожоговой жидкостью или с раствором антисептика.
- Обезболивание наркотическими анальгетиками.
- При необходимости - медикаментозный сон.
ПРОТИВОШОКОВАЯ ТЕРАПИЯ.
Чем раньше начата противошоковая терапия, тем лучше прогноз. Первые 24 часа определяют дальнейшее течение ожоговой болезни, ошибки в терапии становятся роковыми. Течение ожогового шока и развитие полиорганной дисфункции находятся в тесной взаимосвязи.
Выделение “группы риска” по развитию витальных нарушений позволяет мобилизовать усилия, направленные на выживание. В “группу риска” входят дети до 7 лет, с отягощенным преморбидным фоном, дети с ожогом более 30% поверхности тела (не зависимо от характера травмирующего агента), дети, получившие ожоги, осложненные термо-ингаляционной травмой (практически все ожоги пламенем) и дети, доставленные в специализированный центр позже 24 часов с момента травмы.
Основные условия противошоковой терапии:
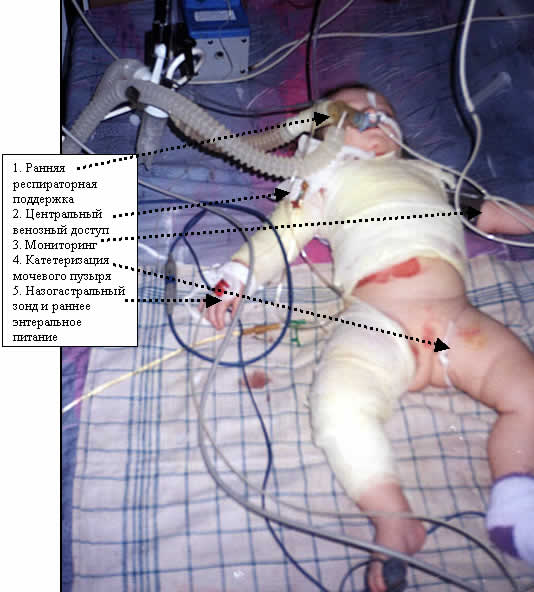
1. Осуществление центрального венозного доступа: катетеризация по Сельдингеру подключичной, бедренной или внутренней яремной вены, диаметр катетера 0,6 или 1,0 мм. Фиксация его к подлежащим тканям производится лейкопластырем. При невозможности катетеризации через здоровую кожу катетер проводится через ожоговую поверхность и фиксируется нитью.
2. Положение больного - на сетке, натянутой на металлический каркас. Аэрация ран препятствует быстрому инфицированию, так как сокращается объем плазмопотери.
3. Микроокружение больного: с целью поддержания температуры тела у детей в состоянии ожогового шока необходимо инфракрасное облучение (установка “лучистое тепло”) или подогрев снизу через сетку тепловентилятором.
4. Установка назо - гастрального зонда (контроль содержимого желудка) с целью ранней диагностики стрессовых язв Курлинга, а также введения антацидов. Энтеральное питание начинается после ликвидации микроциркуляторного спазма и гиповолемии (в среднем к концу первых суток). В зонд начинают вводить полисубстратные смеси (например, гидролизат казеина или раствор глюкозы 5-10% с электролитами) а затем адаптированные смеси (“Альфаре”, “Эншур”, “Изокал”), содержащие все необходимые компоненты в расщепленном виде. Нутритивную поддержку можно также сразу начать с введения адаптированных молочных смесей.
5. Катетеризация мочевого пузыря производится с целью контроля почасового диуреза. Каждые 6 часов катетер промывается стерильным раствором фурациллина.
Медикаментозная терапия:
Основа противошоковой терапии - адекватная своевременная регидратация больного с целью обеспечения адекватной перфузии тканей.
Расчет инфузионной терапии наиболее легко и быстро можно произвести по используемой во всем мире формуле Паркланда:
Дети до 3 лет: 5 х м тела (кг) х площадь ожога в % + физ. потребность.
Дети старше 3 лет: 3 х м тела (кг) х площадь ожога в % + физ. потребность.
Существует модифицированная формула Паркланда с учетом тяжести шока:
N х м тела х % ожога + физ. потребность, где N - тяжесть шока (1,2 или 3).
При термо-ингаляционной травме к площади ожога прибавляется 15%.
Первые 8 часов переливается 1\2 расчетного объема (отсчет начинается с момента получения травмы), вторые 16 часов вводится вторая половина объема.
При шоке 1 степени регидратация производится следующими средами:
глюкоза 5% или 10% : солевые растворы = 1:1.
При тяжелом шоке и у детей в возрасте до 3 лет с отягощающими факторами регидратационная формула следующая:
Глюкоза 10% |
Реополиглюкин |
Криоплазма |
|
50% |
20% |
15% |
15% |
В раствор глюкозы включаются ингибиторы протеолиза (Контрикал от 10 до 40 тыс.ед., Гордокс в дозе 100 – 300 тыс.ед.), Новокаин, Курантил (1,25 – 2,5 мг\кг\сут). Реополиглюкин и криоплазму можно заменить препаратом на основе желатина - Гелофузином или на основе гидроксиэтилкрахмалакрахмала – Рефортаном и Стабизолом. С их использованием регидратационная формула выглядит следующим образом:
Глюкоза 10% |
Солевые растворы |
Рефортан, Стабизол |
50% |
20% |
30% |
При тяжелом ожоговом шоке необходим строгий контроль над степенью регидратации организма, так как перенасыщение жидкостью приводит к развитию отека легких и мозга. При угрозе гипергидратации и необходимости восстановления микроциркуляции при помощи мобилизации жидкости из интерстициальной ткани используется регидратационная терапия малыми объемами, а именно, с использованием 7,2% - 7,5% раствора NaCl в расчете 4 мл х вес тела болюсно в течение 5 – 20 минут. После болюсного введения гипертонического раствора производится контроль электролитного состава крови и гематокрита, затем выполняется перерасчет объема инфузии. Помимо применения гипертонического раствора у больных с критическими ожогами необходима компенсация синдрома трансминерализации применением глюкокортикостероидов – это единственное (на наш взгляд) показание для их применения у больных с термической травмой.
Обезболивание осуществляется внутривенно наркотическими анальгетиками (Промедол из расчета 0,1мл 1% раствора на год жизни) в сочетании с антигистаминными препаратами (Димедрол, Супрастин, Пипольфен в расчете 1 мг на килограмм массы тела, но не более 1 мл.) Кратность введения 4-6 раз в сутки.
Изменения в системе гемостаза в период ожогового шока выражаются в основном в виде гиперкоагуляции (повышается концентрация фибриногена, происходит рост ПТИ и активированного парциального тромбопластинового времени). Усиление внутрисосудистого свертывания крови и спонтанной агрегации тромбоцитов приводит к микроциркуляторному блоку в системе капилляров кожи и паренхиматозных органов.
Как показали исследования, применение Гепарина не влияет на скорость выхода из шока, также, как не приводит и к коррекции реологических свойств крови, а в условиях нарушенной трофики кишечной стенки и угрозы кишечного кровотечения чревато развитием геморрагического синдрома.
Коррекцию реологических расстройств крови предпочтительно осуществлять Реополиглюкином и естественными ингибиторами протеолиза (Контрикал, Гордокс). Применение этих препаратов также позволяет активировать репаративные процессы в ране.
Трансфузии криоплазмы благоприятно влияют как на реологические свойства крови так и на коллоидно-осмотическое равновесие в организме обожженного. С третьих суток при глубоких и обширных ожогах необходимы трансфузии иммунной (антистафилококковой, антисинегнойной) криоплазмы как с целью замещения, так и с целью иммунокоррекции. Применение кровезаменителей (таких, как Гелофузин, Рефортан, Стабизол) позволяет существенно уменьшить объем компонентов крови, если лечение начато своевременно.
Инотропная поддержка миокарда осуществляется детям с площадью ожога более 15% поверхности тела, в связи с развивающейся у них диастолической дисфункцией миокарда. Допмин в дозе 3 мкг\кг\мин вводится микроструйно круглосуточно дозатором или добавляется в инфузионные растворы.
Необходимым условием противошоковой терапии является оптимизация кислородного статуса .
Вариантом выбора является назотрахеальная интубация с переводом на вспомогательную ИВЛ с поддержкой на вдохе и концентрацией кислорода во вдыхаемой смеси с постепенным снижением Fi О2 с 0,45 - 0,6 до 0,3.
Показания к ИВЛ при наличии современной дыхательной аппаратуры в интересах больного могут быть расширены относительно традиционных. Это:
1. Развитие тяжелого шока не зависимо от площади и глубины поражения на отягощенном преморбидном фоне или при наличии факторов неблагоприятного прогноза.
2. Недостаточность функции хотя бы одной из систем, например, макрогематурия, кровотечение из стрессовых язв Курлинга.
3. Наличие клинических или доклинических признаков ОРДС : (шунтирование крови более 12%, SO 2 менее 94%, РаО2 ниже 80 мм рт ст, РаО2\ Fi О2 ниже 370 мм рт ст).
Ранняя респираторная поддержка позволяет оптимизировать противошоковую терапию, (ускоряя выход детей из шока), позволяет со вторых суток начать оперативное лечение, сокращает срок лечения детей в реанимационном отделении. В отделении реанимации детского ожогового центра г. Екатеринбурга средний срок пребывания детей с тяжелой термической травмой благодаря ранней респираторной поддержке снизился с 23,2 +\- 3,1 сут. до 11,3 +\- 2,0 сут., общий койко-день с 54,9 +\- 4,2 сут. до 38,6 +\- 3,6 сут.
Режим ИВЛ выбирается в зависимости от времени начала противошоковой терапии и механизма травмы. У детей с изолированным поражением кожи рекомендуется использовать режим синхронизированной перемежающейся принудительной вентиляции легких ( SIMV ) с поддержкой давлением до +18 см Н2О и сеансами РЕЕР до 3,5 см Н2О по 30 минут не менее 5 раз в сутки. У детей с поздним поступлением развивается повышение резистентности легочной ткани, снижается легочно-торакальный комплайнс, создается угроза баротравмы легких, в связи с чем рекомендуется проводить ИВЛ с контролем по давлению ( PCV ) до 22 см Н2О до снижения среднего давления в дыхательных путях (МАР) до 7,5 см Н2О.
У детей, получивших термоингаляционную травму необходим визуальный осмотр трахеобронхиального дерева. При скоплении слизи, наличии сегментарных гипоэктазов производится диагностическая и санационная бронхоскопия. ИВЛ осуществляется в режиме SIMV с PCV до 20 см Н2О. Учитывая высокую резистентность легочной ткани уровень РЕЕР поддерживается не выше 3 см Н2О сеансами по 30 минут не менее 4-5 раз в сутки. Адекватная оксигенация достигается в основном за счет повышения FiO 2 (желательно не выше 0,6) и изменения соотношения вдох:выдох = 1:1.
У детей с локализацией ожога в области воздухоносных путей и ограничения податливости грудной клетки при неэффективности режима SIMV + PCV рекомендуется использование инверсированного режима ИВЛ с обратным соотношением вдоха к выдоху ( PCV - IRV ). Коэффициент оксигенации артериальной крови достоверно увеличивается в течение 24 часов, что позволяет снизить FiO 2 до 0,35 в течение суток у большинства пациентов.
Антибактериальная терапия не проводится детям с ожоговым шоком 1 степени без отягощающих факторов. Всем остальным детям антибактериальная терапия проводится по двум алгоритмам:
Первый – от эмпирически избранного антибиотика ряда полусинтентических пенициллинов (например, Амоксиклав), к препарату согласно чувствительности микрофлоры.
Второй – от препарата с максимально широким спектром действия (например, Тиенам) к узкому, согласно чувствительности выделенного из биологических сред организма возбудителя.
Первый путь применим при площади поражения до 40% поверхности тела при не осложненном преморбидном фоне и догоспитальном времени до 24 часов. Второй способ - во всех остальных случаях. Учитывая длительность существования «входных ворот» инфекции предпочтение необходимо отдавать моно - терапии, не исключая и возможность комбинаций в случае микст – инфекции. Комбинации антибактериальных препаратов применяются у детей, поступивших на фоне ОРВИ или при наличии термо-ингаляционной травмы.
Нутритивная поддержка начинается в среднем со вторых суток от момента получения ожога. Учитывая неспособность большинства детей в состоянии тяжелого ожогового шока к энтеральному питанию в связи с парезом желудочно-кишечного тракта и обеднением кишечной стенки кровообращением, большая часть объема вводится внутривенно. При парентеральном питании в качестве донаторов пластического материала наиболее эффективны растворы кристаллических аминокислот (Аминопласмаль, Вамин, Аминопед, Инфезол), для калорической поддержки - концентрированные растворы глюкозы (20% раствор) и жировые эмульсии (Липофундин МЦТ\ЛЦТ, Интралипид).
У большинства детей с вторых-третьих суток становится возможным вариант комбинированного (парентеральное + энтеральное) питания. Постепенно на долю энтерального питания переводится до 70% вводимого калоража и азота. В качестве средств для данного варианта искусственного питания наиболее эффективны современные энтеральные смеси (Нутризон, Стрессрн, Нутрисоя, Берламин). При возможности энтерального питания через трубочку эффективным корректором гиперметаболизма и обладающим высокими вкусовыми качествами является препарат Нутридринк.
ХИРУРГИЧЕСКАЯ ТАКТИКА ПРИ ЛЕЧЕНИИ ОЖОГОВ У ДЕТЕЙ.
При поступлении больного с ожогом, прежде всего, оценивается площадь и глубина поражения, наличие термоингаляционной травмы. Площадь кожного покрова различных сегментов у детей разного возраста существенно различается. В своей работе мы пользуемся таблицей Lund and Browder , 1994:
Таблица 6.
ПЛОЩАДЬ ПОВЕРХНОСТИ (%) ОТДЕЛЬНЫХ АНАТОМИЧЕСКИХ ОБЛАСТЕЙ
ТЕЛА У ДЕТЕЙ В ЗАВИСИМОСТИ ОТ ВОЗРАСТА.
Части тела |
до 1 года |
1 год |
5 лет |
10 лет |
15 лет |
Голова |
20 |
17 |
13 |
10 |
8 |
Шея |
2 |
2 |
2 |
2 |
2 |
Грудь |
10 |
10 |
10 |
10 |
10 |
Живот |
8 |
8 |
8 |
8 |
8 |
Спина |
11 |
11 |
11 |
11 |
11 |
Ягодицы (2) |
5 |
5 |
5 |
5 |
5 |
Половые органы |
1 |
1 |
1 |
1 |
1 |
Плечи (2) |
8 |
8 |
8 |
8 |
8 |
Предплечья (2) |
5 |
5 |
5 |
5 |
5 |
Кисти (2) |
5 |
5 |
5 |
5 |
5 |
Бедра (2) |
11 |
13 |
16 |
18 |
19 |
Голени (2) |
9 |
10 |
11 |
12 |
13 |
Стопы (2) |
5 |
5 |
5 |
5 |
5 |
Предварительная оценка глубины поражения происходит при первичном осмотре, в процессе первичного туалета ожоговой поверхности она уточняется.
1 степень - характеризуется наличием покраснения кожи с четкими контурами, иногда на отечной основе, эпидермис не поражен (стойкая артериальная гиперемия и воспалительная экссудация).
2 степень - наличие тонкостенных пузырей с прозрачным жидким содержимым (серозный экссудат пропотевает через расширенные капилляры, отслаивая эпидермис от базального слоя). Дном раны является ростковый слой эпидермиса - влажный, блестящий, гладкий, очень болезненный, обильная экссудация сохраняется 2-4 суток.
3 А степень - наличие толстостенных пузырей с желеобразным плазматическим отделяемым, частично вскрывшихся, обнаженное дно раны влажное, розовое, с участками белого (ишемия) и красного (стаз) цвета - сосочковый слой собственно кожи, часто покрытый тонким, белесовато-серым, мягким струпом, петехиальными кровоизлияниями, болевая чувствительность сохранена, сосудистая реакция чаще отсутствует.
3 Б степень - поражение всей толщи кожи с образованием коагуляционного (сухого) или колликвационного (влажного) некроза. При сухом некрозе струп плотный, сухой, темно-красный или буро-желтый, с узкой зоной гиперемии, небольшим перифокальным отеком, в толще струпа часто просвечивают тромбированные сосуды. При влажном некрозе погибшая кожа отечна, тестоватой консистенции, сохранившиеся толстостенные пузыри могут содержать геморрагический экссудат, дно раны - пестрое, от белого до темно-красного, пепельного или желтоватого, распространенный перифокальный отек. Сосудистая и болевая реакция отсутствуют. В зону поражения частично или полностью вовлечена подкожная жировая клетчатка.
4 степень - сопровождается омертвением не только кожи, но и образований, расположенных ниже собственной фасции - мышц, сухожилий, костей, суставов. Характерно образование толстого, сухого или влажного, белесого, желтовато-коричневого или черного струпа тестоватой консистенции. Под ним и в окружности резко выражен отек тканей, мышцы имеют вид «вареного мяса».
По тактике хирургического лечения разделяют поверхностные (1, 2, 3А степени) ожоги, при которых наступает спонтанная эпителизация при адекватном консервативном лечении за счет сохранившихся придатков кожи. Глубокие ожоги (3 Б и 4 степени) требуют оперативного восстановления кожного покрова.
Термоингаляционная травма диагностируется на основании анамнеза (вдыхание горячего пара или продуктов горения), визуально (ожоги в области лица, поражение слизистых носа, ротоглотки). При лариногоскопии или бронхоскопии - гиперемия, отек слизистой глотки и межчерпаловидной зоны, скопление слизи и копоти. Могут отмечаться осиплость голоса, сухой непродуктивный кашель, одышка, сухие рассеянные хрипы. Ренгенологическое исследование позволяет выявить сегментарные гипоэктазы. Наличие термоингаляционной травмы подразумевает увеличение объема инфузионной терапии в среднем на 15%. Применение респираторной поддержки в этом случае обязательно.
Прогноз и объем терапии определяется исходя из площади и глубины поражения, наличия термоингаляционного поражения, возраста ребенка и его преморбидного фона. Основным прогностическим методом является расчет индекса Франка. За единицу берется 1% поверхности ожога при ожоге поверхностном и за три единицы берется 1% глубокого ожога. При наличии термоингаляционной травмы прибавляется от 10 до 30 единиц в зависимости от тяжести поражения трахео-бронхиального дерева.
При сумме единиц менее 60 прогноз считается благоприятным. При сумме от 60 до 90 единиц – прогноз сомнительный. При сумме свыше 90 единиц высока вероятность неблагоприятного исхода.
Первичный туалет ожоговой поверхности производится при поступлении больного (исключая крайне тяжелый шок). После обработки непораженной кожи вокруг раны спиртом, ожоговая поверхность очищается от загрязнения копотью и остатками некротизированного эпидермиса. Вскрываются и дренируются крупные эпидермальные пузыри, дно ран отмывается нейтральным раствором антисептика (Фурациллин, водный раствор Хлоргексидина). После этого повторно оценивается глубина и площадь поражения.
При наличии циркулярного, глубокого ожога на конечностях, грудной клетке с признаками сдавления подлежащих тканей нарастающим отеком, показана некротомия – рассечение струпа на всю толщу пораженных тканей
(насечки или лампасные разрезы в продольном направлении).
После проведения первичного туалета при поверхностных ожогах накладываются влажно-высыхающие повязки с раствором антисептика, или, при ограниченных поверхностных ожогах и ожогах лица возможно открытое ведение с использованием пленкообразующих аэрозолей (Пантенол, Левовизоль, Олазоль) или гелей, содержащих масло чайного дерева, пихты, Актовегин, Солкосерил.
При глубоких ожогах не рекомендуется использовать открытое ведение в связи с высокой опасностью диссеминации госпитальной инфекции. Далее на раны накладывается мазевая повязка с использованием препаратов сульфадиазина серебра (Дермазин, Аргосульфан, Сильвердин) или мазей на полиэтиленгликолевой основе (Левосин, Левомеколь). Перевязки осуществляются ежедневно или через сутки, отмачивая предварительно повязки растворами антисептиков.
Особое внимание следует уделить выбору анестезиологического пособия (использование миорелаксантов длительного действия), при некрэктомиях на небольшой площади предпочтительно проведение внутривенного наркоза (Диприван, Кетамин + Реланиум). При операциях на большой площади - НЛА + ГОМК, Фторотан или Закись азота. Перевязки производятся под внутривенным наркозом (Диприван, Калипсол + Реланиум).
Заместительная терапия во время оперативного вмешательства производится криоплазмой, эритроцитарной взвесью, высокомолекулярными декстранами, желатинами и препаратами на основе гидроксиэтилкрахмала. Необходим строгий учет кровопотери. При адекватном дооперационном возмещении ОЦК и умеренной гемодилюции оперативные вмешательства на площади не более 20% поверхности тела могут быть выполнены без применения препаратов крови.
С целью местного гемостаза используют коагуляцию, раствор Адреналина (1 мл в 250 мл физиологического раствора), а также перекись водорода.
Некрэктомия производится после выхода из шока (2-4-е сутки от момента травмы) с целью предотвращения инфекционно-септических осложнений. В зависимости от глубины поражения выполняют тангенциальное или фасциальное иссечение струпа.
Тангенциальная некрэктомия показана при ожогах 3А Б степени, предусматривает послойное удаление дерматомом некротизированных тканей до жизнеспособного слоя, о чем свидетельствует появление капиллярного кровотечения. Закрытие ран, иссеченных таким способом, возможно синтетическими пленочными покрытиями (типа Биокол), либо, при уверенности в радикальности и достаточности донорских ресурсов – использование аутолоскутов.
Перевязка после некрэктомии производится на следующий день с целью контроля радикальности иссечения и жизнеспособности пересаженных лоскутов.
ПРОТИВОПОКАЗАНИЯ К ПРОВЕДЕНИЮ НЕКРЭКТОМИИ
- Отсутствие опыта проведения подобных операций.
- Невозможность обеспечения необходимых условий для проведения операции и последующей интенсивной терапии.
- Сохраняющиеся проявления ожогового шока.
- Анемия при гематокрите ниже 30%.
- Нарушения свертывающей системы крови.
- Острые расстройства кровообращения.
- Декомпенсированная дыхательная недостаточность.
- Отек головного мозга.
- Инфицированная рана.
Четвертые сутки являются критическим сроком при постановке показаний к некрэктомии. В более поздние сроки рана инфицируется и создается угроза развития синдрома токсического шока и генерализации процесса. При поступлении больных с инфицированными ранами применяется тактика консервативного лечения под мазевыми повязками.
В конце третьей недели производится решение вопроса об аутодермопластике . При ее планировании обязателен расчет донорских ресурсов собственной кожи. Способ ранней некрэктомии позволяет избежать развития или прогрессирования полиорганных дисфункций, снижает летальность, сроки пребывания больного в стационаре, улучшает косметические и функциональные результаты.
Критерии выхода из шока:
- Повышение температуры не менее чем не 1 градус от нормы
- Симптом бледного пятна менее 1 секунды (не специфичен).
- Стабилизация гемодинамики.
- Положительное ЦВД.
- Стабилизация почасового диуреза.
Рекомендуемый комплекс лабораторных исследований:
- Эритроциты, гемоглобин, гематокрит. Каждые 6 часов первые сутки и каждые 12 часов в последующее время.
- Общий анализ крови ежедневно.
- КЩС каждые 6 часов первые сутки, затем каждые 12 часов.
- Общий анализ мочи при поступлении, затем ежедневно.
- Биохимический контроль: электролиты (калий, натрий, хлор), общий белок и альбумин, мочевина, билирубин, трансаминазы, амилаза, креатинин. Контроль уровня токсемии - СМП, ЦИК, контроль уровня тканевых перекисей - пировиноградная кислота, ЛДГ или молочная кислота.
- Контроль состояния системы гемостаза: ПТИ, фибриноген, АПТВ, тромбоциты, растворимые фибрин-мономерные комплексы и ТЭГ.
- Динамика гормонов стресса - пролактина, кортизола и тиреотропного гормона при поступлении и спустя 8 часов.
При отсутствии возможности полного обследования необходимым является контроль уровня Ht , исследование осадка и удельного веса мочи, контроль электролитов крови, а также уровня общего белка и мочевины.
В прогностическом смысле неблагоприятными признаками являются:
- Стойкие элекролитные расстройства.
- Геморрагические проявления в виде макрогематурии или кровотечения из желудочно-кишечного тракта, а также остальные проявления СПОД, вызванные патологическим депонированием крови, периферической вазоконстрикцией и, в конечном итоге, гипоксией жизненно-важных органов.
- Стойкая гипопротеинемия, не корригирующаяся нутритивной поддержкой.
- Продолжительность шока более 2 суток.
ОСОБЕННОСТИ ИНТЕНСИВНОЙ ТЕРАПИИ
В ПЕРИОД ПОЛИОРГАННОЙ НЕДОСТАТОЧНОСТИ.
Сравнительно недавно в терминологии использовали название «ожоговая токсемия или септико-токсемия». Токсическая концепция патогенеза ожоговой болезни, предполагающая образование в организме обожженного субстанции, вызывающей нарушение жизнедеятельности, появилась более 100 лет назад. Главными итогами развития токсической концепции являются: безусловные доказательство токсичности обожженной кожи, установление гистиогенного характера токсемии при ожогах, выделение токсической ожоговой субстанции из термически пораженных тканей в эксперименте и клинике, расшифровка ожогового токсина, выяснение антигенных свойств обожженной кожи и механизмов ожоговой аутоинтоксикации (Мовшев Б.Е., Недошивин Р.В. 1986; Смирнов С.В., Габриелян Н.И., Игнатов Р.В., Белоцерковская О.И. 1989).
Токсичность - свойство обожженной кожи, закономерно возникающее вследствие действия термического фактора. Токсический эффект обожженной кожи можно измерить объективным методом биотестирования. Существует интегральная зависимость между числом погибших лабораторных животных и содержанием выделенного специфического белка в экстракте.
Появление аномального белкового компонента доказано в 1986 году. Белок обладает специфическими антигенными свойствами и высокой токсической активностью. Токсин появляется в коже как результат непосредственного действия тепла на живую ткань, а не привносится в нее извне. Основным условием является повышение температуры кожи выше 50 градусов. Токсин хорошо растворим в биологических средах организма, что обеспечивает его беспрепятственное всасывание из очага поражения в кровоток в ранний период после ожога.
Токсин обожженной кожи представляет собой белок с молекулярной массой около 290 000 дальтон и относительно низким содержанием ароматических аминокислот. Характерна его антигенная неидентичность с белками кожи и сыворотки крови. Механизм действия токсина может быть представлен как цепь взаимозависимых нарушений на разных уровнях интеграции - системном, органном, клеточном и молекулярном (Зайцев В.Т., Пекарский Д.Е. 1980). Установлено, что ожоговый токсин оказывает выраженное гипотензивное действие и при введении в кровоток лабораторных животных вызывает снижение артериального давления на 40-50 мм рт. ст.
Отчетливые изменения наблюдаются в микроциркуляции: сужаются артериолы, замедляется движение крови по венулам, уменьшается число функционирующих капилляров. Первичная блокада ретикуло-эндотелиальной системы (РЭС), наступающая под действием токсина, становится отправным пунктом ожоговой токсемии. Развивающаяся под влиянием токсина гемодинамическая гипоксия и блокада РЭС ведут к общему результату - нарушению функции внутренних органов. Таким образом, универсальное поражение органов и тканей медиаторами воспаления и ПОН и токсином обожженной кожи вызывает в организме обожженного развитие синдрома полиорганной дисфункции .
Наиболее актуальным в разгар ПОН является синдром кишечной недостаточности (СКН). Немаловажная роль в частоте СКН принадлежит возрасту пациента.
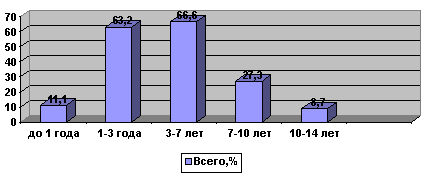
Рис. 5. Частота развития СКН в зависимости от возраста.
Печеночная дисфункция или постгипоксический (постшоковый) гепатит – одно из проявлений ПОН у обожженных. Частота его проявления также широко варьирует в зависимости от возраста, однако здесь преобладающим является подростковый период, что связано с социальными причинами (большинство пострадавших детей подросткового возраста употребляют алкоголь, токсические и наркотические вещества). Патогенез развития печеночной дисфункции представлен на рисунке.
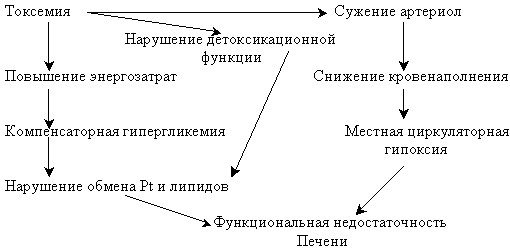
Рис. 6. ПАТОГЕНЕЗ РАЗВИТИЯ ПЕЧЕНОЧНОЙ ДИСФУНКЦИИ ПРИ ОЖОГОВОЙ БОЛЕЗНИ
В патогенезе ожоговой болезни некоторые авторы небезосновательно выделяют три естественных алгоритма, влияющих на прогноз: первый – зависимость преобладания аутоиммунных или иммунносупрессивных механизмов в развитии процесса. Временный, но весьма тяжелый иммунодефицит, удерживающийся в течение первых 5-7 суток ожоговой болезни, является естественным ответом на термическую травму и прямо коррелирует с ее тяжестью. Направленность второго алгоритма определяется преобладанием эндотоксикоза, либо механизмов, ограничивающих его развитие. Третий алгоритм зависит от преобладания трофологических факторов, способствующих регенераторно – репаративным процессам, или трофологических расстройств, препятствующих заживлению.
Все три алгоритма тесно взаимосвязаны и создают метаболическую основу патогенеза ожоговой болезни. Образование массива мертвых и умирающих тканей поддерживает сложный, многофакторный каскад цитокиновой активности (синдром системного воспалительного ответа). Неконтролируемое прогрессирование этого каскада способствует прогрессированию вторичного некроза, развитию эндотоксикоза и общему истощению организма вследствие интенсивного гиперметаболизма. Возникают исключительно благоприятные условия не только для местной хирургической инфекции, но и для ее генерализации с исходом в сепсис.
СТАДИИ РАЗВИТИЯ СЕПСИСА ПРИ ТЕРМИЧЕСКОЙ ТРАВМЕ
(использованы материалы согласительной конференции по проблемам сепсиса,
США, 1991 год и работы R . Bone 1991, 1994 г.г.)
- Локальная продукция цитокинов в ответ на повреждение кожи (имеет положительное влияние на трофику раны, не выходит за пределы зоны поражения).
- Выброс малого количества цитокинов в системный кровоток (регионарный ССВО).
- Генерализация системной реакции на воспаление. Регулирующие системы не способны к поддержанию гомеостаза, формируются отдаленные очаги воспаления и дисфункции (почки, печень, ЦНС).
- Синдром полиорганной недостаточности (СПОН) – наиболее тяжелая стадия ССВО. При ожоговой болезни СПОН всегда первичен, он является результатом воздействия повреждающего температурного фактора.
ОСНОВНЫЕ ПРИНЦИПЫ ИНТЕНСИВНОЙ ТЕРАПИИ В ПЕРИОД СПОН.
Как было указано выше, центральным звеном в профилактике генерализации инфекции является удаление мертвых тканей и обеспечение оптимальных условий для тканей, сохранивших жизнеспособность.
Становится очевидным, что широкое применение антибактериальной терапии и разнообразных противовоспалительных средств не является панацеей для ликвидации инфекционных осложнений и их последствий. Наряду с типированием возбудителя и подбором антибактериальной терапии с учетом чувствительности микрофлоры необходима тщательная коррекция транспорта кислорода. Идеальной предупредительной терапией развития гнойно-септических осложнений является кожная аутопластика после иссечения или химического некролизиса ожогового струпа.
ОСНОВНЫЕ АЛГОРИТМЫ ИНТЕНСИВНОЙ ТЕРАПИИ ОЖОГОВОЙ БОЛЕЗНИ.
1. Технология раннего выявления и доставки ожоговых больных в специализированный центр.
У большинства погибших от термических поражений детей смерть можно было предотвратить, используя на первом этапе (в ЦРБ, в неспециализированной клинике) все лечебные мероприятия, которые могли бы оказать положительное влияние на компенсаторные механизмы. Транспортабельным является ребенок, получивший ожог сегодня. В более поздние сроки развитие СПОН не позволяет осуществить перегоспитализацию обожженного ребенка без осложнений.
Этими обстоятельствами и была обусловлена необходимость отработки технологии ранней доставки детей в специализированный центр в состоянии шока. Консультативная бригада в составе врача реаниматолога, врача комбустиолога и фельдшера в рамках центра медицины катастроф получает информацию о пострадавшем в первые часы от момента термической травмы.
Лечащий врач ЦРБ (ЦГБ) по телефону дает характеристику состояния больного и корригирует стартовую терапию согласно с рекомендациями врача-консультанта. Одновременно оформляется вызов, и бригада прибывает на место, где производится оценка тяжести и предтранспортная подготовка, в состав которой входит:
- Инфузионная терапия согласно формуле Паркланда.
- Обезболивание наркотическими анальгетиками.
- Введение кортикостероидов.
- У пациентов с термоингаляционными травмами применяются бронходилятаторы.
После оценки адекватности дыхания решается вопрос о необходимости респираторной поддержки. В необходимом случае производится интубация трахеи, и пациент транспортируется на ИВЛ. В пути осуществляется мониторинг (пульсоксиметрия, ЧСС, ЧД, АД), ИВЛ производится по принципу ВЧ или объемным методом, с использованием Fi О2 от 0,21 до 1,0 по клиническим показаниям.
2. Протокол ранней респираторной поддержки.
Наиболее действенной мерой профилактики развития и прогрессирования ОРДС является раннее начало респираторной поддержки. У детей с поздним поступлением развивается повышение резистентности легочной ткани, снижается легочно-торакальный комплайнс, создается угроза баротравмы легких, в связи с чем рекомендуется проводить ИВЛ с контролем по давлению ( PCV ) до 22 см Н2О до снижения среднего давления в дыхательных путях (МАР) до 7,5 см Н2О.
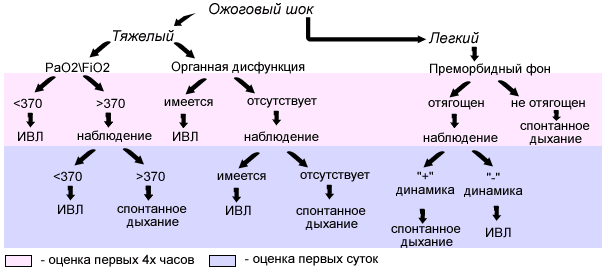
Рис. 7. Алгоритм ранней респираторной помощи у детей с термической травмой (Насонова Н.П. 1997)
Опыт проведения респираторной поддержки у детей с различными видами термических поражений позволил в 1997 году создать алгоритм респираторной помощи, позволяющий принять быстрое тактическое решение и оценить эффективность искусственной вентиляции легких. Данный алгоритм применяется большинству пациентов, поступающих в клинику.
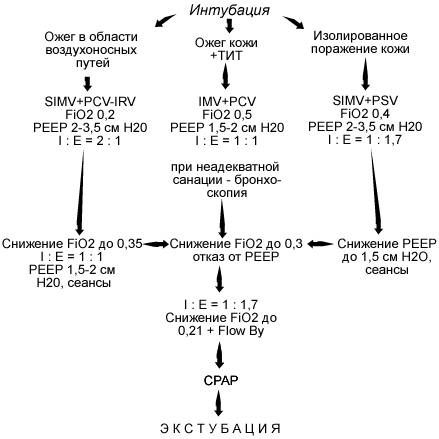
Рис. 8. Алгоритм респираторной поддержки у детей с различными ожогами (Насонова Н.П., 1997)
3. Протокол терапии синдрома кишечной недостаточности (СКН) и ранней нутритивной поддержки.
Нутритивная поддержка – это процесс обеспечения полноценного питания с помощью ряда методов, отличных от обычного приема пищи. Этот процесс включает в себя дополнительное оральное питание, энтеральное питание через зонд, частичное или полное парентеральное питание.
Для определения нутритивного статуса необходимо опираться на три его основные составляющие: энергетический и белковый баланс, адекватность функции жизненно-важных органов и степень стрессового метаболизма (гиперметаболизма). Для определения степени и выраженности белково-энергетической недостаточности применяются следующие методы:
- Клинические параметры (потеря более 10% от долженствующей массы тела). Расчет идеальной массы тела производили по Фляйшу.
- Лабораторные параметры. Концентрация общего белка, альбумина сыворотки крови и выраженность лимфопении.
Таблица 7.
СТЕПЕНЬ НУТРИТИВНОЙ НЕДОСТАТОЧНОСТИ
Параметры |
Степени |
||
Легкая |
Средняя |
Тяжелая |
|
Альбумин, (г\л) |
28-35 |
21-27 |
<20 |
Общий белок, (г\л) |
>60 |
50-59 |
<50 |
Лимфоциты (абс.) |
1200-2000 |
800-1200 |
<800 |
Дефицит м.т. (%) |
10-20 |
21-30 |
>30 |
Кроме того, для оценки нутритивного статуса необходимо принимать во внимание состояние ожоговых ран, их глубину и способность к регенерации. Важным критерием также является степень оперативной активности.
Энтеральное зондовое питание. Наиболее часто нами используется назогастральный зонд. Последний после установки фиксируется к крылу носа полоской лейкопластыря, и каждые 24 часа производится его смена. Энтеральная смесь вводится наиболее часто капельным способом, в течение 16 - 18 часов в сутки, реже – дробным методом.
Среды, используемые для питания детей, в зависимости от возраста детей, применяются преимущественно безлактозные (Нутризон, Нутри-Соя, Альфаре, Нутрилан) или смешанные 50\50 (Берламин). При отсутствии безлактозных или низколактозных смесей могут использоваться адаптированные молочные смеси. У часто срыгивающих детей желательно применение препарата Нутризон – антирефлюкс.
Методика терапии СКН. С целью обеспечения адекватной перистальтики и контроля желудочного содержимого пациенту устанавливается назогастральный зонд и производится контроль желудочного содержимого. При наличии кишечного содержимого в желудке производится его лаваж до чистых промывных вод. Затем проводится стимуляция перистальтики (Убретид в возрастной дозе или Эритромицин в порошке в дозе 30 мг на год жизни, но не более 300 мг) однократно, за 20 минут до попытки энтерального питания.
Первое введение жидкости осуществляется капельно, медленно, в объеме 1\5 физиологической потребности в сутки. Наиболее часто питание начинается со смесей, специально созданных для клинического питания (см. выше), которые подразделяются на элементные (Пепти 2000), полуэлементные (Пепти-Юниор) и полисубстратные (Нутризон, Нутрисоя и т.п.).
При условии положительного результата, ежедневно количество вводимой смеси увеличивается на 1\5 – 1\3 физиологической потребности и к пятым суткам, как правило, ребенок усваивает энтерально весь необходимый ему объем. Помимо смеси в питание добавляются фармаконутриенты (рыбий жир – донатор три-омега-жирных кислот и альфа-токоферола-ацетат – мощный антиоксидант). При получении отрицательного результата (отсутствие пассажа смеси по ЖКТ и наличии сброса по зонду) попытка повторяется от первой ступени алгоритма.
Показания к парентеральному питанию устанавливаются следующим образом: 1. Предоперационная подготовка у больных с локальными глубокими ожогами для улучшения эпителизации и регенерации донорских и раневых поверхностей. 2. Отказ от энтерального приема пищи или сниженный аппетит у детей с ожогами любой площади. 3. Развитие ожоговой болезни и гиперметаболизма у пациентов с ожогами любой площади и глубины.
Противопоказания к проведению парентерального питания: 1. Развитие рефрактерного шока, 2. Гипергидратация, 3. Анафилаксия на составляющие питательных сред.
В качестве основных ингредиентов парентерального питания используются следующие составляющие: углеводы (10% и 20% растворы глюкозы в дозе 8-15 г\кг веса в сутки, медленно), жировые эмульсии (Липофундин МСТ\ЛСТ в дозе 3 г\кг веса в сутки со скоростью введения до 0,15 г\кг в час, т.е. не быстрее 100 мл в час) и растворы аминокислот (Вамин, Инфезол, Аминовеноз, Аминопласмаль – СЕ 10%, Аминопласмаль – гепа в дозе 1,0-2,5 г\кг веса тела в сутки со скоростью введения до 0,1 г\кг веса тела в час, одновременно с жировой эмульсией).
4.Стандарт анестезиологической защиты.
Премедикация осуществляется в палате реанимации за 30 минут до транспортировки в операционную и включает наркотические анальгетики, седативные препараты, антигистаминные средства, м-холиномиметики. Индукция, согласно протоколу, осуществляется с помощью Реланиума в дозе 0,2 – 0,3 мг\кг или Дормикума и Оксибутирата натрия в дозе 70-100 мг\кг массы тела. Базовой схемой для проведения анестезиологического пособия является нейролептанальгезия. Некоторое повышение АД в ходе анестезии является желательным эффектом у детей с тяжелой термической травмой. Кроме того, ГОМК понижает обменные процессы, повышает устойчивость тканей головного мозга к гипоксии. Перед интубацией наиболее часто используется болюсное введение Фентанила в дозе 0,001-0,003 мг\кг, после чего производится миоплегия Ардуаном в дозе 0,02-0,08 мг\кг или Мивакроном в дозе 0,15-0,25 мг\кг массы тела. В указанной дозе он создает хорошие условия для эндотрахеальной интубации. Следует отметить, что ряд детей с термической травмой требуют более высокой дозировки препарата (до 0,25 мг\кг). Интубация трахеи производится наиболее часто назо-трахеальным способом в связи с необходимостью продленной ИВЛ после большинства массивных оперативных вмешательств.
КОНТАКТНЫЕ ТЕЛЕФОНЫ ДЛЯ КОНСУЛЬТАТИВНО-МЕТОДИЧЕСКОЙ
РАБОТЫ И ПОМОЩИ ДЕТЯМ С ТЕРМИЧЕСКОЙ ТРАВМОЙ.
Детский ожоговый центр ДГКБ №9: г. Екатеринбург, ул. Решетская 51. Тел. 52-08-49.
Заведующий центром - Штукатуров Алексей Константинович (52-08-49).
Научный консультант – Насонова Наталья Петровна (52-02-29).
Заведующий РАО – Пономарев Евгений Игоревич (52-02-29)
«Центр медицины катастроф и неотложных состояний» - тел. 46-64-61(2).
ЛИТЕРАТУРА:
- Алексеев А. Лечение тяжелообожженных: проблемы и успехи. Врач №4, 1998, с. 32 –33.
- Альес В.Ф., Андреев А.Г., Ульянова Г.И., Гранова Л.В., Астамиров М.К. Доставка, потребление и экстракция О2 в острый период ожоговой болезни у детей. Анестезиология и реаниматология №1, 1998, с. 4 –7.
- Альес В.Ф., Степанова Н.А., Гольдина О.А., Горбачевский Ю.В. Патофизиологические механизмы нарушений доставки, потребления и экстракции кислорода при критических состояниях. Методы их интенсивной терапии. ВИТ №2, 1998, с. 8 – 12.
- Альес В.Ф., Андреев А.Г., Астамиров М.К. Транспорт кислорода и газовый состав крови в норме и у больных, находящихся в критических состояниях. Реаниматология и интенсивная терапия №2, 1998, с. 7 – 16.
- Балох Д., Бензер А. Приоритеты первых дней интенсивной терапии ожоговой травмы. Актуальные проблемы анестезиологии и реаниматологии. Освежающий курс лекций. 1997, с. 168 – 170.
- Зайцев В.Т., Пекарский Д.Е. Диагностика и лечение токсемии при ожоговой болезни. Хирургия №5, 1980, с. 33 – 37.
- Лисицин К.М. Вихриев Б.С. Пути улучшения исходов лечения обожженных. Военно-медицинский журнал №8, 1984, с. 27 – 30.
- Лейдерман И.Н., Руднов В.А. Оценка эффективности метода коррекции синдрома гиперметаболизма у пациентов с СПОН. ВИТ, 1998, №2, с. 17-18.
- Лейдерман И.Н., Насонова Н.П., Оберюхтина И.В. нутритивная поддержка при тяжелой термической травме. Стандартный протокол (методическое пособие). Екатеринбург, 2000, 19 стр.
- Мовшев Б.Е., Недошивина Р.В. Ожоговый токсин, его идентификация и биологическая активность. Гематология и трансфузиология №8, том 31, 1986, с. 49 – 54.
- Насонова Н.П. Респираторная поддержка в комплексной противошоковой терапии у детей с тяжелой термической травмой. Автореф. дисс. канд. мед. наук, Екатеринбург, 1997, 30 стр.
- Насонова Н.П., Егоров В.М. Показания к превентивной респираторной поддержке у детей с тяжелой термической травмой. «Неотложные состояния у детей», 6 конгресс педиатров России, 2000, тезисы, с. 207.
- Насонова Н.П., Егоров В.М., Одинак В.М. Ранняя респираторная поддержка в комплексной интенсивной терапии у детей с тяжелой термической травмой. Анестезиология и реаниматология, №1, 2000, с. 47-50.
- Насонова Н.П., Солодовник Д.В., Синдром токсического шока: новое лицо старого возбудителя. Вестник интенсивной терапии, 1999, №4, с. 28-31.
- Насонова Н.П., Лейдерман И.Н., Пономарев Е.И. с соавт. Протокол терапии синдрома кишечной недостаточности и ранней нутритивной поддержки у детей с термической травмой. «Актуальные вопросы педиатрии, детской хирургии, анестезиологии и реаниматологии детского возраста», Екатеринбург, 2000, с. 106 – 109.
- Насонова Н.П., Егоров В.М., Лукин О.В. с соавт. Обеспечение неотложной специализированной помощи при транспортировке детей с тяжелой термической травмой в крупном промышленном регионе. «Интенсивная терапия неотложных состояний», екатеринбург, 2000, с. 173 – 175.
- Нуштаев И., Нуштаев А. Детский ожоговый травматизм. Врач №3, 1997, с.16.
- Руднов В.А. Пути оптимизации диагностики, прогноза и интенсивной терапии сепсиса с органной дисфункцией. Автореф. докт. Дисс. 1995.
- Руднов В.А., Пионтек А.Э. Краткий справочник по анестезиологии и интенсивной терапии. Екатеринбург, 1995, 100 с.
- Смирнов С.В., Габриелян Н.И., Игнатов Р.В., Белоцерковская О.И. Эндотоксемии и критерии ее объективизации у больных с ожогами. Клиническая медицина №5, 1989, том 67, с. 128 – 131.
- Фурман В. Интенсивная терапия ожоговых больных. Актуальные вопросы анестезиологии и реаниматологии. Освежающий курс лекций, 1993, с. 257 – 259.
- Шанин В.Ю. Патогенез респираторного дистресс-синдрома как осложнения военно-травматического шока и острого периода тяжелой раневой болезни. Клиническая медицина и патофизиология №1, 1997, с. 13 – 22.
- Doughty L.A., Kaplan S.S., Carcillo J.A. Inflammatory cytokine and nitric oxide responses in pediatric sepsis and organ failure. Crit Care Med. 1996, Vol. 24, № 7, p. 1137 – 1143.
- Griffiths R. W., Laing J.E. A burn formula in clinical practice. Ann. R. Coll.Surg. Engl. 1981., 63, 50-53.
- Harms B.A. et al. Microvascular fluid and protein flux in pulmonary and systemic circulation after thermal injury. Micr. Res.,1982,23,77.
- Hennenberger A., Partecke B.D. Therapy of the severely burned child from the pediatric intensive care vewpoint. Unfalcchirurg. 1995, Apr. 98 (4): 193 - 197.
- Herdon D.N., Barrow R.E., Linases H. Et al. Burns. 1988, vol. 14., p. 349-356.
- Holleman J.N. et al. Palmonary effects intravevous fluid therapy in burn resuscitation. Surg. Gynecol. Obstet.,1978, 147, 161 - 166.
- Horgan P.G., Mannick J.A., Dubravec D.B. et all. Effect of low dose recombinant interleukin 2 plus indomethacin on mortality after sepsis in a murine burn model. British journal of surgery, 77 (4) 401-4 \1990.
- Hughes J.R. et al. Seizures following burns of the skin : II.Condition associated with these seizures.-Dis. Nerw. sust., 1973, 35, 347-353.
- Jacobs R.F., Tabor D.R. Immune cellular interactions during sepsis and septic injury. Crit. Care. Clin. 1989, 5: 9-26.
- Jones W.G., Barber A.E., Kapur S., et all. Pathophysiologic glucocorticoid levels and survival of translocating bacteria. Archives of surgery, 126 (1) 50-5 \1991.
- Jones W.G., Barber A.E., Minei J.P. et all. Antibiotic prophylaxis diminishes bacterial translocation but not mortality in experimental burn wound sepsis. Journal of trauma. 30 (6) 737-40 \1990.
- Luce P.V. Acute lung injury and the acute respiratory distress syndrome. Crit. Care Med. 1998, vol. 26, № 2, p. 369 – 376.
- Marinov Z., Kvalteni K., Koller J. Fluid resuscitation in thermally injured pediatric patient. Acta Chir. Plast. 1997, 39(1) : 28 - 32.
- Martin J. Evaluation of cortisone in the treatment of burns. Surgery, 1955, vol. 38, №3.
- Mendez M.V., Molloy R.G., O`Riordain D.S., Holzheimer R.G., Nestor M.S., et all. Lymphokine activated killer cells enhance IL-2 prevention of sepsis-related death in a murine model of thermal injury. Journal of surgical research, 54 (6) 565-70\1993.
- Merrell S.W. et al. Fluid resuscitation in thermaly injured children. Am. J. Surg., 1986, Dec. 1, 152 (6): 664 - 669.
- Metkus A.P., Trabulsy P.P., Schlobohm R. A furebigter with pancreatitis. American Journal of Public Health (GAPH) ISSN: 0090 - 0036, vol. 86, ISS 1, Date Jan 1996, p. 81-83.
- Moggi C., Memmini G., Turini M., Ciulli L. Severe inflammatiry disease in children. Rationale for corticosteroid immunomodulating therapy : pathogenic therapy. Ped. Med. Chic. 1996. Jul,18(4) : 395-401.
- Monafo W.W. Initial management of burns. New England. Journal of Medicine . ISS:0028-4793, vol 335, ISS:21, Nov 21,1996, p.1581-1586.
- Montgomery A.B., Stager M.A.,Carrico C.J. Causes of mortality in patients with the ARDS. Am. Rew. Respir. Dis. 1985, 132, p.485-489.
- Movafo W:W: et al. The treatment of burned children. Clin Plast Surg 1977, Oct 4 (4): 537 - 546.
- Nagesha C.N., Shenoy K.J., Chandrashekar M.R. Study of burn sepsis with special reference to Pseudomonas aeruginosa. Journal of the Indian medical association> 94 (6) 230-3 \1996.
- Pinsky M.R., Matuschar G.M. Multiple systems organ failure : Failure of host defense mechanism. Crit. Care Clin. 1989; 5: 199-220.
- Powers S.R., Mannal R., Necleroim et al. Pphysiologic consegueses of positive end expiratory pressure (PPEP).
- Renz B.M., Sherman R. Exposure of buttock burn wounds to stool in scald-abused infants and children: stool-staining of eschar and burn wound sepsis. American surgeon, 59 (6) 379-83 \1993.
- Resnick S.D. Staphylococcal toxin-mediated syndrome in childhood. Seminars in dermatology, 11 (1) 11-8 \1992.
- Reynolds E.M., Pyan D.P. et al. Left ventricular failure complicating severe pediatric burn injures. J.Ped. Surg. 1995, Feb., 30(2) : 264 - 269.
- Rixen D., Siegel J.H., Friedman H.P. “Sepsis\SIRS”, physiologic classification, severity stratification, relation to cytokine elaboration and outcome prediction in posttrauma ctitical illness. Journal of trauma, 41 (4) 581-98 \1996.
- Saadia K., Lipman J. Multiple organ failure after trauma. British Medical Journal (IBMJ) IAAN : 0959-8146, vol. 313, ISS : 7057, Date: Sap 7, 1996, p. 573 - 574.
- Schiller W.R. Burn management in children. Pediatr. Ann.1996, Aug 25: 431.
- Schlag G., Redl H. Mediators of injury and inflammation. World journal of surgery, 20 (4) 406-10 \1996.
- Schoemaker et al. Prospectiv trial of supranormal values of surve voss as therapeutic goals in high-risk surgical patients. Shest 1992,v102,p 208
- Taylor D.E., Piantadosi C.A. Oxidative metabolism in sepsis and sepsis syndrome. Journal of critical care, 10 (3) 122035 \1995.
- Thomson P.B., Herndon D.N. et al. Effect on mortaliti of inhalation injury. J. Trauma, 26: 163 - 165, 1986.
- Tuite P.C. Crit Care Nurs. Recognition and management of shock in the pediatric patient. 1997, May, 20 (1) : 52 - 61.

