Комбинации кетопрофена и нефопама для обеспечения послеоперационного обезболивания с минимальным потреблением наркотических анальгетиков у кардиохирургических больных.
А.А. Еременко, Л.С. Сорокина, М.В. Павлов
Отделение кардиореанимации и интенсивной терапии ФГБУ Российского научного центра хирургии им. акад. Б.В. Петровского РАМН
Исследованы 4 схемы анальгезии:
- нефопам на фоне контролируемой пациентом анальгезии (КПА) тримеперидином;
- кетопрофен (100 мг каждые 12 ч внутримышечно) на фоне КПА тримеперидином;
- комбинация нефопама и кетопрофена по указанной выше схеме на фоне КПА тримеперидином;
- КПА тримеперидином в виде монотерапии в раннем послеоперационном периоде у кардиохирургических больных.
В каждую группу вошли по 20 кардиохирургичских больных (всего 80 пациентов) в возрасте от 40 до 70 лет. Введение нефопама и кетопрофена перед экстубацией больных снижает степень выраженности болевого синдрома в среднем на 90% и делает возможной раннюю активизацию пациентов. Сочетание нефопама и кетопрофена приводило к наиболее выраженному анальгетическому и опиоидсберегающему эффекту. Суммарная доза тримеперидина за 24 ч в среднем по этой группе достигала 14,7 мг на одного больного, что было в 4,9 раза меньше дозы, потребляемой в группе изолированной КПА тримеперидином.
По динамике максимальной инспираторной емкости легких (МИЕЛ) получены наилучшие результаты в первых трех группах, что достоверно отличалось от группы изолированной КПА с 6го часа от начала исследования. В целом нежелательные эффекты были связаны с введением тримеперидина и зависели от его дозы. В группе изолированной КПА частота тошноты, рвоты, головокружения, слабости была достоверно выше, чем в остальных группах.
Ключевые слова: послеоперационная боль у кардиохирургических больных, контролируемая пациентом анальгезия, нефопам, кетопрофен, тримеперидин.
Проблема послеоперационного обезболивания у кардиохирургических больных относится к числу наиболее актуальных.
Выраженный послеоперационный болевой синдром является причиной ряда серьезных патофизиологических эффектов, влияющих на исход вмешательства, задерживающих послеоперационное восстановление, удлиняющих период реабилитации и увеличивающих стоимость лечения [2, 5, 7, 9, 10, 12, 13, 15, 16].
Умеренная и интенсивная боль независимо от локализации может оказывать влияние практически на все органы, увеличивая риск развития осложнений и летальность в послеоперационном периоде. В связи с этим оценка выраженности болевого синдрома должна входить в перечень мониторируемых витальных показателей, таких как ЧСС, АД, ЦВД и др.
В настоящее время доминирует принцип сбалансированного послеоперационного обезболивания, что включает комбинированное использование анальгетиков с разным механизмом действия и синергическим анальгетическим эффектом. Концепция мультимодальной анальгезии предусматривает одновременное назначение двух анальгетиков и более и/или методов обезболивания, позволяющих достичь адекватной анальгезии при минимальных побочных эффектах [2, 5, 7, 9, 10, 12, 13, 15, 16].
Цель работы — оценка обезболивающего, опиоидсберегающего и нежелательных побочных эффектов нефопама, кетопрофена и их комбинации в раннем послеоперационном периоде у кардиохирургических больных.
Материал и методы. В исследование включены 80 больных, перенесших различные операции на сердце. Средний возраст пациентов составил 50,8 ± 10,8 года (от 40 до 65 лет). Дизайн исследования — рандомизированное проспективное сравнительное исследование. Все больные, методом случайных чисел были распределены в 4 группы.
1-я группа: нефопам на фоне контролируемой пациентом анальгезии (КПА) тримеперидином. Первую внутривенную инъекцию нефопама (20 мг в течение 30 мин) вводили за 30 мин до экстубации, далее осуществляли постоянную инфузию в дозе до 120 мг в сутки.
2-я группа: кетопрофен (100 мг каждые 12 ч внутримышечно) на фоне КПА тримеперидином.
3-я группа: комбинация нефопама и кетопрофена по указанной выше схеме на фоне КПА тримеперидином.
4-я группа: КПА тримеперидином в виде монотерапии.
В исследовании использовали акупан (нефопам) фирмы "Биокодекс" (Франция), промедол (тримеперидин) ФГУП "Московский эндокринный завод, кетонал (кетопрофен) фирмы "Lek" (Словения).
КПА тримеперидином начинали через 2 ч после экстубации трахеи. Введение тримеперидина осуществляли в режиме "по требованию" на фоне постоянной инфузии (комбинированный режим). При этом концентрация этого препарата составила 2 мг/мл, начальная или насыщающая доза — 5 мг, болюсная доза (БД) составила 3 мг, локаутинтервал (ЛИ) — 6 мин, 4часовая максимальная доза — 20 мг, скорость постоянной инфузии — 0,1 мг/ч.
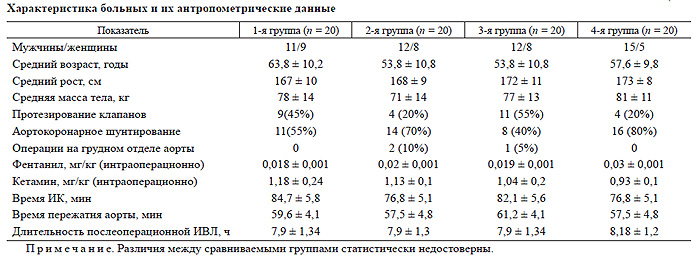
По возрасту, полу, антропометрическим данным, видам оперативного вмешательства, особенностям интраоперационной общей анестезии, длительности ИК, ишемии миокарда и операции, продолжительности послеоперационной ИВЛ больные четырех групп не различались (табл. 1).
Операции производили под общей анестезией с использованием ИК. Пациенты получали сбалансированную общую анестезию с применением севофлурана, пропофола, кетамина и фентанила при 40—60% содержании кислорода во вдыхаемой смеси. По дозам кетамина и фентанила пациенты сравниваемых групп не различались.
В ОРИТ всем больным проводили стандартные мероприятия интенсивной терапии и мониторинга. Длительность ИВЛ после мых группах. Время нахождения дренажей в полости средостения, перикарда и плевральных полостях составило в среднем 20,2 ± 2,1 ч. Согласно стандартному протоколу, все пациенты перед операцией и в послеоперационном периоде получали Н2блокаторы или ингибиторы протоновой помпы.
Критерии включения пациентов в исследование: срединная стернотомия, ранний послеоперационный период, уровень сознания — ясное или легкое оглушение, 14—15 баллов по шкале комы Глазго, возраст старше 12 лет.
Критерии исключения: наличие в анамнезе психических заболеваний, наличие в анамнезе противопоказаний к назначению нефопама и кетопрофена и индивидуальная непереносимость препаратов этих групп, печеночнопочечная недостаточность, периоперационные поражения головного мозга (ОНМК, постгипоксическая или метаболическая энцефалопатия), послеоперационное кровотечение более 1,4 мл/кг/ч, выраженная сердечнососудистая и/или дыхательная недостаточность, требующая проведения длительной ИВЛ (более 2 сут).
Интенсивность боли оценивали по 5балльной вербальной шкале в покое и при глубоком вдохе и кашле.
В качестве дополнительного объективного критерия эффективности анальгезии использовали метод побудительной спирометрии. Максимальную инспираторную емкость легких (МИЕЛ) измеряли с помощью объемного спирометра Coach 2® (Intersurgical).
Первую оценку интенсивности боли и МИЕЛ проводили сразу после экстубации трахеи, затем каждые 2 ч в течение первых послеоперационных суток. Одновременно фиксировали показатели гемодинамики (АД и ЧСС).
Статистическая обработка данных проведена на персональном компьютере с помощью ППП Statistica 6.0 for Windows.
Результаты представлены как М ± m (среднее значение ± стандартная ошибка). Для сравнения количественных показателей и определения различий между ними использовали критерий Стьюдента и непараметрический Uкритерий Манна—Уитни. Различия считали достоверными при уровне значимости р < 0,05.
Для выявления различий по частоте встречаемости разных признаков использовали критерий χ2. Различия считали статистически достоверными при уровне значимости р < 0,05.
Результаты исследования и их обсуждение. В исследовании сравнивали анальгетическую эффективность при использовании кетопрофена, нефопама и их комбинации в послеоперационном периоде у кардиохирургических больных.
Кетопрофен — 2 (3-бензоилфенил) пропионовая кислота представляет особый интерес среди неселективных НПВП вследствие целого ряда преимуществ. Известно, что в суточной дозе 200—300 мг по противовоспалительной и жаропонижающей активности он не уступает, а по анальгетической превосходит большинство НПВП [3].
Нефопам занимает особое место среди анальгетических средств. Это препарат представляет собой рацемическую смесь двух энантиомеров и относится к ненаркотическим анальгетикам центрального действия [3]. Являясь ингибитором моноаминов, как, например трамадол, нефопам отличается от него отсутствием морфиноподобного эффекта. Он оказывает мультимодальное воздействие благодаря своему влиянию на многие мишени нейропластики, в отличие от трамадола его действие не нарушается антагонистами серотониновых 5HT3-рецепторов (например, ондансетроном) [4, 5]. К преимуществам относится также отсутствие влияния на агрегацию тромбоцитов и угнетающее воздействие на центральную нервную систему и дыхание [6, 7].
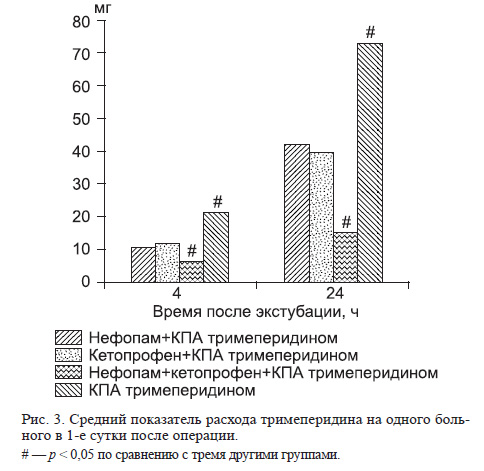
У больных в 1-й группе экстубацию трахеи выполняли на фоне терапевтических доз нефопама, во 2-й группе — на фоне кетопрофена, в 3-й — при комбинации этих препаратов.
Пациентам всех групп введение тримеперидина во избежание депрессии дыхания на фоне остаточного действия общей анестезии начинали через 2 ч после экстубации.
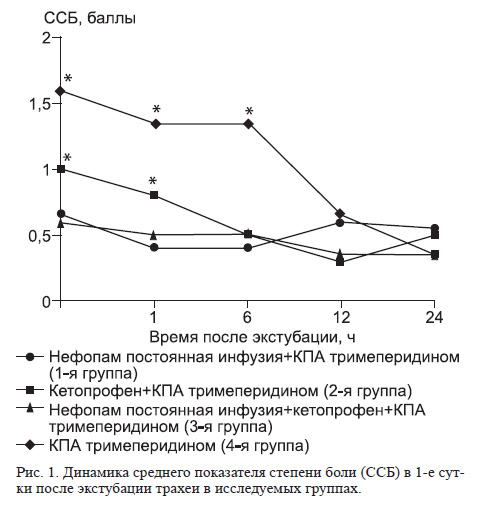
Сравнение динамики выраженности болевого синдрома показало, что непосредственно после экстубации и через 1 ч интенсивность боли в 4-й группе была выше, однако не более 2 баллов (слабая боль при кашле или глубоком вдохе). Различия в 4-й группе по сравнению с тремя другими были статистически достоверны на первых трех этапах исследований.
Показатели в 3-й группе на первом и втором этапах достоверно отличались как от 4-й группы, так и от остальных. Достоверных отличий между группами, в которых использовали нефопам, не отмечено. Поскольку инфузию тримеперидина начинали через 2 ч после экстубации трахеи, в 4-й группе к 6-му часу отмечалось снижение интенсивности боли, а к 12-му часу этот показатель достоверно не отличался от трех других групп. К концу 1-х суток интенсивность боли во всех четырех группах не превышала 1 балла (рис. 1).
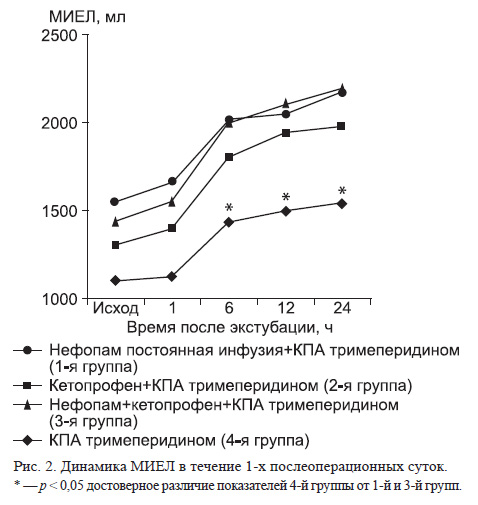
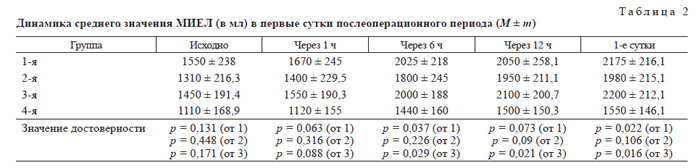
Поскольку боль при стернотомии и дренировании плевральных полостей приводит к ограничению экскурсии грудной клетки, анальгетический эффект нефопама и кетопрофена оказывает положительное влияние на функцию внешнего дыхания, что отражает динамика МИЕЛ, представленная на рис. 2. Средние значения МИЕЛ в 1, 2 и 3-й группах достоверно не отличались на всех этапах исследования (табл. 2).
В группе пациентов, получавших КПА тримеперидином, меньшие значения МИЕЛ, имеющие достоверные различия на последних трех этапах, повидимому, связаны с характерным для этого препарата центральным угнетением дыхания.
При эпизодической оценке выраженности болевого синдрома персоналом пациент может испытывать сильные болевые ощущения в периоды времени между осмотрами. КПА с использованием опиоидов позволяет объективно оценить потребность больного в этих препаратах, а при сочетании с другими анальгетиками и их опиоидсберегающий эффект, поскольку метод ориентирован на индивидуальные потребности пациента в обезболивании (рис. 3). Таким образом, полученные в 4-й группе суточные дозы тримеперидина (в среднем 72,3 мг) отражают реальную потребность в этом опиоидном препарате при изолированном его применении. На фоне нефопама и кетопрофена потребность в тримеперидине существенно снижалась, причем различий в опиоидсберегающем эффекте этих препаратов не было. К 4-му часу при использовании нефопама больные потребили в среднем 10,5 мг, а к 24-му часу — 41,85 мг тримеперидина. В группе кетопрофена эти цифры составили соответственно 11,4 и 39,26 мг. Комбинация нефопама и кетопрофена приводила к адекватному обезболиванию, и у 55% пациентов не отмечено ни одного нажатия триггера инъекции тримеперидина. Суммарная его доза у 70% пациентов была практически равна дозе фоновой инфузии (0,1 мг в час), а за 24 ч в среднем по группе достигала 14,7 мг (меньше одной ампулы тримеперидина в сутки), что было в 4,9 раза меньше дозы, потребляемой в группе изолированной КПА тримеперидином (p = 0,000), и значимо ниже, чем при применении этих препаратов по отдельности. Расход тримеперидина в 1-й группе был в 1,7 раза (p = 0,002), во 2-й группе — в 1,8 раза (p = 0,001) меньше, чем в 4-й группе. Таким образом, сочетанное использование кетопрофена и постоянной инфузии нефопама у большинства пациентов позволило достичь адекватного обезболивания без применения сильных опиоидных анальгетиков или с использованием их в минимальных дозировках.
По данным различных исследований, общий опиоидсберегающий эффект нефопама варьирует от 20 до 50% в зависимости от вида хирургического вмешательства, методики применения и используемых ненаркотических анальгетиков, таких как НПВП [12]. В нашем исследовании опиоидсберегающий эффект нефопама в 1й группе составил 42%, кетопрофена во 2й группе — 46%, комбинации нефопама и кетопрофена в 3-й группе — 79%.
Ранее с применением нефопама связывали 15—30% частоту возникновения побочных эффектов, особенно тошноты и головокружения [13]. Несмотря на то что данные побочные явления были связаны с быстрым введением препарата, эти явления даже будучи незначительными привели к некоторой настороженности в применении этого препарата, когда он появился в 1970х годах во Франции. Наши данные не подтверждают высокую частоту возникновения данных побочных явлений, поскольку частота тошноты и головокружения в группах нефопама достоверно ниже, чем в группе изолированной КПА тримеперидином. Это можно объяснить тем, что в нашем исследовании нефопам применяли в виде постоянной внутривенной инфузии.
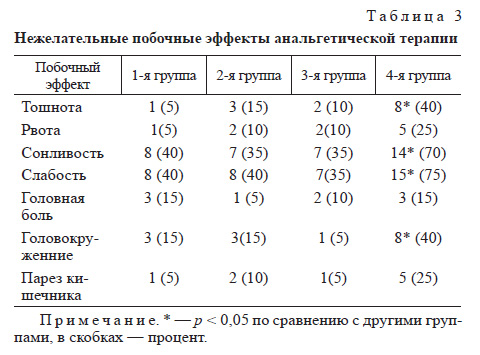
Результаты оценки побочных эффектов в четырех исследуемых группах представлены в табл. 3. В 1й группе у 1 (5%) больного, во 2й у 3 (15%), в 3й группе у 2 (10%) была отмечена тошнота, у 1 (5%) и 2 (10%), у 2 (10%) больных соответственно — рвота. Причиной указанных побочных эффектов могло быть последействие общей анестезии и других препаратов, применявшихся во время операции и в раннем послеоперационном периоде. Эти же побочные эффекты наблюдали и в 4-й группе, в которой тошнота была отмечена у 8 (40%) пациентов, рвота — у 5 (25%), т. е. частота тошноты в 4-й группе достоверно отличалась от трех других.
Такие побочные эффекты, как слабость и сонливость, наблюдались в равной степени у больных первых трех групп. Они отмечались у 8 (40%) больных 1-й группы, у 8 (40%) 2-й и у 7 (35%) больных 3-й группы. Во всех случаях вялость и сонливость прошли без отмены препаратов. Эти симптомы отмечались и у больных группы изолированной КПА (75%), что достоверно отличалось от остальных трех групп. Парез кишечника в 1-й и 3-й группах отмечен у 1 (5%) пациента в каждой, 2-й группе — у 2 (10%), а в 4-й группе данный симптом наблюдался у 5 (25%) больных, что, с нашей точки зрения, также объясняется побочными эффектами тримеперидина, поскольку его количество у больных, получавших нефопам и кетопрофен, было минимальным.
В 4-й группе головокружение встречалось в 2,6 раза чаще, чем в 1-й и 2-й группах, и в 8 раз чаще, чем в 3-й, что также обусловлено побочными эффектами высоких доз тримеперидина.
Не обнаружено статистически значимых различий в динамике АД, а также в анализах свертывающей системы крови и объеме послеоперационной кровопотери в течение всего периода наблюдения.
ВЫВОДЫ
- Послеоперационная анальгезия при сочетанном применении нефопама и кетопрофена была более эффективной, чем при использовании этих препаратов по отдельности.
- Введение нефопама и кетопрофена перед экстубацией больных приводит к снижению выраженности болевого синдрома в среднем на 90% и делает возможной раннюю активизацию пациентов.
- Сочетание нефопама и кетопрофена на фоне КПА тримеперидином приводило к наиболее выраженному анальгетическому и опиоидсберегающему эффекту. Расход тримеперидина в группах с использованием нефопама и кетопрофена как по отдельности, так и в комбинации был достоверно ниже, чем в группе изолированной КПА, и составил соответственно в среднем 41,85, 39,26, 14,7 и 72,3 мг.
- В целом нежелательные эффекты были связаны с тримеперидином и зависели от его дозы. В группе изолированной КПА частота тошноты (на 35, 25 и 30%), слабости и сонливости (на 35 и 40%), головокружения (на 25 и 35%) была достоверно выше, чем в 1, 2 и 3-й группах соответственно.
- Kehlet Н., Dahl J.B. The value of "multimodal" or "balanced analgesia" in postoperative pain treatment. Anesth. Analg. 1993; 77: 1048—56
- Marret E., Kurdi O., Zufferey P. el al. Effects of nonsteroidal antiinfammatory drugs on PCA morphine sideeffects: metaanalysis of randomized controlled trials. Anesthesiology. 2005; 102: 1249—60.
- Elia et al. Does multimodal analgesia with acetaminophen, nonsteroidal antiinflammatory drugs, or selective cyclooxygenase2 inhibitors and patientcontrolled analgesia morphine offer advantages over morphine alone? Anesthesiology. 2005; 103: 1296—304.
- Stamer U.M. et al. Impact of CYP2D6 genotype on posroperative tramadol analgesia. Pain. 2003; 105: 231—8.
- Arcioni R. et al. Ondansetron inhibits the analgesic effects of tramadol: a possible 5HT(3) spinal receptor involvement in acute pain in humans. Anesth. Analg. 2002; 94: 1553—7.
- Bhatt A.M., Pleuvry B.J., Maddison S.E. Respiratory and metabolic effects of oral nefopam in human volunteers. Br. J. Clin. Pharmacol. 1981; 11: 209—11.
- Dordoni P.L., Della Ventura M., Stefanelli A. et al. Effect of ketorolac, ketoprofen and nefopam on platelet function. Anaesthesia. 1994; 49: 1046—9.
- Tirault M. et al. The effect of nefopam on morphin overconsumption induced by largedose remifentanil during propofol anaesthesia for major abdominal surgery. Anesth Analg 2006; 102: 110117.
- Du Manoir B et al. Randomized prospective study of the analgesic effect of nefopam after orthopaedic surgery. Br. J. Anaesth. 2003; 91: 836—41.
- McLintock T.T., Kenny G.N., Howie J.C. et al. Assessment of the analgesic efficacy of nefopam hydrochloride after upper abdominal surgery: a study using patient controlled analgesia. Br. J. Surg. 1988; 75: 779—81.
- Heel R.C., Brogden R.N., Pakes GE, Speight TM, Avery GS. Nefopam: a review of its pharmacological properties and therapeutic efficacy. Drugs. 1980; 19: 249—67.
- Hyllested M., Jones S., Pedersen J.L., Kehlen H. Comparative effect of paracetamol, NSAIDs or their combination in postoperative pain management: a qualitative review. Br. J. Anaesth. 2002; 88: 199—214.
- Eremenko A.A., Avetisjan M.I.. Combination analgesics early after cardiac operations. Consilium Medicum. 2005; 2: 28—32 (in Russian).
- Eremenko A.A., Urbanov A.V., Avetisjan M.I.. Pain using buprenorphine transdermal therapeutic system after cardiac surgery. Health and medical devices. 2006; 4 (28): 4—7 (in Russian).
- Lebedeva R.N., Nikoda V.V. Pharmacotherapy of acute pain. Moscow: Publishing House "Air Art". 1998 (in Russian).
- Eremenko A.A., Sorokina L.S., Avetisjan M.I. Comparative evaluation of ketoprofen and lornoxicam for postoperative pain relief in cardiosurgical patients.
Cardiology and cardiovascular surgery. 2009; 6: 72 (in Russian).
*13. Еременко A.A., Аветисян M.И. Применение комбинированных анальгетиков в ранние сроки после кардиохирургических операций. 2005; 2: 28—32.
*14. Еременко A.A., Урбанов A.В., Аветисян M.И. Обезболивание при помощи трансдермальной терапевтической системы бупренорфина после кардиохирургических операций. Здравоохранение и медицинская техника. 2006; 4 (28): 4—7.
*15. Лебедева Р.Н., Никода В.В. Фармакотерапия острой боли. М.: АирАрт; 1998.
*16. Еременко A.A., Сорокина Л.С., Aветися M.И. Comparative evaluation of ketoprofen and lornoxicam for postoperative pain relief in cardiosurgical patients. Cardiol. Сardiovasc. Surg. 2009; 6: 72.
АНЕСТЕЗИОЛОГИЯ И РЕАНИМАТОЛОГИЯ № 5, 2013

