Массивные акушерские кровотечения: от гистерэктомии к фармакотерапии
А.П. Момот1, И.В. Молчанова2, В.Б. Цхай3
1 Алтайский филиал Гематологического научного центра Минздравсоцразвития России, Барнаул;
2 Главное управление по здравоохранению и фармацевтической деятельности при Администрации Алтайского края, Барнаул;
3 Красноярский государственный медицинский университет им. проф. В.Ф.Войно-Ясенецкого Минздравсоцразвития России
В работе проведена оценка эффективности использования рекомбинантного активированного фактора VII (rFVIIa) при массивных акушерских кровотечениях (МАК) у 75 женщин во время беременности, в родах и раннем послеродовом периоде в зависимости от причины кровотечений и объема кровопотери. В соответствии с использованными в работе критериями эффективности оптимальный гемостатический эффект rFVIIа был получен у женщин с массивным локальным (маточным) кровотечением, у которых применение данного препарата позволило избежать гистерэктомии в 80,8% случаев. В группе пациенток с МАК и синдромом диссеминированного внутрисосудистого свертывания применение rFVIIа было сравнительно менее эффективным. Таким образом, FVIIа является высокоэффективным гемостатическим средством в лечении женщин с МАК, у которых не получен ответ на традиционную гемостатическую терапию, применяемую в акушерской практике.
Ключевые слова: массивные акушерские кровотечения, гемостаз, синдром диссеминированного внутрисосудистого свертывания крови, рекомбинантный активированный фактор VII, гистерэктомия
Основной причиной, приводящей к гистерэктомии, а иногда и к гибели больных в акушерской практике, являются массивные акушерские кровотечения (МАК) [1–4].
По данным ВОЗ, МАК входят в «большую пятерку» причин материнской смертности, составляя в общей структуре 25–30%, что обусловливает постоянный интерес к различным методам их купирования [5, 6]. Ситуации, при которых возникают обильные кровотечения, такие как разрыв матки, преждевременная отслойка плаценты и ее вращение, атония матки, требуют интенсивных реанимационных мер и часто приводят к необходимости проведения гистерэктомии. Известно, что только 62–65% родов через естественные пути сопровождаются физиологической кровопотерей, 1/3 пациенток теряют от 500 до 1000 мл крови, а в 3–8% случаев объем кровопотери превышает 1,5% от массы тела роженицы и считается массивным, требующим трансфузии эритроцитной массы и зачастую удаления матки. По определению ВОЗ, патологической считается кровопотеря в объеме 500 мл и более во время или после родов либо любая кровопотеря после родов, которая является причиной нестабильности кровообращения [7].
Для акушерских кровотечений характерны внезапность и высокая скорость кровопотери, что при сниженных адаптивных возможностях организма роженицы на фоне соматических заболеваний и патологии беременности способствует быстрому развитию коагулопатии, явлений шока и полиорганной недостаточности [8].
Первичная помощь при МАК в большинстве стран мира рутинно включает применение средств, повышающих тонус матки, простагландинов, ручную ревизию полости матки и послеродовых путей, массаж матки, а при их неэффективности – гистерэктомию [9, 10].
В последние годы достаточно эффективными мерами остановки послеродовых кровотечений считается проведение ряда инвазивных манипуляций – маточной баллонной тампонады [11], деваскуляризации матки и наложения компрессионных швов [12], эмболизации маточных артерий [13], перевязки маточных и внутренних подвздошных артерий [14], являющихся альтернативой традиционной гистерэктомии. Перспективы для купирования МАК и уменьшения потребности в донорской крови наметились в последние годы и в области фармакологической коррекции гемостаза. В числе разных методов изучается эмпирическое использование рекомбинантного активированного фактора VII (rFVIIa) при лечении кровотечений, рефрактерных к общепринятой консервативной терапии.
Первое описание успешного лечения некупирующегося акушерского кровотечения с применением rFVIIa было опубликовано F.Moscardo и соавт. в 2001 г. [15]. Авторы сообщили о прекрасном гемостатическом эффекте rFVIIa при угрожающем жизни МАК после кесарева сечения у женщины с синдромом диссеминированного внутрисосудистого свертывания (ДВС), нарушениями функции печени и почечной недостаточностью. В дальнейшем G.Breborowicz и соавт. [16], описывая опыт лечения МАК с помощью rFVIIa, сообщили, что применение препарата позволило избежать проведения гистерэктомии в 2 из 6 случаев. В России первый успешный опыт применения rFVIIa у пациентки с тяжелым послеродовым кровотечением и синдромом массивных гемотрансфузий был получен в 2002 г. в клинике, руководимой проф. З.С.Баркаганом [17].
В данной работе мы представляем опыт использования rFVIIa для купирования МАК в крупных акушерских клиниках российских городов – Барнаула, Красноярска, Брянска и Сыктывкара.
Пациенты и методы В исследование были включены 105 пациенток с МАК, возникшими во время беременности (у 28, или 26,7% пациенток), родов (у 18, или 17,1% пациенток) и в послеродовом периоде (у 59, или 56,2% пациенток). Массивной мы считали кровопотерю, составляющую более 1,5% от массы тела пациентки, или любую меньшую по объему кровопотерю, приводящую к гемодинамическим нарушениям. Средний возраст пациенток составил 28,6 ± 6,3 года.
Дизайн исследования представлен на рисунке.
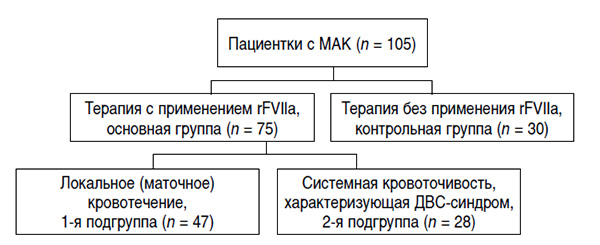
Основную группу составили 75 пациенток, у которых в качестве дополнения к классической схеме акушерской тактики при МАК использовали фармакологический гемостаз с применением rFVIIа. НовоСэвен® («Ново Нордиск», Дания) вводили внутривенно болюсно в дозе от 13,6 до 146,5 мкг/кг, в среднем доза rFVIIа составила 65,4 ± 36,7 мкг/кг. В связи с отсутствием строгих инструкций по применению rFVIIа в акушерской практике (препарат использовали вне зарегистрированных показаний) к введению препарата с учетом его высокой стоимости прибегали как к последнему средству в надежде избежать калечащих операций и/или тяжелых, угрожающих жизни осложнений.
В основной группе пациенток были выделены 2 подгруппы: 1-я подгруппа – 47 женщин с классической картиной акушерского кровотечения, 2-я подгруппа – 28 пациенток, у которых на фоне массивной кровопотери возник акушерский ДВС-синдром, определенный по критериям, приведенным C.LaBelle и C.Kitchens [18]. У женщин 1-й подгруппы rFVIIa в ходе остановки МАК был применен с целью остановки локального маточного кровотечения без проведения лапаротомии и гистерэктомии. Во 2-й подгруппе до введения rFVIIa классическая схема остановки МАК была выполнена в полном объеме с использованием известных методов хирургического вмешательства, вплоть до гистерэктомии у 16 (57,1%) пациенток. При этом у пациенток с ДВС-синдромом отмечалась системная кровоточивость (подкожные гематомы, кровотечения из мест инъекций, желудочнокишечные кровотечения, гематурия и другие проявления в различных сочетаниях), представлявшая угрозу для жизни.
Контрольную группу составили 30 пациенток с МАК, лечение которых осуществляли по классической технологии, включавшей использование препаратов, сокращающих матку, массаж матки, ручное обследование полости матки, инфузионную и трасфузионную терапию с применением свежезамороженной плазмы (СЗП), препаратов крови – эритроцитной массы и тромбоконцентрата, ингибиторов протеаз, а также хирургических методов гемостаза, что согласуется с рекомендациями ряда экспертов [18–23].
Сравниваемые группы пациенток статистически значимо не различались по возрасту женщин, сроку беременности при возникновении МАК, методам родоразрешения, акушерскому и соматическому анамнезу (заболевания репродуктивной, сердечно-сосудистой систем, наличие очагов хронической инфекции, вирусное и токсическое поражение печени).
Для оценки эффективности использования rFVIIa в комплексном лечении МАК выделяли критерии неблагоприятных исходов – ранних и поздних. К ранним неблагоприятным исходам относили:
• объем кровопотери 2200 мл и более;
• скорость кровопотери более 30 мл/мин;
• концентрацию гемоглобина (Hb) 60 г/л и менее;
• время от начала кровотечения до введения rFVIIa более 120 мин в основной группе (в контрольной группе – время от начала кровотечения до его остановки).
К поздним неблагоприятным исходам относили тотальную гистерэктомию и летальный исход, как для матери, так и для плода.
Статистическую обработку полученных данных проводили с помощью программы Excel фирмы “Microsoft” по стандартным методикам вычислений показателей описательной статистики. Значения показателей представлены в виде средней величины и ошибки средней (M ± m). Для сравнения данных в малых группах использовали непараметрические критерии – Фишера, χ2-критерий с поправкой Бонферрони, а также Т-критерий Вилкоксона. Оценку эффективности применения rFVIIa для лечения МАК проводили с использованием критериев доказательной медицины, при этом вычисляли снижение абсолютного риска (absolute risk reduction – ARR), снижение относительного риска (relative risk reduction – RRR), число пациенток, которых необходимо лечить, чтобы предотвратить неблагоприятный исход (number needed to treat – NNT), отношение шансов (odds ratio – ОR), 95% доверительный интервал (ДИ). Различия между сравниваемыми параметрами считали статистически значимыми при p ≤ 0,05.
Результаты исследования и их обсуждение
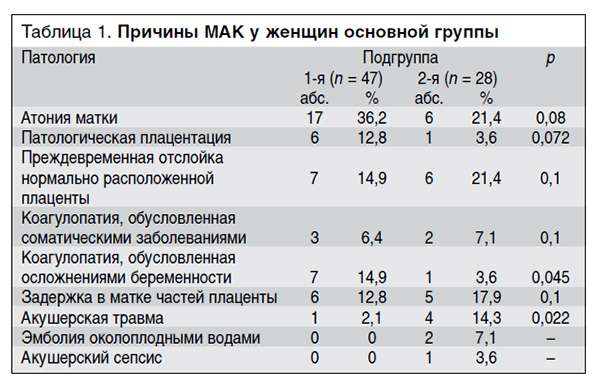
Отклонения в течение беременности в известной мере определяли и характер осложнений в родах и послеродовом периоде, ставших причиной развития МАК (табл. 1).
Основными причинами МАК у женщин основной группы, как в 1-й, так и во 2-й подгруппе, были атония матки, преждевременная отслойка нормально расположенной плаценты и задержка в матке частей плаценты. Статистически значимых различий в частоте встречаемости этих патологических изменений в качестве причины МАК в двух подгруппах пациенток не выявлено. В подгруппе пациенток с локальным (маточным) кровотечением статистически значимо чаще наблюдалась коагулопатия, обусловленная осложнениями беременности (14,9 против 3,6%; p = 0,045), а в подгруппе пациенток с ДВС-синдромом – акушерская травма (разрыв матки и мягких тканей родовых путей – 14,3 против 2,1%; p = 0,022).
Эмболия околоплодными водами и акушерский сепсис наблюдались только в подгруппе пациенток с ДВС-синдромом.
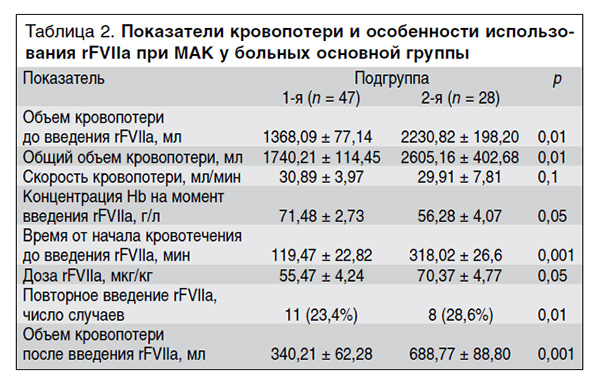
Анализ параметров кровопотери выявил существенные различия в подгруппах основной группы (табл. 2). Так, общий объем кровопотери и кровопотеря до введения rFVIIa в подгруппе женщин с локальным (маточным) кровотечением были статистически значимо меньше, чем в подгруппе женщин, у которых развился ДВС-синдром (1740,21 ± 114,45 против 2605,16 ± 402,68 мл; p = 0,01 и 1368,09 ± 77,14 против 2230,82 ± 198,2 мл; p = 0,01 соответственно).
Время от начала кровотечения до введения rFVIIа было статистически значимо больше в подгруппе пациенток с акушерским ДВС-синдромом (318,02 ± 26,6 против 119,47 ± 22,82 мин; p = 0,001). Очевидно, это связано с тем, что rFVIIа рассматривается акушерами и реаниматологами как резервное средство купирования МАК после использования известных гемостатических технологий, включая гистерэктомию.
Следует обратить внимание на то, что доза вводимого rFVIIa и доля пациенток, получивших повторное введение препарата, были статистически значимо больше в подгруппе пациенток с ДВС-синдромом (70,37 ± 4,77 против 55,47 ± 4,24 мкг/кг; p = 0,05 и 28,6 против 23,4%; p = 0,01 соответственно).
Несмотря на это, кровотечение во 2-й подгруппе пациенток продолжалось и после применения rFVIIa, о чем свидетельствовал статистически значимо больший объем кровопотери в этой подгруппе по сравнению с подгруппой пациенток с локальным (маточным) кровотечением (688,77 ± 88,80 против 340,21 ± 62,28 мл; p = 0,001).
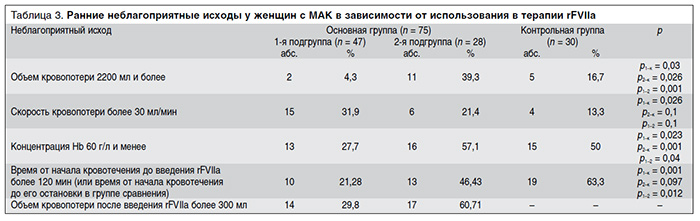
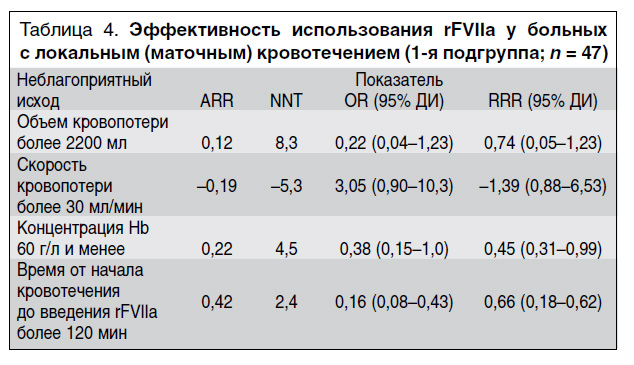
Количество ранних неблагоприятных исходов в группах/подгруппах сравнения представлено в табл. 3, из которой видно, что в подгруппе женщин с локальным (маточным) кровотечением, которым вводили rFVIIa, наблюдалось наибольшее количество женщин с высоким темпом кровопотери (более 30 мл/мин). Несмотря на это, доля пациенток в этой подгруппе, у которых развились такие неблагоприятные исходы, как объем кровопотери более 2200 мл и концентрация Hb менее 60 г/л, была статистически значимо меньше, чем в контрольной группе и в подгруппе пациенток с ДВС-синдромом.
В отличие от 1-й подгруппы доля пациенток во 2-й подгруппе, у которых развились такие неблагоприятные исходы, как объем кровопотери более 2200 мл и концентрация Hb менее 60 г/л, была статистически значимо больше, чем в контрольной группе (см. табл. 3).
Оценка эффективности применения rFVIIa по критерию «объем кровопотери» у больных 1-й подгруппы показала снижение относительного риска на 74%, по критерию «анемия» – на 45%, по критерию «раннее введение препарата» (менее чем через 120 мин от начала кровотечения) – на 66%, что свидетельствует о высокой клинической эффективности применения rFVIIa в комплексной терапии МАК, не осложненных ДВС-синдромом. Чтобы предотвратить 1 неблагоприятный исход по всем указанным критериям, количество пролеченных больных этой группы должно составлять от 2,4 до 8,3 (табл. 4).
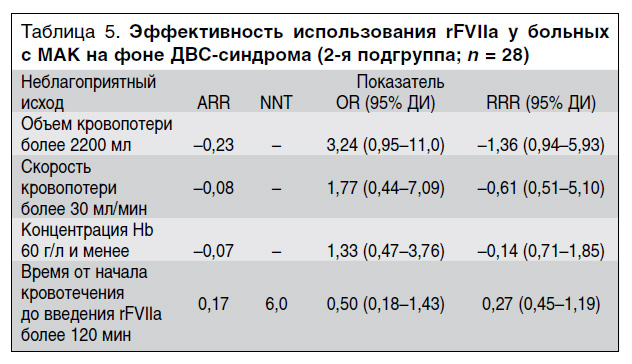
У женщин с системной кровоточивостью на фоне ДВС-синдрома почти для всех критериев неблагоприятных исходов значение ARR оказалось отрицательным, за исключением критерия «раннее введение препарата» (менее чем через 120 мин от начала кровотечения) (табл. 5). Это свидетельствует о том, что частота неблагоприятных исходов во 2-й подгруппе основной группы была выше, чем в контрольной группе. Значение RRR при раннем введении rFVIIa (в течение 120 мин от момента начала кровотечения) составило 27%, что свидетельствует о наличии клинического эффекта от применения препарата.
Таким образом, по результатам проведенного анализа можно сделать заключение, что клиническая эффективность rFVIIa в комплексном лечении МАК наиболее высока у пациенток с локальным (маточным) кровотечением, а у пациенток с развившимся акушерским ДВС-синдромом препарат дает эффект только при раннем введении.
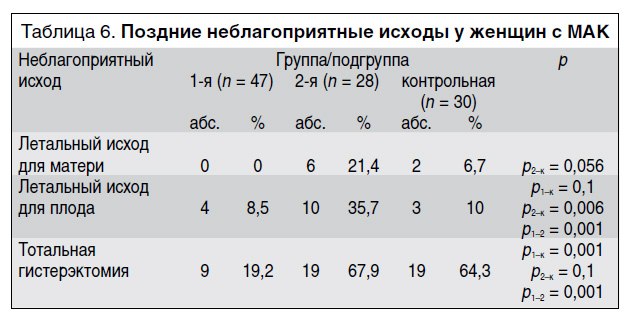
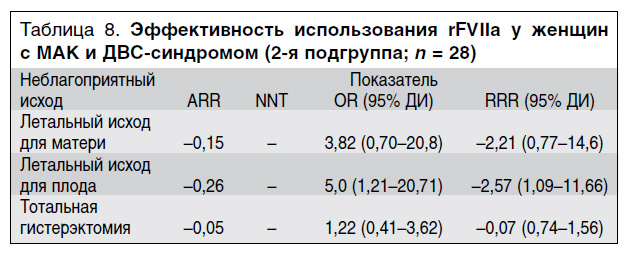
Мы также оценили количество поздних неблагоприятных исходов в группах/подгруппах сравнения (табл. 6–8).
Количество летальных исходов для плода во 2-й подгруппе было статистически значимо больше, чем в 1-й подгруппе и в контрольной группе. Количество случаев гистерэктомии в 1-й подгруппе было статистически значимо меньше, чем в контрольной группе и во 2-й подгруппе (см. табл. 6).
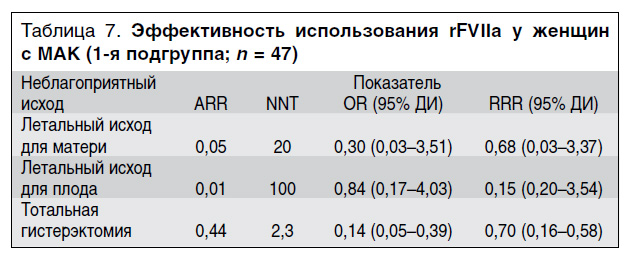
Ниже приводится раздельный анализ по каждому критерию (см. табл. 7, 8). Хотя летального исхода для матери в 1-й подгруппе не было, была смоделирована ситуация с 1 возможным летальным исходом. Данных, свидетельствующих о влиянии введения rFVIIa в комплексном лечении МАК на частоту летального исхода у плода, в группах сравнения не получено (см. табл. 7, 8), что позволяет сделать вывод об отсутствии значимого влияния введения rFVIIa на потерю плода. У пациенток с МАК и акушерским ДВС-синдромом (2-я подгруппа) введение rFVIIа не оказывало влияния на частоту летального исхода для матери и на частоту тотальной гистерэктомии, значения ARR и RRR для этих критериев оказались отрицательными или практически равными нулю. В отличие от 2-й подгруппы у пациенток с массивным локальным (маточным) кровотечением, которым вводили rFVIIа (1-я подгруппа), по критериям «летальный исход для матери» и «тотальная гистерэктомия» получен положительный клинический результат. Снижение относительного риска по критерию «летальный исход для матери» составило 68%, по критерию «тотальная гистерэктомия» – 70%, что всегда соответствовало клиническому эффекту по сохранению репродуктивной функции матери. Чтобы предотвратить 1 неблагоприятный исход по указанным критериям необходимо пролечить от 2,3 до 20 больных этой группы.
При отдельном изучении каждого случая гистерэктомии у пациенток с локальным (маточным) кровотечением (9 случаев, или 19,2%) было установлено, что использование rFVIIа было неэффективным у пациенток, у которых кровотечение возникло по причине патологической плацентации (вращения плаценты в 5 наблюдениях из 9) и развития матки Кювелера (в 4 случаях из 9) вследствие преждевременной отслойки плаценты.
Ранее было показано, что применение rFVIIa дает сравнительно худший гемостатический эффект у больных с тяжелой коагулопатией, ацидозом и гипотермией [24–29]. В этих работах было установлено, что эффективный гемостаз при применении rFVIIa можно ожидать при следующих показателях:
• протромбиновое время не более чем в 1,5 раза выше нормы;
• концентрация фибриногена более 1 г/л;
• количество тромбоцитов более 50,0 × 109/л;
• pH крови более 7,1; • отсутствие гипотермии.
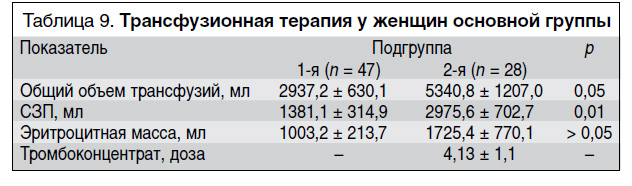
В настоящем исследовании проводили трансфузионную терапию, направленную на восстановление гемостатических свойств крови, поддержание кислотно-основного равновесия, количества эритроцитов для обеспечения тканей кислородом, с коррекцией указанных параметров. Объем и состав этой терапии в основной и контрольной группах практически не отличались. Однако объем трансфузионной терапии у пациенток с МАК и ДВС-синдромом (2-я подгруппа) был статистически значимо больше, чем у пациенток 1-й подгруппы (табл. 9). Кроме того, у женщин 2-й подгруппы объем использованной СЗП был статистически значимо больше (2975,6 ± 702,7 против 1381,1 ± 314,9 мл; p = 0,01), так как в этой подгруппе пациенток дефицит факторов свертывания был более выраженным, чем у пациенток 1-й подгруппы. Статистически значимых различий в объеме эритроцитной массы между сравниваемыми подгруппами не получено. МАК у пациенток без ДВС-синдрома не привело к выраженному дефициту тромбоцитов в отличие от женщин, у которых развился ДВС-синдром и которым были перелиты в среднем 4,13 ± 1,1 дозы тромбоцитов.
Нас также интересовала вероятность развития артериальных и венозных тромбозов на фоне применения rFVIIа.
Так же, как M.Franchini и соавт. [20] (75 случаев лечения rFVIIa женщин с МАК), Т.А.Федорова и соавт. [25] (55 наблюдений), мы не выявили каких-либо признаков сосудистого тромбоза. В целом большинство тромботических осложнений при применении rFVIIa имеют артериальное происхождение и наблюдаются у пациентов с существующими ранее факторами тромбогенного риска [30].
Заключение
Полученные нами данные свидетельствуют о том, что rFVIIа является высокоэффективным гемостатическим средством для лечения МАК у женщин, у которых не получен ответ на классические методы гемостатической терапии, используемые в акушерской практике. В соответствии с использованными в настоящей работе критериями эффективности наиболее выраженный гемостатический эффект rFVIIa был получен у женщин с массивным локальным (маточным) кровотечением, у которых применение препарата позволило избежать гистерэктомии в подавляющем большинстве случаев (80,8%), в сочетании с отсутствием летальных исходов у пациенток (см. табл. 7).
Сравнительно более низкая гемостатическая эффективность в этой подгруппе наблюдалась у женщин, у которых причиной МАК явились тотальная отслойка нормально расположенной плаценты с возникновением матки Кювелера и истинное вращение плаценты. В подгруппе пациенток с акушерским ДВС-синдромом и МАК применение rFVIIа также может быть оправданным по жизненным показаниям, хотя и сравнительно менее эффективным. В случаях акушерского ДВС-синдрома и МАК гемостатический эффект rFVII возможен в качестве заместительной, а не патогенетической терапии. Случаи неуспеха фармакологической коррекции кровотечений rFVIIа могут быть объяснены резистентностью, в силу разных причин, свертывающей системы крови к активации избыточным количеством FVIIа [20, 24, 31].
В ряде анализируемых случаев доза rFVIIa была явно заниженной по сравнению с дозами, используемыми у больных гемофилией (90–120 мкг/кг), что было связано с недостаточным количеством имеющегося в наличии препарата. Такое снижение дозы мы считаем нецелесообразным, поскольку использование явно заниженных доз препарата не позволяет рассчитывать на адекватный гемостатический эффект. Для купирования МАК минимально необходимая доза rFVIIa должна составлять 50 мкг/кг. Повторное введение rFVIIа может быть эффективным лишь после исключения ацидоза и гипотермии, а также при соблюдении интервала, не превышающего 2–3 ч от первой инъекции.
На основании полученных данных мы считаем целесообразным включить rFVIIa в схему терапии МАК, предложенную ВОЗ [7], с целью снижения числа радикальных вмешательств.
Следует подчеркнуть, что наши собственные и доступные в настоящее время в литературе данные по этой важной проблеме получены в неконтролируемых и нерандомизированных исследованиях, проведение которых невозможно по этическим причинам в акушерской практике критических состояний [27].
В течение последних 3 лет на территории РФ применяется препарат Коагил-VII (ОАО «Фармстандарт», Россия).
За это время накоплен опыт применения препарата как при гемофилии, так и вне зарегистрированных показаний (off-label), в том числе при МАК. В 2010 г. на базе Гематологического научного центра Минздравсоцразвития (Москва) было завершено сравнительное исследование, в рамках которого проведен анализ фармакокинетики препаратов Коагил-VII и НовоСэвен®. Результаты исследования показали, что оба препарата идентичны по своей фармакокинетике, статистически значимых различий в показателях диагностических коагулометрических тестов при использовании двух препаратов не выявлено. Накопленный клинический опыт показал высокую эффективность препарата Коагил-VII.
- Острая массивная кровопотеря. Воробьев А.И., Городецкий В.М., Шулутко Е.М. и др. М.: ГЭОТАР-мед; 2001.
- Баркаган З.С., Момот А.П. Современные аспекты патогенеза, диагностики и терапии ДВС-синдрома. Вестник гематологии 2005; 1(2): 5–14.
- Макацария А.Д., Бицадзе В.О. Синдром диссеминированного внутрисосудистого свертывания в акушерской практике. М.: Триада-X; 2002.
- Радзинский В.Е., Костин И.Н. Безопасное акушерство. Акушерство и гинекология 2007; 5: 12–6.
- Baudo F., Caimi T.M., Mostarda G., de Cataldo F., Morra E. Critical bleeding in pregnancy: a novel therapeutic approach to bleeding. Minerva Anestesiol 2006; 72(6): 389–93.
- Make every mother and child count: the World Health Report. Geneva: WHO; 2005.
- WHO guidelines for the management of postpartum haemorrhage and retained placenta. Geneva: WHO; 2009.
- Macphail S., Talks K. Massive post-partum haemorrhage and management of disseminated intravascular coagulation. Curr Obstet Gynaecol 2004; 14(2): 123–31.
- Abdel-Aleem H., Singata M., Abdel-Aleem M., Mshweshwe N., Williams X., Hofmeyr G.J. Uterine massage to reduce postpartum hemorrhage after vaginal delivery. Int J Gynaecol Obstet 2010; 111(1): 32–6.
- Henrich W., Surbek D., Kainer F., Grottke O., Hopp H., Kiesewetter H., et al. Diagnosis and treatment of peripartum bleeding. J Perinat Med 2008; 36(6): 467–78.
- Penninx J.P.M., Pasmans H.L.M., Oei S.G. Arterial balloon occlusion of the internal iliac arteries for treatment of life-threatening massive postpartum haemorrhage: a series of 15 consecutive cases. Eur J Obstet Gynecol Reprod Biol 2010; 148(2): 131–4.
- Sentilhes L., Gromez A., Trichot C., Ricbourg-Schneider A., Descamps P., Marpeau L. Fertility after B-Lynch suture and stepwise uterine devascularization. Fertil Steril 2009; 91(3): 934. e5–9.
- Irion O., Terraz S., Boulvain M., Boehlen F., Becker C.D. Postpartum hemmorhage: prevention and treatment by arterial embolization and activated recombinant factor VII. Rev Med Suisse 2008; 4(176): 2269–70; 2272; 2274–5.
- Papp Z., Tоth-Pаl E., Papp C., Sziller I., Gavai M., Silhavy M., et al. Hypogastric artery ligation for intractable pelvic hemorrhage. Int J Gynaecol Obstet 2006; 92(1): 27–31.
- Moscardo F., Pеrez F., de la Rubia J., Balerdi B., Lorenzo J.I., Senent M.L., et al. Successful treatment of severe intra-abdominal bleeding associated with disseminated intravascular coagulation using recombinant activated factor VII. Br J Haematol 2001; 114(1): 174–6.
- Breborowicz G.H., Sobieszczyk S., Szymankiewicz M. Efficacy of recombinant activated factor VII (rFVIIa, NovoSeven) in prenatal medicine. Arch Perinat Med 2002; 8: 21–7.
- Баркаган З.С., Мамаев А.Н., Морозова Л.И., Мамаева И.В. Первый опыт успешного применения рекомбинантного активированного фактора VII в терапии терминальной фазы акушерского ДВС-синдрома. Тромбоз, гемостаз и реология 2006; 1: 72–3.
- Ahonen J., Stefanovic V., Lassila R. Management of postpartum haemorrhage. Acta Anaesthesiol Scand 2010; 54(10): 1164–78.
- Franchini M., Lippi G., Franchi M. The use of recombinant activated factor VII in obstetric and gynaecological haemorrhage. Br J Obstet Gynaecol 2007; 114(1): 8–15.
- LaBelle C., Kitchens C.S. Disseminated intravascular coagulation. In: Kitchens C.S., Alving B.M., Kessler C.M., eds. Consultative hemostasis and thrombosis. 2nd ed. Philadelphia: Elsevier; 2007: 183–209.
- Phillips L.E., McLintock C., Pollock W., Gatt S., Popham P., Jankelowitz G., et al. Recombinant activated factor VII in obstetric hemorrhage: experiences from the Australian and New Zealand Haemostasis Registry. Anesth Analg 2009; 109(6): 1908–15.
- Sobieszczyk S., Breborowicz G.H., Platicanov V., Tanchev S., Kessler C.M. Recombinant factor VIIa in the management of postpartum bleeds: an audit of clinical use. Acta Obstet Gynecol Scand 2006; 85(10): 1239–47.
- Welsh A., McLintock C., Gatt S., Somerset D., Popham P., Ogle R. Guidelines for the use of recombinant activated factor VII in massive obstetric haemorrhage. Aust N Z J Obstet Gynaecol 2008; 48(1): 12–6.
- Бокерия Л.А., Самсонова Н.Н., Плющ М.Г. Ким А.И., Козар Е.Ф. Применение рекомбинантного активированного VII фактора свертывания крови в клинической практике. Анналы хирургии 2004; 1: 5–10.
- Федорова Т.А., Стрельникова Е.В., Рогачевский О.В. Анализ многоцентрового применения рекомбинантного коагуляционного фактора VII (НовоСэвен в лечении массивных акушерских кровотечений). Акушерство и гинекология 2008; 4: 48–52.
- Шулутко Е.М., Щербакова О.В., Синауридзе Е.И. Опыт использования рекомбинантного фактора VII в клинической практике. В кн.: Новые медицинские технологии в акушерстве, гинекологии и неонатологии: клинические лекции, тезисы докладов. Т.А. Федорова, ред. М.: Медиа Сфера; 2005: 23–5.
- Bomken C., Mathai S., Biss T., Loughney A., Hanley J. Recombinant activated factor VII (rFVIIa) in the management of major obstetric haemorrhage: a case series and a proposed guideline for use. Obstet Gynecol Int 2009; 2009: 364843.
- Martinowitz U., Michaelson M. Guidelines for the use of recombinant activated factor VII (rFVIIa) in uncontrolled bleeding: a report by the Israeli Multidisciplinary rFVIIa Task Force. J Thromb Haemost 2005; 3(4): 640–8.
- Mittal S., Watson H.G. A critical appraisal of the use of recombinant factor VIIa in acquired bleeding conditions. Br J Haematol 2006; 133(4): 355–63.
- Biss T.T., Hanley J.P. Recombinant activated factor VII (rFVIIa/NovoSeven) in intractable haemorrhage: use of a clinical scoring system to predict outcome. Vox Sang 2006; 90(1): 45–52.
- Verre M., Bossio F., Mammone A., Piccirillo M., Tancioni F., Varano M. Use of recombinant activated factor VII in a case of severe postpartum haemorrhage. Minerva Ginecol 2006; 58(1): 81–4.
Вопросы гематологии/онкологии и иммунопатологии в педиатрии

