Неопиоидный анальгетик центрального действия нефопам в комплексном послеоперационном обезболивании онкохирургических вмешательств
В.Э. ХОРОНЕНКО, В.В. ПЕТРОВА, И.И. СТЕНИНА
ФГБУ «Московский научно-исследовательский онкологический институт им. П.А. Герцена»
Цель исследования — оценить эффективность и безопасность применения неопиоидного анальгетика центрального действия нефопама в составе мультимодальной анестезии и послеоперационного обезболивания у онкохирургических больных абдоминального профиля. Материал и методы. Клиническое исследование выполнено у 317 больных (средний возраст 56,7±10,2 года), перенесших радикальные абдоминальные онкологические операции в условиях сочетанной системной и эпидуральной анестезии. Проанализирована эффективность и безопасность использования нефопама в качестве компонента анестезиологической защиты пациента во время и после операции.
Результаты. На фоне применения нефопама 25% больных не нуждались в дополнительном введении опиоидного анальгетика, что свидетельствует о высокой анальгетической способности препарата. В 75% наблюдений в первые 2 сут. требовалось введение тримеперидина в дозе от 20 мг до 40 мг.
В 1-е сутки средняя доза опиоида составила 29,3±11,2 мг, ко 2-м суткам доза опиоида существенно снилась и составила 18,9±12,4 мг, на 3-и сутки после операции в дополнительном введении опиоида нуждалось лишь 80 (31%) пациентов из 250, на 4-е сутки потребность наркотическом анальгетике ни один из исследуемых пациентов не отметил. Заключение. Нефопам показал высокую эффективность в профилактике и лечении послеоперационного болевого синдрома, острой опиоидной толерантности и мышечной дрожи. Использование нефопама как компонента послеоперационной аналгезии позволило существенно снизить потребность в опиоидном анальгетике, достичь полноценного обезболивания и избежать депрессии ЦНС и дыхания. Побочных эффектов препарата в применяемой дозе ни в одном наблюдении выявлено не было.
Ключевые слова: онкохирургия, послеоперационная боль, послеоперационный озноб, превентивная аналгезия, нефопам.
Современная онкохирургия характеризуется стремлением к максимальному радикализму, что сопровождается значительным расширением объема операций, осуществлением комбинированных доступов, одновременной работой в двух и более полостях, резекцией нескольких органов, обширной лимфаденэктомией.
Выполнение подобных вмешательств невозможно без адекватной анестезиологической защиты больного. Последние достижения анестезиологии и интенсивной терапии позволили существенно снизить риск осложнений при таких онкологических операциях и успешно осуществлять хирургическое лечение больных, в том числе с низкими функциональными резервами. Однако слабым звеном в обеспечении безопасности и комфортности больных после операции является период пробуждения, когда действие наркотического анальгетика короткого действия уже окончилось, а дополнительные компоненты обезболивания еще не вступили в полную активность.

В этом случае нередко развиваются послеоперационный озноб, дрожь, острый болевой синдром, что может сопровождаться гипердинамическими реакциями кровообращения, тошнотой, рвотой. Введение сильного наркотического анальгетика на этом этапе может привести к развитию нежелательных эффектов — депрессии сознания и дыхания, нередко требующих интенсивной терапии, вплоть до реанимационных мероприятий [1—3].
В этой связи в последние годы существенно возрос интерес к неопиодному анальгетику центрального действия нефопаму (акупан, «Biocodex», Франция), включение которого в схему послеоперационного обезболивания в комбинации с опиоидным анальгетиком может уменьшить дозу последнего без потери качества аналгезии и избежать опиоидопосредованного побочного действия [3—5].
Анальгетические свойства нефопама основываются на подавлении обратного захвата серотонина, норадреналина и дофамина, усилении нисходящих тормозных серотонинергических и норадренергических эффектов.
Нефопам влияет также на глутаминергическую передачу через модуляцию кальциевых и натриевых ионных каналов, подавляя активность NMDA-рецепторов [4—6].
Последние исследования показали, что использование нефопама позволяет предотвратить развитие послеоперационной мышечной дрожи, связанной с гипотермией после общей анестезии, и в этом качестве существенно превосходит различные комбинации препаратов, применяемых с этой целью [1—5].
Кроме того, многие исследователи считают, что нефопам в индивидуальных дозах безопасен для обезболивания у пожилых пациентов и пациентов в различных критических состояниях [7—9]. Эффективен и безопасен препарат как для послеоперационного обезболивания у кардиохирургических больных, так и у больных ортопедического и акушерско-гинекологического профиля [10—14].
Нефопам не входит в перечень препаратов, находящихся под международным контролем использования, не списывается как истинный наркотик, обладая при этом анальгетическим эффектом по силе и длительности превосходящим трамадол. Побочными реакциями нефопама являются потливость, сонливость, атропиноподобные реакции [4, 5].
Обезболивание наряду с инфузионной терапией, профилактикой венозных тромбоэмболических и инфекционных осложнений является важной частью хирургического лечения, во многом определяющей не только его непосредственные результаты, но и качество жизни оперированных пациентов в последующем. Целью настоящего исследования явилась разработка новых подходов к эффективному обезболиванию больших по объему и травматичных онкохирургических вмешательств и обеспечению безопасности и комфортности послеоперационного периода.
Основной задачей исследования была оценка эффективности и безопасности использования нефопама как компонента мультимодальной послеоперационной аналгезии для предотвращения острой опиоидной толерантности, озноба и гипердинамических реакций кровообращения на этапе выхода из анестезии.
Материал и методы
Клиническое исследование выполнено у 317 больных в возрасте от 40 лет до 71 года (средний возраст 56,7±10,2 года), перенесших радикальные операции по поводу новообразований брюшной полости, забрюшинного пространства и малого таза. Мужчин было 186, женщин — 131. Распределение больных по виду оперативного вмешательства представлено в табл. 1.
По категории физического статуса с учетом основного и сопутствующих заболеваний кардиореспираторной системы большинство больных относились к классу 2—3 ASA. Масса тела исследуемых варьировала от 57 до 98 кг, составляя в среднем 74,2±13,4 кг.
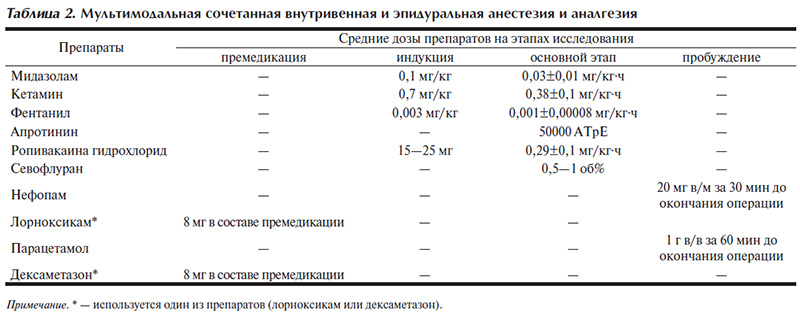
Анестезиологическое обеспечение хирургических вмешательств осуществлялось по принятой в институте методике, основанной на принципе мультимодальности [2, 16]. Накануне все пациенты получали премедикацию, включающую препараты бензодиазепинового ряда, и в день операции препараты бензодиазепинового ряда, холинолитик атропин, нестероидные или стероидные анальгетики (лорноксикам 8 мг или дексаметазон 8 мг внутримышечно). Использовали сочетанную анестезию на основе ингаляционного анестетика севофлурана (севоран, «Abbott», США) в комбинации с внутривенным введением опиоидного анальгетика фентанила и эпидуральным введением ропивакаина гидрохлорида (наропин, «Astra Zeneca», Великобритания). Средние дозы препаратов приведены в табл. 2.
Уровень пункции эпидурального пространства выбирали в зависимости от зоны оперативного вмешательства: при гастрэктомии, в том числе расширенной, абдоминальным доступом с лимфаденэктомией D2 — ThVIII— ThIX; при радикальных операциях по поводу колоректального рака — ThXI—LI, при цистпростатвезикулэктомии с тонкокишечной пластикой — ThXI—LII с проведением катетера на 3—4 см в краниальном направлении. Непрерывную эпидуральную инфузию анестетика осуществляли с помощью шприцевой помпы из расчета 50 мг на 10 мл со скоростью 5—10 мл в час (25—50 мг/ч). Обычная доза наропина при операциях длительностью до 3 ч не превышала 75 мг; при более длительных операциях продолжали инфузию анестетика со скоростью 25 мг/ч.
Новым элементом периоперационной анестезиологической защиты в нашем исследовании было использование неопиоидного анальгетика центрального действия нефопама. Первое введение нефопама в дозе 20 мг осуществляли внутримышечно за 30 мин до окончания операции. Далее препарат вводили планово в течение 3 сут после операции по 20 мг 4 раза в сутки. Параллельно проводили послеоперационную аналгезию 0,2% раствором наропина в виде постоянной инфузии со скоростью 4—8 мл/ч и внутримышечное введение лорноксикама 16 мг в сутки или парацетамола 3 г/сут. На этом фоне опиоидный анальгетик тримеперидин (промедол, Россия) в дозе 20 мг вводили по требованию, при наличии у больного жалоб на боль, превышающую 3—4 балла по визуально-аналоговой шкале (ВАШ), где 0 — отсутствие боли, 10 — нестерпимая боль (рисунок).
Результаты и обсуждение
В процессе проведения общей анестезии осложнений не отмечено. По окончании операции все больные, вошедшие в исследование, просыпались и были экстубированы на операционном столе при отсутствии жалоб на боль, признаков психомоторного возбуждения, мышечной дрожи и гипердинамических сердечно-сосудистых реакций. В послеоперационном периоде проводили комплексное послеоперационное обезболивание (табл. 3). Болевые ощущения фиксировали согласно опросу по ВАШ (см. рисунок). Наркотический анальгетик тримеперидин (20 мг подкожно) применяли, если болевые ощущения у пациента превышали 3—4 балла.
Анализ результатов послеоперационного обезболивания в отделении интенсивной терапии показал, что на фоне применения нефопама 25% больных не нуждались в дополнительном введении опиоидного анальгетика, что свидетельствует о высокой анальгетической способности препарата и в целом совпадает с данными мирового опыта [4—6, 8]. В 75% наблюдений в первые 2 сут требовалось введение тримеперидина в дозе от 20 мг до 40 мг. В 1-е сутки средняя доза опиоида составила 29,3±11,2 мг, ко 2-м суткам доза опиоида существенно снизилась и составила 18,9±12,4 мг, на 3-и сутки после операции в дополнительном введении опиоида нуждалось лишь 80 (31%) пациентов из 250. Доза вводимого опиоидного анальгетика была ниже, чем в 1-е сутки послеоперационного периода — 27,5±12,4 мг. На 4-е сутки потребность в наркотическом анальгетике ни один из исследуемых пациентов не отметил.
При анализе болевых ощущений по ВАШ использование приведенной методики обезболивания позволило достичь отличного и хорошего результата (1—2 балла) у 60% пациентов. Низкая потребность в дотации опиоидного анальгетика позволила минимизировать седативный эффект. Атропиноподобные побочные реакции, присущие нефопаму, в наших наблюдениях полностью отсутствовали. У 40% пациентов эффект обезболивания оценен как хороший и удовлетворительный (3—4 балла по ВАШ).
Этой части больных требовалось введение минимальных доз опиоидного анальгетика — 20 мг тримеперидина 1— 2 раза в сутки, что не привело к развитию побочных эффектов, свойственных истинным агонистам μ-рецепторов.
Эффект обезболивания после однократного введения нефопама внутримышечно в дозе 20 мг составил в среднем 4±0,2 ч.
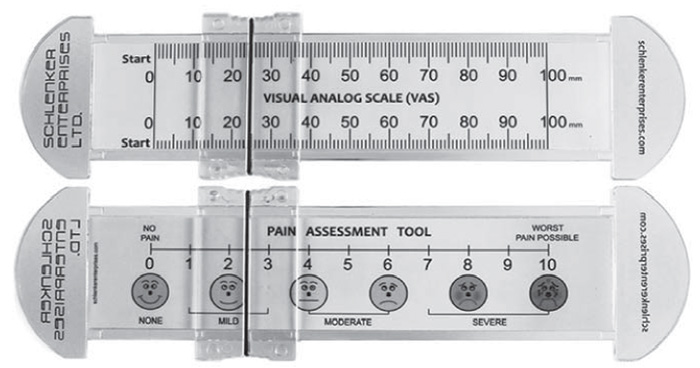
Визуально-аналоговая шкала Визуально-аналоговая шкала (ВАШ) представляет собой линию, разделенную на 10 равных отрезков, каждый из которых соответствует одному баллу: 0 означает отсутствие боли, 1—3 балла — слабая боль, 4—6 — умеренная, 7—8 — сильная, 9—10 — максимально возможная боль.

На фоне хорошего качества послеоперационного обезболивания больные были спокойны, адекватны, выполняли рекомендуемые движения, дыхательную гимнастику, откашливание. Показатели кровообращения, газообмена, метаболического компонента КОС оставались в пределах физиологических границ и достоверно не различались от исходных. Динамика лабораторных показателей указывала на отсутствие послеоперационной гипергликемии, азотемии, гипербилирубинемии и тромбоцитопении, отмечалось умеренное снижение гемоглобина. Перевод в профильное отделение осуществляли на 3-и сутки.
Побочных эффектов, связанных с введением нефопама, не наблюдали.
Выводы
- Профилактическое (за 30 мин до окончания операции) внутримышечное введение нефопама предотвращает развитие послеоперационного озноба и гипердинамических реакций у 100% больных.
- Нефопам в составе мультимодальной послеоперационной аналгезии позволяет снизить дозы опиоидного анальгетика до минимальных (20—40 мг тримеперидина в сутки) у 75% пациентов, а в 25% случаев вовсе отказаться от его применения.
- Мультимодальный подход к послеоперационному обезболиванию, основанный на применении комплекса препаратов разного механизма действия, позволяет полноценно и безопасно использовать его после обширных и травматичных онкологических операций при минимальном расходе опиоидных анальгетиков.
- Побочных эффектов, связанных с использованием нефопама в рекомендуемых дозах, в проведенном исследовании не выявлено.
- Климчук Л.В. Опыт применения акупана для профилактики послеоперационной дрожи после хирургических вмешательств в онкологии. Медицина неотложных состояний. 2013; 2: 85—8.
- Осипова Н.А., Петрова В.В. Боль в хирургии. Средства и способы защиты. М.: МИА; 2013. 446 с.
- Richebe P., Picard W., Rivat C., Jelacic S. et al. Eff ects of nefopam on early postoperative hyperalgesia after cardiac surgery. J. Cardiothorac. Vasc. Anesth. 2013; 3: 427—35.
- Андрющенко В.П., Маглеванный В.А., Куновский В.В. Принципиально новый подход к купированию острого болевого синдрома (обзор литературы). Медицина неотложных состояний. 2013; 2: 9—12.
- Овечкин А.М. Роль и место нефопама (акупана) в схемах мультимодальной послеоперационной анальгезии (обзор литературы). Регионарная анестезия и лечение острой боли. 2001; 5 (4): 5—12.
- Delage N., Maaliki H., Beloenil H. et al. Median eff ective dose (ED50) of nefopam and ketoprofen in postoperative patients: a study of interaction using sequential analysis and isobolographic analysis. Anesthesiology. 2005; 102 (6): 1211—6.
- Chanques G., Sebbane M., Constantin J.M. et al. Analgesic effi cacy and hemodynamic eff ects of nefopam in critically ill patients. Br. J. Anaesth. 2011; 106 (3): 336—43.
- Falzone E., Hoff mann C., Keita H. Posoperative analgesia in eldery patients. Drugs Aging. 2013; 30 (2): 81—90.
- Mimoz O., Chauvet S., Grégoire N., Marchand S., Le Guern M.E, Saleh A. Nefopam pharmacokinetics in patient with end-stade renal disease. Anesth. Analg. 2010; 111: 1146—53.
- Полушин Ю.С., Вартанова И.В., Беженарь В.Ф. и др. Оценка эффективности сочетанного применения нефопама гидрохлорида и кетопрофена в лечении послеоперационного болевого синдрома у больных эндометриозом. Журнал акушерства и женских болезней. 2012; 61 (6): 48—53.
- Пасечников С.П., Никитин О.Д., Малолетний Л.Н. Сравнительная оценка эффективности послеоперационного обезболивания морфином и акупаном в урологической практике. Медицина неотложных состояний. 2013; 1: 72—6.
- Тимербаев В.Х., Смирнова О.В., Генов П.Г. Проблема обезболивания женщин после операции экстирпации матки. Вестник анестезиологии и реаниматологии. 2013; 6: 061—071.
- Aveline C., Roux A.L., Hetet H.L. Gautier J. F. et al. Pain and recovery after total knee arthroplasty: a twelve moths follow-up after a prospective randomized study evaluating nefopam and ketamine for early rehabilitation. Clin. J. Pain. 2013; 4: 22—6.
- Еременко А.А., Сорокина Л.С., Павлов М.В. Комбинация кетопрофена и нефопама для обеспечения послеоперационного обезболивания с минимальным потреблением наркотических анальгетиков у кардиохирургических больных. Анестезиология и реаниматология. 2013; 5: 11—5.
- Evans M.S., Lysakowski C., Tramer M.R. Nefopam for the Prevent of Postoperative pain: Quanttative Systematic Review. Br. J. Anaesth. 2008; 101 (5): 610—7.
- Осипова Н.А., Петрова В.В., Донскова Ю.С., Хороненко В.Э. и др. Анестезиологическая защита пациента при обширных онкологических операциях. Медицинская технология. М.; 2010. 21 с.
ОНКОЛОГИЯ. ЖУРНАЛ им. П.А. ГЕРЦЕНА, 3, 2014

