Ершов А.Л.
Повреждение и замещение сурфактанта при респираторном дистресс-синдроме взрослых.
(обзор литературы)
Институт проблем хирургии, Сан Антонио, Техас. (e-mail: alershov@e-mail.ru)
Abstract. Yershov AL. Surfactant alteration and replacement in acute respiratory distress syndrome. Review.
Inactivation of pulmonary surfactant may be important in acute lung injury and acute respiratory distress syndrome. Mechanisms of surfactant alterations in ARDS include: 1) lack of surface-active compounds (phospholipids, apoproteins) due to reduced generation/release by diseased type II cells of alveoli or to increased loss of material (this feature includes changes in the relative composition of the surfactant phospholipid and/or apoprotein profiles); 2) inhibition of surfactant function by plasma protein leakage; 3) "incorporation" of surfactant phospholipids and apoproteins into polymerizing fibrin upon hyaline membrane formation; and 4) damage/inhibition of surfactant compounds by inflammatory mediators (proteases, oxidants, nonsurfactant lipids). Treatment of surfactant dysfunction by instilling exogenous surfactants may improve gas exchange and pulmonary mechanics. Surfactants used for treatment vary in their attributes and effects, so when various surfactants are considered for therapy, resistance to inactivation is an important consideration. In addition to the classical goals of replacement therapy defined for preterm infants (rapid improvement in lung compliance and gas exchange), this approach will have to consider its impact on host defense competence and inflammatory and proliferative processes when applied in adults with respiratory failure.
1. Краткие сведения о физиологическая роли сурфактанта в норме и при остром повреждении легких
Легочный1 сурфактант2 - смесь фосфолипидов, состоящая из 2-х фаз: нижней (гипофаза, жидкая), содержащей гликопротеиды и сглаживающей неровности эпителия; а также поверхностной фазы (опофаза) - мономолекулярной фосфолипидная пленки, обращенной гидрофобными участками в просвет альвеолы. Основные биологические свойства сурфактанта сводятся к снижению сил поверхностного натяжения в альвеолах (в почти в 10 раз); участию в антимикробной защите легких и формированию противоотечного барьера, за счет предотвращения «пропотевания» жидкости из легочных капилляров в просвет альвеолы.
1. Биологические структуры, схожие с сурфактантом легких, были обнаружены во внутреннем ухе (орган Корти), евстахиевой трубе и в почках. В настоящем обзоре речь идет о сурфактанте легких.
2. Слово «сурфактант» является аббревиатурой английской фразы «поверхностно активное вещество»
Повреждение сурфактанта, несомненно, является одним из ключевых звеньев в патогенезе острого повреждения легких (ОПЛ3) и его наиболее тяжелой формы -респираторного дистресс-синдрома взрослых (РДСВ4). В настоящем разделе обзора представлены общие данные по составу, метаболизму и функционированию системы сурфактанта в легких взрослых в норме и при данной патологии.
3. В англоязычной литературе: acute lung injury ( ALI )
4. В англоязычной литературе - острый легочный дистресс-синдром: acute respiratory distress syndrome , ( ARDS ). Слово “ distress ” в данном названии не имеет точного эквивалента в русском языке и может быть переведено, как “терпящий бедственние”, а также “болезненный, ненормальный”. Интересно, что в слэнговой речи это слово также иногда используется в значении “сдавливание, зажимание”.
Состав. Легочный сурфактант был выделен и описан J. A. Clements в 1957 году [14]. Эта легочная структура представляет собой секрет, вырабатываемый некоторыми клетками респираторного отдела легких. Его наиболее очевидной и изученной к настоящему времени функцией является снижение сил поверхностного натяжения, стремящихся уменьшить радиус альвеол.
У всех млекопитающих сурфактант обладает достаточно схожим составом, включая в себя приблизительно 90% липидов и 10% белков-апопротеинов, получивших название протеины сурфактанта (surfactant proteins, SP). В настоящее время выделяют SP-A, -B, -C, -D. Липидная фракция сурфактанта представлена преимущественно фосфолипидами: дипальмитоилфосфатидилхолином (ДПФХ) - 45%, фосфатидилхолином - 25%, фосфатидилглицеролом - 5%, остальные фосфолипидами - 5%, Также в состав фосфолипидной фракции входят фосфатидилинозит, фосфатидилэтаноламин, фосфатидилсерин (всего 5%). Другие липиды сурфактанта - холестерин, триглицериды, ненасыщенные жирные кислоты и сфигномиелин суммарно составляют около 10% [53]. По-видимому, наиболее существенную роль в уменьшении сил поверхностного натяжения играет ДПФХ [84]. Достаточно велика физиологическая ценность и белковых компонентов сурфактанта: SP-B и SP-С являются гидрофобными и вовлечены, главным образом, в процессы снижения поверхностного натяжения [89], в то время как SP-A и SP-D гидрофильны и их роль преимущественно сводится к участию в антиинфекционной защите легких [12, 13].
Метаболизм. Сурфактант синтезируется в альвеолоцитах II типа и клетками Клара [59, 40], где он может накапливаться в виде осмиофильных (следовательно, имеющие липидную природу) пластинчатых телец, а затем секретироваться в просвет альвеол путем экзоцитоза (см. рис 1). В ходе секреции изначальная, пространственно «скрученная» структура сурфактанта (имеющая название «пластинчатые тельца»), преобразуется путем «разворачивания» в тубулярный миелин и охватывает в виде монослоя липидов и протеинов внутреннюю поверхность альвеолы на границе сред воздух/жидкость. Синтезируются молекулы фосфатидилхолина преимущественно по цитидил-трифосфатному пути, этот процесс регулируется ферментами фосфорилхолинцитидилтрансфераза и холинфосфотрансфераза. SP гликозилируются5 в аппарате Гольджи, а затем соединяются с фосфолипидами. В ходе циклических изменений площади внутренней поверхности альвеол, связанных с дыхательными движениями, пленка сурфактанта постепенно разрушается и превращается в небольшие пузырьки (везикулы), которые либо захватываются альвеоцитами II типа для ресинтеза, либо полностью удаляются из респираторной зоны за счет фагоцитоза альвеолярными макрофагами [90, 92]. Синтез новых порций сурфактанта и утилизация везикул происходят достаточно быстро. Однако, если кровоток через какой-то участок легкого прекращается (например, в результате эмболии), то ранее синтезированный сурфактант подвергается быстрому разрушению, а продукция свежих порций приостанавливается [23, 63].
5. Гликозилирование белков основано на способности глюкозы, фруктозы и галактозы вступать в реакции гликозилирования с аминогруппами, входящими в структуру белков, липидов и нуклеиновых кислот.
При центрифугировании в плотных средах сурфактант может быть разделен на две фракции: так называемые «крупные агрегаты» (large aggregates of surfactant, LAs), состоящие из секретированных пластинчатых телец и тубулярного миелина, а также на фракцию с меньшей плотностью, названную «малыми агрегатами» сурфактанта (small aggregates of surfactant, SAs), представленную везикулярными образованиями. В то время, как крупные агрегаты (LAs) содержит SP и обладает ценными биофизическими свойствами в здоровых легких, малые агрегаты (SAs) содержит незначительное количество SP и в опытах проявляет слабо выраженную биологическую активность как in vivo, так и in vitro [8].
Данные экспериментальной работы Veldhuizen RA с соавт. [86] дают основание предполагать, что LAs претерпевают метаболическое превращение в SAs под влиянием циклических механических воздействий на пленку сурфактанта (типичный пример - воздействие давления дыхательной смеси, нагнетаемой в легкие во время ИВЛ), а также под влиянием некоторых протеаз, в частности фермента, названного конвертазой. Процесс конверсии LАs ![]() As, на фоне постоянного синтеза новых порций фракции LAs сурфактанта позволяет поддерживать в просвете альвеолы здоровых взрослых людей достаточно стабильное соотношение L A s/SAs.
As, на фоне постоянного синтеза новых порций фракции LAs сурфактанта позволяет поддерживать в просвете альвеолы здоровых взрослых людей достаточно стабильное соотношение L A s/SAs.
При патологических процессах в легких в респираторных зонах могут появляться другие ферменты (отличающиеся от конвертазы), также способные инициировать превращение LАs![]() SAs. В первую очередь к этой группе энзимов следует отнести эластазу нейтрофилов. В результате патологической активизации ферментативных процессов в просвете альвеолы возможно быстрое нарастание фракции биологически пассивной SAs и истощение наиболее биологически ценной фракции сурфактанта – LАs [49].
SAs. В первую очередь к этой группе энзимов следует отнести эластазу нейтрофилов. В результате патологической активизации ферментативных процессов в просвете альвеолы возможно быстрое нарастание фракции биологически пассивной SAs и истощение наиболее биологически ценной фракции сурфактанта – LАs [49].
Функция. Как указывалось выше, основная функция сурфактанта – снижение сил поверхностного натяжения на внутренней стенке альвеолы в зоне взаимодействия сред воздух/жидкость.
Поверхностным натяжением называется сила, измеряемая обычно в динах, действующая в поперечном направлении на воображаемый отрезок длиной 1 см на поверхности жидкости. Эта сила обусловлена тем, что межмолекулярное сцепление внутри жидкости гораздо сильнее, чем на границе ее раздела с газом. Поэтому всегда имеет место однонаправленный процесс к максимальному уменьшению поверхности жидкости. Хорошим примером этого явления служит образование мыльных пузырей. Их стенки стремятся максимально сократиться, и в результате образуется сферическая поверхность, площадь которой при данном объеме минимальна. Внутри такого пузыря действует давление, равное по закону Лапласа ![]() P = 4
P = 4![]() /r, где
/r, где ![]() – величина поверхностного натяжения на разделе воздух/жидкость; r – радиус пузыря. В выстланных жидкостью альвеолах в создании давления участвует только одна поверхность, а не две, как в мыльном пузыре, поэтому в числителе данного уравнения следует ставить не 4, а 2. В этом случае
– величина поверхностного натяжения на разделе воздух/жидкость; r – радиус пузыря. В выстланных жидкостью альвеолах в создании давления участвует только одна поверхность, а не две, как в мыльном пузыре, поэтому в числителе данного уравнения следует ставить не 4, а 2. В этом случае ![]() Р представляет собой градиент сил, действие которых направлено на уменьшение диаметра альвеолы и, в конечном счете, на её коллабирование.
Р представляет собой градиент сил, действие которых направлено на уменьшение диаметра альвеолы и, в конечном счете, на её коллабирование.
При отсутствии механизмов противодействия силам поверхностного натяжения, величина ![]() P будет нарастать параллельно уменьшению радиуса альвеолы, что при некоторых вариантах легочной патологии приводит к ателектазированию респираторных зон.
P будет нарастать параллельно уменьшению радиуса альвеолы, что при некоторых вариантах легочной патологии приводит к ателектазированию респираторных зон.
Механизм воздействия сурфактанта на поверхностное натяжение заключается в следующем. Образование тонкого слоя сурфактанта на жидкости, покрывающей наружную поверхность альвеолярного эпителия, определяется неоднородными физико-химическими свойствами молекул ДПХФ, обладающих как гидрофобными, так и гидрофильными окончаниями. Действующие между ними силы молекулярного отталкивания противодействуют силам притяжения между молекулами воды, обуславливающими поверхностное натяжение. Его уменьшение при снижении площади поверхности объясняется более плотным примыканием друг к другу молекул ДПФХ, за счет чего сила взаимного отталкивания между молекулами становится больше.
Коллабированию альвеол могут сопутствовать или предшествовать явления легочного отека, обусловленного как повышением гидростатического давления, действующего перпендикулярно альвеолярно-капиллярному барьеру, так и повышением порозности альвеолярно-капиллярной стенки [54].
Сурфактант начинает синтезироваться у плода человека в достаточных количествах на 27-29 неделе внутриутробного развития. При рождении недоношенного ребенка на более ранних сроках беременности отсутствие сурфактанта приводит к резкому возрастанию сил поверхностного натяжения в альвеолах, что значительно повышает энерготраты во время дыхания и способствует быстрой утомляемости дыхательной мускулатуры. В этой ситуации обычно возникает необходимость в проведении ИВЛ, однако, её применение в ряде случаев может вызвать дальнейшее ухудшение ситуации за счет вентилятор-индуцированной травмы легких. В указанной ситуации применение экзогенного сурфактанта является патогенетически оправданным методом лечения и способно повысить эффективность ИВЛ, а также уровень выживаемости среди недоношенных новорожденных.
Применение препаратов экзогенного сурфактанта рассматривается в качестве одного из наиболее важных компонентов в терапии респираторного дистресс-синдрома у недоношенных новорожденных [62, 70, 49, 51, 52]. У взрослых больных, при развитии РДСВ, характерен не столько дефицит продукции сурфактанта, сколько его повреждение, что закономерно приводит к нестабильности геометрии альвеол и тенденции к их ателектазированию. Указанное состояние также требует в большинстве случаев проведения ИВЛ. Однако, в отличие от ситуации с недоношенными детьми, назначение экзогенного сурфактанта в данной группе больных эффективно далеко не во всех ситуациях из-за существенно большей сложности патогенетических механизмов, вовлеченных в развитие РДСВ. Интересно, что относительное количество сурфактанта в легких взрослого здорового человека составляет всего 5-15 mg / kg массы тела и эта величина у ниже, чем у здоровых новорожденных детей [58 ] .
В последние годы привлекает внимание роль сурфактанта в системе антимикробной защиты легких. SP-A и SP-D принадлежат семейству коллектинов, которые обладают способностью связываться с поверхностью микробной стенки и, тем самым, облегчать процесс опсонизации и последующего фагоцитоза патогенов [94, 60, 15] . Экспериментальное подтверждение роли сурфактанта в антимикробной защите легких было получено в исследованиях на трансгенных животных, не имеющих в структуре сурфактанта SP-A и SP-D. В проведенных опытах эти животные проявили достоверно более высокую восприимчивость к бактериальной и вирусной легочной инфекции по сравнению с обычными животными [46, 47, 48].
При нормальном функционировании мукоцилиарного клиренса сурфактант также способствует удалению инородных микрочастичек, попавших со вдыхаемым воздухом в просвет альвеолы [70, 18].
Изменения в системе сурфактанта при повреждении легких
Уже в первом описании клиники РДСВ, выполненном Ashbaugh DG с соавт. [2] , предполагалась, что повреждение сурфактанта играет важную роль в патогенезе развития данного синдрома. В дальнейшем эта гипотеза была многократно подтверждена [45 , 3, 32 ].
Анализ бронхоальвеолярной лаважной жидкости (БАЛЖ), полученной у больных РДСВ, а также в экспериментальных моделях, всегда выявляет наличие выраженных изменений в системе эндогенного сурфактанта [21, 95, 86]. В частности, описано снижение уровня ДПФХ, фосфатидилглицерола, сурфактант-ассоциированных протеинов [54]; установлено изменение пропорций между вариантами агрегатов сурфактанта: снижение функционально активной (LA) и повышение неактивной (SA) фракции [66].
При РДСВ изменяются и физиологические свойства сурфактанта: он теряет эластические свойства, быстрее разрушается в ходе циклических растяжений в процессе дыхания и в меньшей степени воздействует на силы поверхностного натяжения внутри альвеолы [62]. В самое последнее время были опубликованы данные, свидетельствующие о высокой предрасположенности к развитию РДСВ у лиц, имеющих структурные, генетически детерминированные, изменения в SP-В [ 25, 56 ]. Интересно, что эта генетическая предрасположенность к РДСВ в большей мере свойственна женщинам [25 ]. Возможно, эти данные объясняют известный факт, что АRDS развивается лишь у сравнительно небольшой части больных, имеющих один или даже сочетание нескольких факторов риска возникновения этой тяжелой патологии.
Механизмы возникновения дефектов в системе сурфактанта при РДСВ связаны как с нарушением синтеза (и/или секреции) этого соединения внутри альвеоцитов II типа, так и с ускорением деградации липидов и протеинов в просвете альвеолы [32]. Возможно, что обнаружение компонентов сурфактанта (в частности – SP) в плазме крови некоторых больных РДСВ может быть связано с повышенной порозностью альвеоляро-капиллярного барьера и поступлением этих соединений в системный кровоток [20]. Этот пока недостаточно изученный процесс «вымывания» сурфактанта из альвеол в капиллярное русло может потенцироваться под влиянием нерациональных режимов ИВЛ, ведущих к повреждению легких (lung-injury mechanical ventilation), т.е. в результате развития вентилятор-индуцированной травмы легких [38, 39]. Cравнительно недавно было предложено использовать определение концентрации SP-D в плазме в качестве прогностического критерия у лиц с ОПЛ/РДСВ [21, 11]. Следует заметить, что SP , особенно SP - A , SP - B и SP - D в организме человека продуцируются только альвеолоцитами и у здоровых людей за пределами легких в физиологических условиях не определяются. Их появление в крови может использоваться как маркер повреждения легочной ткани при достаточно разнообразной патологии нижних дыхательных путей [32].
При экссудативной стадии РДСВ, выражающейся в поступлении в просвет альвеол значительного количества протеинов плазмы, возникают новые механизмы повреждения сурфактанта. В этом случае отмечается своеобразное ингибирование плазменными белками еще сохранившихся фрагментов сурфактанта (LAs) за счет их конкурентного вытеснения из зоны раздела сред воздух/жидкость на внутренней поверхности стенки альвеолы [28]. Наряду с другими механизмами, процесс инактивации сурфактанта белками крови задействован и при тромбоэмболии ветвей легочной артерии. Развивающаяся в этих случаях порозность алевеолярно-капиллярного барьера приводит к «пропотеванию» протеинов плазмы в просвет альвеолы, нейтрализации сурфактантной пленки и появлению ателектазов [63, 64]. В этой же связи представляют интерес данные Strayer DS с соавт. [ 77 ], выявившими в экспериментальной работе защитные свойства SP - A по отношению к ингибирующим воздействиям фибриногена крови на сурфактант.
Экспериментальные исследования как in vivo , так и in vitro показывают, что назначение при экссудативной стадии РДСВ высоких доз экзогенного сурфактанта в ряде случаев может привести к положительному клиническому эффекту за счет обратного процесса в альвеолах и восстановления физиологического слоя L A s на стенках альвеолы [43].
2. Терапия препаратами экзогенного сурфактанта при остром повреждении легких
и респираторном дистресс-синдроме взрослых.
За последние два десятилетия опубликовано большое количество весьма противоречивых данных по эффективности применения экзогенного сурфактанта у больных ОПЛ и РДСВ [74, 75, 29, 30, 36]. Большей частью это описания отдельных наблюдений или исследования в небольших группах больных и экспериментальных моделях [70, 30]. До настоящего момента было проведено явно недостаточное число контролируемых рандомизированных клинических исследований эффективности экзогенного сурфактанта при РДСВ, отвечающих современным стандартам [1, 27, 74, 49, 50].
В одном из таких немногих исследований [1] синтетический сурфактант “Exosurf” (GlaxoSmithkline, США; 13,5 мг/мл ДПФХ) вводился больным в виде аэрозоля в дозе 112 мг/кг/день на протяжение 5 дней. Исследование было проведено на 725 пациентах с РДСВ на фоне сепсиса. В ходе применения влияния “Exosurf” статистически значимого уменьшения количество дней, проведенных без ИВЛ в течение первых 28 суток заболевания, и снижения уровня летальности выявить не удалось. Процент умерших больных оказался равным в исследуемой и контрольной группах (по 41%).
Другое исследование, с меньшим числом больных, было проведено в 1997 Gregory TJ с соавт. [ 27 ]. В этом случае использовался модифицированный натуральный бычий сурфактант “Survanta” (25 mg/ml), который инсталлировался непосредственно в дыхательные пути больных по различным схемам: 1) 8 доз по 50 мг/кг; 2) 4 дозы по 100 мг/кг и 3) 8 доз по 100 мг/кг в течение 28 суток. Вторая группа больных имела наилучшие результаты, уровень летальности в ней оказался 18,8% (для сравнения, - в контрольной группе, не получавшей экзогенного сурфактанта, этот показатель составил 43,8%).
Еще одно достаточно крупное исследование было связано с клиническим испытанием рекомбинантного сурфактанта “Venticute” (Byk Pharmaceuticals, Германия). Предварительная апробация препарата на небольшой группе пациентов с РДСВ продемонстрировала вполне обнадеживающие результаты [75]. В связи с этим, в 2001 году был проведен расширенный этап клинических испытаний “Venticute” [74]. Исследование проводилось параллельно в США, Европе и в Южной Африке. Доза препарата составила 200 мг/кг в расчете на фосфолипиды. В отчетах всех стран-участниц международного эксперимента в результате применения “Venticute” было отмечено статистически значимое улучшение оксигенации, однако достоверных изменений в уровне летальности и сроках пребывания больных на ИВЛ получить не удалось. Однако, при последующем обобщающем анализе всего собранного материала, полученного в ходе лечения и наблюдения 448 пациентов, было установлено, что пациенты со вторичным вариантом РДСВ, т.е. возникшем на фоне предшествующего бактериального или химического поражения легких (пневмония, аспирация), после проведения лечения “Venticute” имели статистически значимое снижение уровня летальности. Одновременно это достаточно широкое и хорошо контролируемое исследование показало клиническую приемлемость метода терапии экзогенным сурфактантом, а также отсутствие серьезных осложнений в ходе использования “Venticute” для больных РДСВ. Последнее обстоятельство подтвердило данные о безопасности экзогенного сурфактанта для больных РДСВ, полученные ранее в других исследованиях [91].
Можно предполагать, что результаты проведенной работы выглядели несколько обескураживающими для производителей “Venticute” и организаторов международного исследования. Однако, отсутствие убедительного снижения летальности и сроков пребывания больных на ИВЛ вовсе не следует однозначно трактовать как проявление полной неэффективности препаратов экзогенного сурфактанта. Скорее эти результаты указывают на необходимость более глубокого изучения всех сложных механизмов, вовлеченных в патогенез РДСВ, а также на недостаточный учет в ходе эксперимента различных внешних и внутренних факторов, влияющих на эффективность терапии сурфактантом. То есть, требуется более рациональный и индивидуальный подход к применению препаратов данной группы [49].
Понимание необходимости оптимизировать назначение коммерческих препаратов сурфактанта при РДСВ закономерно привело к поиску обстоятельств, повышающих или снижающих эффективность данного вида терапии. В настоящее время среди этих разнообразных факторов наиболее значимыми представляются:
- Патогенетический вариант и степень тяжести РДСВ;
- Качественный и количественный состав ингредиентов в препарате экзогенного сурфактанта;
- Объем, частота и метод введения препарата; режим проведения ИВЛ в момент введения сурфактанта и в ближайший последующий период;
- Выбор оптимального времени для начала и завершения заместительной терапии.
Патогенетические особенности развития РДСВ
Под собирательным понятием «РДСВ» в настоящее время объединены схожие клинические проявления, возникающие при очень неоднородных по этиопатогенезу заболеваниях и патологических состояниях. Вот только беглое и далеко неполное перечисление причин, способных привести к возникновению РДСВ [19, 67, 82, 57]:
- Диффузные легочные инфекции (вирусные, бактериальные, микотические, пневмоцистные).
- Аспирация содержимого желудка при синдроме Мендельсона, воды - при утоплении.
- Вдыхание токсинов и раздражающих веществ (хлор, NO 2 , некоторые виды дыма, озон, высокие концентрации О 2 ).
- Отек легких, обусловленный передозировкой наркотических средств (героин, метадон, морфин, декстропропоксифен).
- Побочный эффект некоторых ненаркотических лекарственных средств (нитрофурантоин).
- Иммунологический ответ на различные антигены (синдром Гудпасчера, системная красная волчанка).
- Любая травма, в том числе – ожоговая, сопровождающаяся гипотензией.
- Системные реакции организма на внелегочные процессы (септицемия, вызванная грам-отрицательной микрофлорой; геморрагический панкреатит, эмболия амниотической жидкостью, жировая эмболия).
- Посткардиопульмональное обходное шунтирование («легкое-насос», «постперфузионное легкое») и т.д.
Pelosi P. с соавт. в недавно опубликованном обзоре [67], а также в своей более ранней работе [22] подчеркивает целесообразность выделения как минимум двух вариантов РДСВ: 1) возникающего вследствие прямого повреждения легких (pulmonary ARDS, ARDSp) и 2) представляющего собой вторичный процесс как следствие тяжелого внелегочного патологического состояния ( extrapulmonary ARDS, ARDSexp). В упомянутом обзоре обоснована правомерность такого подхода на примере объективно существующих различий, касающихся патофизиологии развития этих двух форм ARDS, путей биохимической и иммунной активации патологических процессов в легких; отличий морфологических, гистологических и рентгенологических данных, полученных в этих подгруппах больных, а также отмечена целесообразность дифференцировать подходы к выбору режимов ИВЛ, защищающих легкие и индивидуализировать проведение лекарственной терапии.
Схожий подход к выделению двух вариантов РДСВ содержится и в работе корейских исследователей [55]. Так, например, они установили, что показатель PaO2/FIO2 при проведении ИВЛ в положении лежа на животе у больных ARDSexp улучшался на 63% за 30 минут, в то время как у больных ARDSp этот показатель вырос лишь на 23% и на это ушло 2 часа.
С учетом впечатляющего разнообразия причин, вызывающих РДСВ и вариабельности ответа в разных подгруппах пациентов на проводимое лечение (даже на положение туловища больного при ИВЛ), сложно рассчитывать на однородные результаты при унифицированном, недифференцированном подходе к назначению экзогенного сурфактанта. Подтверждением этому может служить сообщение Seeger W. с соавт. [72 ] о достоверно меньшей летальности при применении экзогенного сурфактанта больным с первично-легочной формой РДСВ ( ARDSp ).
Следует отметить, что стремление к выделению патофизиологических вариантов РДСВ появилось сравнительно недавно и поддерживается не всеми специалистами, работающими в данной области. Весьма критичное отношение к такому подходу изложено в работе Callister M.E. и Evans T.W. [10], которые считают, что выделение различных форм РДСВ требует более взвешенного подхода и должно опираться, в числе прочих показателей, на различия в уровне летальности в подгруппах больных.
Особенности качественного состава экзогенного сурфактанта
Характеристика некоторых коммерческих препаратов сурфактанта, производимых в настоящее время представлена в таблице 1. Обобщение опубликованных данных, по использованию различных вариантов экзогенного сурфактанта при РДСВ, позволяет сделать следующие выводы: более высоким терапевтическим эффектом обладают протеин-содержащие лекарственные формы [79, 73], а внутри этой группы препаратов – изготовленные на основе БАЛЖ [49]. Так, например, применение препарата “bLES” (Канада), исходным сырьем для которого служит БАЛЖ крупного рогатого скота, в экспериментальной модели приводило к более значимому улучшению газообмена, по сравнению с препаратом “Survanta” (США), изготовленным из легочной ткани крупного рогатого скота [50] Следует отметить, что эти два препарата существенно отличаются по содержанию липидов (см табл. 1). Это обстоятельство, по-видимому, также может сказываться на эффективности их применения.
Кроме различий в содержании липидов, терапевтическую эффективность экзогенного сурфактанта может определять концентрация SP, особенно – SP-B и SP-C. Сравнительно недавно проведенные эксперименты на животных показали вполне сопоставимую терапевтическую эффективность при РДСВ экзогенного сурфактанта “Venticute” (Германия), содержащий рекомбинантный SP-C в сочетание c ДПФХ и другими липидами, и “bLES”, основанного на липидной вытяжке из натурального сурфактанта крупного рогатого скота [31].
Возможно, синтетические биологически-активные компоненты заменителей сурфактанта исчезают из просвета альвеол раньше, чем их натуральные аналогии. В работе Beresford M.W. и Shaw N.J. [5] было показано, что уровень SP - B в БАЛЖ , выполненной на следующий день после введения двух различных форм экзогенного сурфактанта, был достоверно ниже в группе, где использовался препарат из синтетического сырья, по сравнению с группой, получившей экзогенный сурфактант из натурального сырья.
В тоже время при применении препаратов экзогенного сурфактанта, изготовленных на основе биологического сырья, необходимо учитывать теоретическую возможность переноса патогенных микроорганизмов, что практически исключено при использовании синтетических заменителей сурфактанта. По-видимому, вероятность заражения препаратами экзогенного сурфактанта весьма незначительная, описания подобных случаев в доступной литературе не нашлось. Основной технологической проблемой получения препаратов экзогенного сурфактанта животного происхождения является определенный дефицит сырья, однако появление синтетических аналогов с хорошими терапевтическими свойствами позволяет обойти это препятствие.
Способы введение сурфактанта и его дозировка
Различные методики применения сурфактанта преследуют общую цель – доставить адекватную дозу препарата в альвеолы без сопутствующего существенного угнетения дыхательной функции легких и ухудшения общего состояния больного. В настоящее время в клинической практике и в экспериментальных моделях используются следующие основные способы назначения сурфактанта:
- Инсталляция жидкой формы препарата болюсом или капельно через эндотрахеальную трубку;
- Введение препарата через бронхоскоп. В этом случае может назначение сурфактанта может сочетаться с сегментарным бронхоальвеолярным лаважем, при котором вводимый препарат используется в качестве промывной жидкости или вводится в сравнительно больших объемах сразу после обычного лаважа [24];
- Аэрозольное применение сурфактанта.
Каждый из представленных способов имеет свои преимущества и недостатки, однако, медленное (капельное) введение препарата через катетер, установленный в эндотрахеальной трубке по мнению одного из крупнейших специалистов в этой области Lewis JF [49] является методом выбора для больных с достаточно тяжелыми вариантами РДСВ. Эта рекомендация обосновывается легкостью применения указанного способа и возможностью ввести значительные объемы сурфактанта за сравнительно небольшой период времени. В качестве альтернативы капельному введению сурфактанта у больных с умеренно выраженными формами ОПЛ и РДСВ может быть рекомендовано назначение аэрозольных форм препарата [51] . Недавно в Японии было проведено экспериментальное исследование [16], оценивавшее возможность пролонгировать действие аэрозоля экзогенного сурфактанта за счет последующего (через 15 минут) назначения аэрозоля декстрана. На экспериментальной модели РДСВ авторам работы удалось показать, что ингалированный декстран в просвете альвеол способен предотвращать ингибирование белками плазмы экзогенного сурфактанта и приводит к достоверному продлению его клинического эффекта.
Терапевтическая и экономическая эффективность различных способов применения коммерческих форм сурфактанта в настоящее время находится в стадии изучения.
Влияние проводимой ИВЛ. Многочисленные экспериментальные и клинические исследования, проведенные в последнее десятилетие указывают на достаточно сложное взаимодействии различных режимов ИВЛ и экзогенного легочного сурфактанта [88, 39, 41, 42, 87]. Значительная часть экспериментальных работ свидетельствует о том, что назначение экзогенного сурфактанта на фоне проведения «защитной» стратегии ИВЛ приводит не только к более заметному улучшению газообменной функции поврежденных легких, но и сопровождается выраженными изменениями в метаболизме легких и показателях легочной механики [35]. Так, например, на экспериментальной модели РДСВ было установлено, что во время прессоциклической ИВЛ с высоким пиковым давлением вдоха (PIP) введение экзогенного сурфактанта “bLES” (100 mg/kg) способно существенно повышать уровень TNF-a и IL-d в перфузате, оттекающем от легких; однако этот эффект не был связан с активацией альвеолярных макрофагов, а скорее определялся раскрытием ранее ателектазированных альвеол и перерастяжением альвеоцитов. Комментируя это сообщение можно заключить, что авторы описывают достаточно хорошо известную ателектотравму легких. Тем не менее, несмотря на подъем концентрации провоспалительных цитокинов, в ходе использования “bLES” были отмечены улучшение легочного комплайнса и повышение дыхательного объема [76].
Интересно, что применение препарата « Alveofact» (препарат, близкий к « Survanta») в дозе 60 mg/kg у двухлетней девочки, с РДСВ на фоне инфекционной внелегочной патологии, оказало на концентрацию цитокинов прямо противоположный эффект: артериовенозная разница по TNF-a и IL-d у ребенка снизилась за счет артериального компонента. Этот эффект авторы наблюдения [80] связали с ингибирующим влиянием экзогенного сурфактанта на активацию полиморфно-ядерных нейтрофилов в сосудистом русле легких. Представленные в этой работе данные хорошо согласуются с рекомендациями Vazquez de Anda GF с соавт. [83] по использованию экзогенного сурфактанта для лечения вентилято-ассоциированной травмы легких в целях снижения концентрации провоспалительных цитокинов.
К сожалению, работы, посвященные исследованию влияния тех или иных режимов ИВЛ на структуру, метаболизм и клиническую эффективность экзогенного сурфактанта при РДСВ, фрагментарны и крайне немногочисленны [53, 39 ] . Так, например, было обнаружено, что начало проведения ИВЛ у больных РДСВ может приводить к изменению в соотношении SP в БАЛЖ. Уже через одни сутки ИВЛ заметно вырастает уровень SP - A , а к концу вторых суток вентиляции концентрация этого соединения становится достоверно выше исходного уровня [3]. Близкие результаты в отношении изменений уровня SP - A на ранних стадиях РДСВ приведены в работе Zhu BL с соавт. [95] Интересно, что при сочетании РДСВ с легочной инфекцией указанных сдвигов в концентрации SP - A не отмечалось [3].
По-видимому, по аналогии с эндогенным сурфактантом, при проведении «повреждающих» режимов ИВЛ большая часть экзогенного сурфактанта достаточно быстро теряет свои свойства за счет конверсии LAs![]() Sas или благодаря другим механизмам. В тоже время «защищающие» методы ИВЛ могут способствуют более длительному сохранению препарата в просвете альвеол и восстановлению физиологического баланса Las/SAs [49]
Sas или благодаря другим механизмам. В тоже время «защищающие» методы ИВЛ могут способствуют более длительному сохранению препарата в просвете альвеол и восстановлению физиологического баланса Las/SAs [49]
Выбор времени начала терапии экзогенным сурфактантом больных РДСВ
К настоящему времени стало вполне очевидным, что в тех случаях, когда РДСВ является составной частью тяжелой полиорганной патологии, назначение препаратов указанной группы малоэффективно [49].
К сожалению, в доступной литературе отсутствует информация по целесообразности профилактического назначения экзогенного сурфактанта у больных с высоким риском развития РДСВ. Экспериментальные и клинические данные по выбору оптимальных сроков начала терапии экзогенным сурфактантом немногочисленны и сводятся к рекомендациям по возможно более раннему применению препаратов, уже на начальных стадиях развития РДСВ [68, 44, 39]. Также было показано, что на более поздних стадиях развития РДСВ при назначении экзогенного сурфактанта более целесообразно использовать бронхоскопический путь введения препарата с предшествующим проведением бронхоальвеолярного лаважа [24].
3. Перспективные направления в изучении терапевтической роли
препаратов экзогенного сурфактанта при патологии легких.
Несмотря на сравнительно скромные результаты, полученные в ходе проведения рандомизированных исследований по использованию экзогенного сурфактанта у больных с РДСВ, препараты этой группы продолжают оставаться весьма перспективными для клинического применения. Представляется, что повышение терапевтической эффективности уже созданных препаратов сурфактанта будет лежать через индивидуализацию дозы и оптимизацию сроков начала терапии.
Вероятно, в перспективе заслуживает более подробного изучения целесообразность профилактического применения препаратов данной группы у лиц с высоким риском развития РДСВ.
Обладая достаточно выраженными антимикробными и иммуномодулирующими свойствами, препараты экзогенного сурфактанта потенциально могут оказаться весьма эффективными в процессе лечения и профилактики многих форм инфекционной патологии легких, в том числе при одном из наиболее частых осложнений длительной ИВЛ – вентилятор-ассоциированной пневмонии ( VAP ). В качестве доказательства обоснованности такого предположения можно привести недавнее сообщение Nakos G . с соавт. [64] о выявлении грубых нарушений в системе эндогенного сурфактанта при VAP , причем механизмы возникновения и клинико-лабораторные проявления этих дефектов оказались весьма близкими к РДСВ (появление в альвеолярной зоне больших количеств нейтрофилов с последующим разрушением за счет нейтрофильной эластазы пленки сурфактанта; вытеснение легочного сурфактанта плазменными белками; уменьшение доли биологически-активной фракции LAs и т.д.). Важно, что структурные и функциональные нарушения эндогенного сурфактанта при VAP могут сохраняться достаточно долго, даже после исчезновения признаков легочной патологии. Самый первый опыт использования при VAP аэрозоля экзогенного сурфактанта Exosurf показал, что у пациентов через 4 дня лечения достоверно снизилось количество нейтрофилов в БАЛЖ [4]. Разумеется, как и в случае с РДСВ, требуются дополнительные исследования по проверке эффективности препаратов сурфактанта при VAP , а также разработка схем по их дифференцированному использованию на различных стадиях заболевания.
Заслуживает внимания сочетанное применение экзогенного сурфактанта и других лекарственных средств, в частности – антибиотиков, при лечении пневмонии. Пока немногочисленные данные позволяют предположить, что такая комбинация у больных с пневмонией, нуждающихся в ИВЛ, снижает риск возникновения некоторых побочных эффектов при введении антибиотиков через дыхательные пути. Кроме того, это сочетание позволяет более эффективно «доставлять» антибактериальные препараты к коллабированным альвеолам в зоне активного воспалительного процесса [34]. По-видимому, этот эффект достигается за счет облегчения процессов рекрутирования ателектазированных альвеол под влиянием экзогенного сурфактанта и последующего вовлечения ранее коллабированных участков легких в дыхательный цикл.
К повреждению сурфактанта приводит длительная ИВЛ даже при отсутствии клинически выраженной патологии легких. По данным Tsangaris I . с соавт. [81 ] у лиц, нуждающихся в ИВЛ по причинам, не связанным с патологией легких, через 2 недели от начала вентиляции отмечалось выраженное снижение LAs и появлялись другие признаки повреждения сурфактанта (сравнение производилось с результатами анализа БАЛЖ, полученной в первые сутки ИВЛ). Эти данные, заслуживает рассмотрения с точки зрения целесообразности профилактического назначения препаратов экзогенного сурфактанта у лиц, нуждающихся в длительной ИВЛ. Возможно, это окажется одним из подходов к снижению риска наступления позднего варианта VAP .
Подводя итог, следует сказать, что, несмотря на достаточно длительный срок промышленного производства, терапевтический потенциал препаратов экзогенного сурфактанта использован еще далеко не полностью. Можно прогнозировать, что с учетом высокой уязвимости эндогенного сурфактанта как при первичных процессах внутри легких, так и при вторичных повреждениях на фоне ведущей патологии других органов, интерес к этому методу лечения будет закономерно возрастать. Немаловажное обстоятельство – высокая распространенность (и, соответственно, социальная значимость) синдрома ОПЛ, при котором терапевтическое применение экзогенного сурфактанта продолжает считаться одним из наиболее перспективных направлений. По последним данным в США частота возникновения ОПЛ составляет 64,2 случая на 100 тыс населения (что, к слову, не отличается от данных по развивающимся странам), а уровень летальности составляет 40% [32, 26].
Повышению эффективности лечения с использованием препаратов сурфактанта будет способствовать дальнейшее накопление знаний о его биологической роли и совершенствование подходов к клиническому применению.
Таблица 1
Названия, состав и фирмы-производители некоторых коммерческих форм сурфактанта, допущенных для применения в ходе лечения ARDS (цитируется с дополнениями по Lewis JF, 2003).
| Название | Исходное сырьё | Состав | Производитель |
| Протеин-содержащие формы | |||
| Alveofact | Лаважная жидкость крупного рогатого скота | 99% PL, 1% SP-B и SP-C | Boehringer Ingelheim, Ingelheim, Германия |
| B LES* | Лаважная жидкость к рупного рогатого скота | 75% фосфатидилхолин и 1% SP - B и SP - C | BLES Biochemicals, London,Ontario, Канада |
| Curosurf | Легчная ткань свиней | ДПФХ, SP - B и SP - C (концентрация - ?) |
Chiesi Farmaceutici, Parma, Италия |
| CLSE** | Легчная ткань свиней | См . “Infasurf” | |
| HL-10 | Легчная ткань свиней | ? | Leo Pharma, Copenhagen, Дания |
| Infasurf | Лаважная жидкость телят | ДПФХ, трипалмитин, SP ( B 290 г/мл, C 360 g / ml ) |
Forest Laboratories, New York, NY, США |
| Surfaxin | Синтетический продукт | ДПФХ, синтетические пептиды | Discovery Laboratories, Doylestown, PA, США |
| Survanta | Легочная ткань крупного рогатого скота | ДПФХ, трипалмитин SP ( B <0.5%, C =99%) | Abbott Laboratories, Abbott Park, IL, США |
| Surfactant TA | Легочная ткань крупного рогатого скота | ДПФХ, трипалмитин, SP ( B <0.5%, C =99%) | Tokyo-Tanabe Co. Ltd., Tokyo, Япония |
| Venticute | Синтетический продукт | ? | Byk Pharmaceuticals, Constance, Германия |
| Формы, не содержащие протеина в своем составе | |||
| ALEC*** | Синтетический продукт | 70% ДПФХ, 30% фосфатидилглицерол | Britannia Pharmaceuticals Limited , Redhill , Великобритания |
| Exosurf | Синтетический продукт | 85% ДПФХ, 9% гексадеканол, 6% тилоксапол |
GlaxoSmithkline, Research triangle Park, NC, США |
* bLES – “Bovine Lipid Extract Surfactant”
** CLSE - “Calf lung surfactant extract”
** * ALEC – “Artificial Lung-Expanding Compound”
Рисунок 1.
Микрофотографии альвеолоцитов II типа и вариантов внутриальвеолярного сурфактанта у крысы в здоровых легких (a, b) и при эксприментальном отеке легких (с-f).
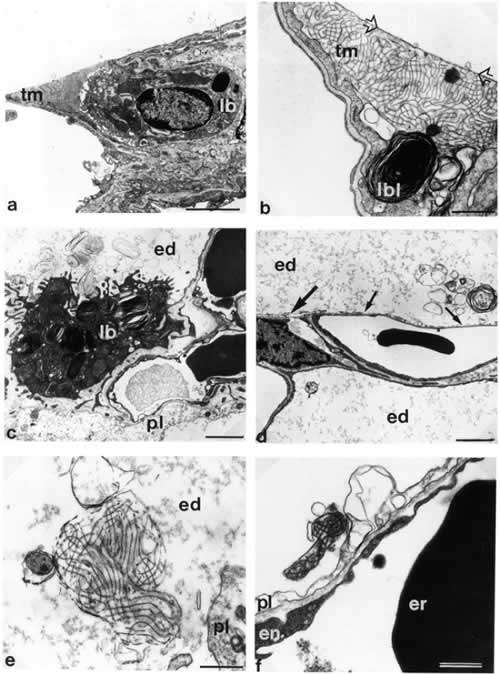
а) Нормальная ультраструктура альвеолоцита II типа. Обозначены: внутриклеточный сурфактант, храняшийся в ламеллярных тельцах (lb), внутриклеточный миелин (tm). Шкала в правом нижнем углу = 2 µm.
b) Тубулярный миелин (tm) плотно контактирует с клеточной мембраной, примыкающей как к базальной мембране (стрелки), так и граничащей с просветом альвеолы. lbl – ламеллярные тельца. Шкала = 0,5 µm.
c) Фокальный внутриальвеолярный отек. Набухание альвеолоцитов I типа (pI). Альвеолоцит II типа с незначительным набуханием митохондрии и ламеллярными тельцами обычных размеров (lb). Различные формы сурфактанта в просвете альвеолы (в отечной жидкости): напоминающие ламеллярные тельца, мультламеллрные, униламиллярные. Шкала = 2 µm.
d) Альвеолярная стенка с частичным набуханием (толстая стрелка) и фрагментацией (тонкая стрелка) альвеолоцита I типа. Просвет альвеолы заполнен отечной жидкостью (ed). Мультиламеллрные и униламеллярные формы сурфактанта. Шкала = 2 µm.
e) Тубулярный миелин в просвете альвеолы (в отечной жидкости), признаки его дезинтеграции. pI = набухание альвеолоцита I типа. Шкала = 0,5 µm.
f ) Дезинтеграция тубулярного миелна в той же модели, но зонах легких без внешних признаков отека: pI = набухание альвеолоцита I типа; en = эндотелий капилляра; er = эритроцит. Шкала = 0,5 µm.
(Цитируется с разрешения автора по Ochs M et al. Am. J. Respir. Crit. Care Med. 1999 160(2): 718-24)
Список литературы.
- Anzueto A , Baughman RP , Guntupalli KK , Weg JG , Wiedemann HP , Raventos AA , Lemaire F , Long W , Zaccardelli DS , Pattishall EN . Aerosolized surfactant in adults with sepsis-induced acute respiratory distress syndrome. Exosurf Acute Respiratory Distress Syndrome Sepsis Study Group. N Engl J Med. 1996 May 30; 334(22):1417-21.
- Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet. 1967 Aug 12;2(7511):319-23.
- Balamugesh T, Kaur S, Majumdar S, Behera D. Surfactant protein-A levels in patients with acute respiratory distress syndrome. Indian J Med Res. 2003 Mar;117:129-33.
- Baughman RP, Henderson RF, Whitsett J, Gunther KL, Keeton DA, Waide JJ, Zaccardelli DS, Pattishall EN, Rashkin MC. Surfactant replacement for ventilator-associated pneumonia: a preliminary report. Respiration. 2002;69(1):57-62.
- Beresford MW, Shaw NJ. Bronchoalveolar lavage surfactant protein a, B, and d concentrations in preterm infants ventilated for respiratory distress syndrome receiving natural and synthetic surfactants. Pediatr Res. 2003 Apr;53(4):663-70.
- Bernard GR, Artigas A, Brigham KL, Carlet J, Falke K, Hudson L, Lamy M, LeGall JR, Morris A, Spragg R. Report of the American-European Consensus conference on acute respiratory distress syndrome: definitions, mechanisms, relevant outcomes, and clinical trial coordination. Consensus Committee. J Crit Care. 1994 Mar;9(1):72-81.
- Bhatia M, Moochhala S. Role of inflammatory mediators in the pathophysiology of acute respiratory distress syndrome. J Pathol. 2004 Feb;202(2):145-56.
- Brackenbury AM, Malloy JL, McCaig LA, Yao LJ, Veldhuizen RA, Lewis JF. Evaluation of alveolar surfactant aggregates in vitro and in vivo. Eur Respir J. 2002 Jan;19(1):41-6.
- Callister ME, Evans TW. Pulmonary versus extrapulmonary acute respiratory distress syndrome: different diseases or just a useful concept? Curr Opin Crit Care. 2002 Feb;8(1):21-5.
- Callister ME, Evans TW. Pulmonary versus extrapulmonary acute respiratory distress syndrome: different diseases or just a useful concept? Curr Opin Crit Care. 2002 Feb;8(1):21-5.
- Cheng IW, Ware LB, Greene KE, Nuckton TJ, Eisner MD, Matthay MA. Prognostic value of surfactant proteins A and D in patients with acute lung injury. Crit Care Med. 2003 Jan;31(1):20-7.
- Clark H, Reid K. The potential of recombinant surfactant protein D therapy to reduce inflammation in neonatal chronic lung disease, cystic fibrosis, and emphysema. Arch Dis Child. 2003 Nov;88(11):981-4.
- Clark H, Reid KB. Structural requirements for SP-D function in vitro and in vivo: therapeutic potential of recombinant SP-D. Immunobiology. 2002 Sep;205(4-5):619-31.
- Clements JA. Surface tension of lung extracts. Proc Soc Exp Biol Med. 1957 May;95(1):170-2.
- Crouch E, Wright JR. Surfactant proteins a and d and pulmonary host defense. Annu Rev Physiol. 2001;63:521-54.
- Cui XG, Tashiro K, Matsumoto H, Tsubokawa Y, Kobayashi T. Aerosolized surfactant and dextran for experimental acute respiratory distress syndrome caused by acidified milk in rats. Acta Anaesthesiol Scand. 2003 Aug;47(7):853-60.
- Davidson KG, Bersten AD, Barr HA, Dowling KD, Nicholas TE, Doyle IR. Endotoxin induces respiratory failure and increases surfactant turnover and respiration independent of alveolocapillary injury in rats. Am J Respir Crit Care Med. 2002 Jun 1;165(11):1516-25.
- De Sanctis GT, Tomkiewicz RP, Rubin BK, Schurch S, King M. Exogenous surfactant enhances mucociliary clearance in the anaesthetized dog. Eur Respir J. 1994 Sep;7(9):1616-21.
- Dechert RE. The pathophysiology of acute respiratory distress syndrome. Respir Care Clin N Am. 2003 Sep;9(3):283-96, vii-viii.
- Doyle IR, Bersten AD, Nicholas TE. Surfactant proteins-A and -B are elevated in plasma of patients with acute respiratory failure. Am J Respir Crit Care Med. 1997 Oct;156 (4 Pt 1):1217-29.
- Eisner MD, Parsons P, Matthay MA, Ware L, Greene K; Acute Respiratory Distress Syndrome Network. Plasma surfactant protein levels and clinical outcomes in patients with acute lung injury. Thorax. 2003 Nov;58(11):983-8.
- Gattinoni L, Pelosi P, Suter PM, Pedoto A, Vercesi P, Lissoni A. Acute respiratory distress syndrome caused by pulmonary and extrapulmonary disease. Different syndromes? Am J Respir Crit Care Med. 1998 Jul;158(1):3-11.
- Giuntini C. Ventilation/perfusion scan and dead space in pulmonary embolism: are they useful for the diagnosis? Q J Nucl Med. 2001 Dec;45(4):281-6.
- Gommers D, Eijking EP, So KL, van't Veen A, Lachmann B. Bronchoalveolar lavage with a diluted surfactant suspension prior to surfactant instillation improves the effectiveness of surfactant therapy in experimental acute respiratory distress syndrome (ARDS). Intensive Care Med. 1998 May;24(5):494-500.
- Gong MN, Wei Z, Xu LL, Miller DP, Thompson BT, Christiani DC. Polymorphism in the surfactant protein-B gene, gender, and the risk of direct pulmonary injury and ARDS. Chest. 2004 Jan;125(1):203-11.
- Goss CH, Brower RG, Hudson LD, Rubenfeld GD; ARDS Network. Incidence of acute lung injury in the United States. Crit Care Med. 2003 Jun;31(6):1607-11.
- Gregory TJ, Steinberg KP, Spragg R, Gadek JE, Hyers TM, Longmore WJ, Moxley MA, Cai GZ, Hite RD, Smith RM, Hudson LD, Crim C, Newton P, Mitchell BR, Gold AJ. Bovine surfactant therapy for patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 1997 Apr;155(4):1309-15.
- Groeneveld AB. Vascular pharmacology of acute lung injury and acute respiratory distress syndrome. Vascul Pharmacol. 2002 Nov;39(4-5):247-56.
- Gunther A, Ruppert C, Schmidt R, Markart P, Grimminger F, Walmrath D, Seeger W. Surfactant alteration and replacement in acute respiratory distress syndrome. Respir Res. 2001;2(6):353-64.
- Gunther A, Schmidt R, Harodt J, Schmehl T, Walmrath D, Ruppert C, Grimminger F, Seeger W. Bronchoscopic administration of bovine natural surfactant in ARDS and septic shock: impact on biophysical and biochemical surfactant properties. Eur Respir J. 2002 May;19(5):797-804.
- Hafner D, Germann PG, Hauschke D.Effects of rSP-C surfactant on oxygenation and histology in a rat-lung-lavage model of acute lung injury. Am J Respir Crit Care Med. 1998 Jul;158(1):270-8.
- Haitsma JJ, Lachmann RA, Lachmann B. Lung protective ventilation in ARDS: role of mediators, PEEP and surfactant. Monaldi Arch Chest Dis. 2003 Apr-Jun;59(2):108-18.
- Haitsma JJ, Lachmann U, Lachmann B. Exogenous surfactant as a drug delivery agent. Adv Drug Deliv Rev. 2001 Apr 25;47(2-3):197-207.
- Haitsma JJ, Papadakos PJ, Lachmann B. Surfactant therapy for acute lung injury/acute respiratory distress syndrome. Curr Opin Crit Care. 2004 10(Feb):18-22
- Hartog A, Gommers D, Haitsma JJ, Lachmann B. Improvement of lung mechanics by exogenous surfactant: effect of prior application of high positive end-expiratory pressure. British Journal of Anaesthesia, 2000, Vol. 85, No. 5 752-756
- Haslam PL, Hughes DA, MacNaughton PD, Baker CS, Evans TW. Surfactant replacement therapy in late-stage adult respiratory distress syndrome. Lancet. 1994 Apr 23;343(8904):1009-11.
- Ito Y, Goffin J, Veldhuizen R, Joseph M, Bjarneson D, McCaig L, Yao LJ, Marcou J, Lewis J. Timing of exogenous surfactant administration in a rabbit model of acute lung injury. J Appl Physiol. 1996 Apr;80(4):1357-64.
- Ito Y, Manwell SE, Kerr CL, Veldhuizen RA, Yao LJ, Bjarneson D, McCaig LA, Bartlett AJ, Lewis JF. Effects of ventilation strategies on the efficacy of exogenous surfactant therapy in a rabbit model of acute lung injury. Am J Respir Crit Care Med. 1998 Jan;157(1):149-55.
- Ito Y, Veldhuizen RA, Yao LJ, McCaig LA, Bartlett AJ, Lewis JF. Ventilation strategies affect surfactant aggregate conversion in acute lung injury. Am J Respir Crit Care Med. 1997 Feb;155(2):493-9.
- Jeffery PK. The origins of secretions in the lower respiratory tract. Eur J Respir Dis Suppl. 1987;153:34-42.
- Kerr CL, Ito Y, Manwell S, Veldhuizen R, Yao L-J, McCaig L, Lewis JF. Effects of surfactant distribution and ventilation strategies on efficacy of exogenous surfactant. J Appl Physiol. 1998, 85(2): 676-684.
- Kerr CL , Veldhuizen R, Lewis JF. Effects of High-Frequency Oscillation on Endogenous Surfactant in an Acute Lung Injury Model. Am. J. Respir. Crit. Care Med. 2001 164(2), July: 237-242
- Kobayashi T, Nitta K, Ganzuka M, Inui S, Grossmann G, Robertson B. Inactivation of exogenous surfactant by pulmonary edema fluid. Pediatr Res. 1991 Apr;29(4 Pt 1):353-6.
- Krause MF, Hoehn T. Timing of surfactant administration determines its physiologic response in a rabbit model of airway lavage. Biol Neonate. 2000 Mar;77(3):196-202.
- Lekka ME, Liokatis S, Nathanail C, Galani V, Nakos G. The impact of intravenous fat emulsion administration in acute lung injury. Am J Respir Crit Care Med. 2004 Mar 1;169(5):638-44.
- LeVine AM, Kurak KE, Bruno MD, Stark JM, Whitsett JA, Korfhagen TR. Surfactant protein-A-deficient mice are susceptible to Pseudomonas aeruginosa infection. Am J Respir Cell Mol Biol. 1998 Oct;19(4):700-8.
- LeVine AM, Whitsett JA, Gwozdz JA, Richardson TR, Fisher JH, Burhans MS, Korfhagen TR. Distinct effects of surfactant protein A or D deficiency during bacterial infection on the lung. J Immunol. 2000 Oct 1;165(7):3934-40.
- LeVine AM, Whitsett JA, Hartshorn KL, Crouch EC, Korfhagen TR. Surfactant protein D enhances clearance of influenza A virus from the lung in vivo. J Immunol. 2001 Nov 15;167(10):5868-73.
- Lewis JF, Brackenbury A. Role of exogenous surfactant in acute lung injury. Crit Care Med. 2003 Apr;31(4 Suppl):S324-8.
- Lewis JF, Goffin J, Yue P, McCaig LA, Bjarneson D, Veldhuizen R. Evaluation of delivery methods for two exogenous surfactant preparations in an animal model of acute lung injury. J. Appl. Physiol . 1996 80: 1156-1164
- Lewis JF, Jobe AH. Surfactant and the adult respiratory distress syndrome. Am Rev Respir Dis. 1993 Jan;147(1):218-33.
- Lewis JF, McCaig L. Aerosolized versus instilled exogenous surfactant in a nonuniform pattern of lung injury. Am Rev Respir Dis. 1993 Nov;148(5):1187-93.
- Lewis JF, Veldhuizen R. The role of exogenous surfactant in the treatment of acute lung injury. Annual Review of Physiology. 2003, 65(March): 613-642
- LewisJF, Novick RJ, Veldhuizen RAW. Surfactant in Lung Injury and Lung Transplantation. Springer-Verlag, New York. 1997, p:1–181.
- Lim CM, Kim EK, Lee JS, Shim TS, Lee SD, Koh Y, Kim WS, Kim DS, Kim WD. Comparison of the response to the prone position between pulmonary and extrapulmonary acute respiratory distress syndrome. Intensive Care Med. 2001 Mar;27(3):477-85.
- Lin Z, Pearson C, Chinchilli V, Pietschmann SM, Luo J, Pison U, Floros J. Polymorphisms of human SP-A, SP-B, and SP-D genes: association of SP-B Thr131Ile with ARDS. Clin Genet. 2000 Sep;58(3):181-91.
- Luce JM. Acute lung injury and the acute respiratory distress syndrome. Crit Care Med. 1998 Feb;26(2):369-76.
- MacIntyre NR Aerosolized medications for altering lung surface active properties. Respir Care 2000;45(6):676–683
- Madsen J, Tornoe I, Nielsen O, Koch C, Steinhilber W, Holmskov U. Expression and localization of lung surfactant protein A in human tissues. Am J Respir Cell Mol Biol. 2003 Nov;29(5):591-7.
- McCormack FX, Whitsett JA. The pulmonary collectins, SP-A and SP-D, orchestrate innate immunity in the lung. J Clin Invest. 2002 Mar;109(6):707-12.
- Merrill JD, Ballard RA. Pulmonary surfactant for neonatal respiratory disorders. Curr Opin Pediatr. 2003 Apr;15(2):149-54.
- Mora R, Arold S, Marzan Y, Suki B, Ingenito EP. Determinants of surfactant function in acute lung injury and early recovery. Am J Physiol Lung Cell Mol Physiol. 2000 Aug;279(2):L342-9.
- Nakos G, Kitsiouli EI, Lekka M. Bronchoalveolar Lavage Alterations in Pulmonary Embolism. Am. J. Respir. Crit. Care Med., Volume 158, Number 5, November 1998, 1504-1510
- Nakos G, Tsangaris H, Liokatis S, Kitsiouli E, Lekka ME. Ventilator-associated pneumonia and atelectasis: evaluation through bronchoalveolar lavage fluid analysis. Intensive Care Med. 2003 Apr;29(4):555-63.
- Nitta K, Kobayashi T. Impairment of surfactant activity and ventilation by proteins in lung edema fluid. Respir Physiol. 1994 Jan;95(1):43-51.
- Panda AK, Nag K, Harbottle RR, Rodriguez Capote K, Veldhuizen RA, Petersen NO, Possmayer F. Effect of Acute Lung Injury on Structure and Function of Pulmonary Surfactant Films. Am J Respir Cell Mol Biol. 2003 Nov 20
- Pelosi P, D'Onofrio D, Chiumello D, Paolo S, Chiara G, Capelozzi VL, Barbas CS, Chiaranda M, Gattinoni L. Pulmonary and extrapulmonary acute respiratory distress syndrome are different. Eur Respir J Suppl. 2003 Aug;42:48s-56s.
- Rasaiah VP, Malloy JL, Lewis JF, Veldhuizen RA. Early surfactant administration protects against lung dysfunction in a mouse model of ARDS. Am J Physiol Lung Cell Mol Physiol. 2003 May;284(5):L783-90. Epub 2003 Jan 17.
- Richman PS, Spragg RG, Robertson B, Merritt TA, Curstedt T. The adult respiratory distress syndrome: first trials with surfactant replacement. Eur Respir J Suppl. 1989 Mar;3:109s-111s.
- Rubin BK. Physiology of airway mucus clearance. Respir Care. 2002 Jul;47(7):761-8.
- Ruppert C, Pucker C, Markart P, Seibold K, Bagheri A, Grimminger F, Seeger W, Gunther A. Impact of surface tension on the conversion rate of large to small surfactant aggregates. Biophys Chem. 2003 May 1;104(1):229-38.
- Seeger W, Spragg RG, Taut FJH, Hafner D, Lewis JF. Treatment with r-SP-C surfactant reduces mortality in ARDS due to primary pulmonary events. Am J respire Crit Care Med 2002;165: A219.
- Sood SL, Balaraman V, Finn KC, Britton B, Uyehara CF, Easa D. Exogenous surfactants in a piglet model of acute respiratory distress syndrome. Am J Respir Crit Care Med. 1996 Feb;153(2):820-8.
- Spragg RG, Lewis JF, Wurst W, Hafner D, Baughman RP, Wewers MD, Marsh JJ. Treatment of acute respiratory distress syndrome with recombinant surfactant protein C surfactant. Am J Respir Crit Care Med. 2003 Jun 1;167(11):1562-6.
- Spragg RG. Surfactant replacement therapy. Clin Chest Med. 2000 Sep;21(3):531-41
- Stamme C, Brasch F, von Bethmann A, Uhlig S. Effect of surfactant on ventilation-induced mediator release in isolated perfused mouse lungs. Pulm Pharmacol Ther. 2002;15(5):455-61.
- Strayer DS, Herting E, Sun B, Robertson B. Antibody to surfactant protein A increases sensitivity of pulmonary surfactant to inactivation by fibrinogen in vivo. Am J Respir Crit Care Med. 1996 Mar;153(3):1116-22.
- Suresh GK, Soll RF. Current surfactant use in premature infants. Clin Perinatol. 2001 Sep;28(3):671-94.
- Taeusch HW, Keough KM. Inactivation of pulmonary surfactant and the treatment of acute lung injuries. Pediatr Pathol Mol Med. 2001 Nov-Dec;20(6):519-36.
- Tegtmeyer FK, Moller J, Zabel P. Inhibition of granulocyte activation by surfactant in a 2-yr-old female with meningococcus-induced ARDS. Eur Respir J. 2002 Apr;19(4):776-9.
- Tsangaris I, Lekka ME, Kitsiouli E, Constantopoulos S, Nakos G. Bronchoalveolar lavage alterations during prolonged ventilation of patients without acute lung injury. Eur Respir J. 2003 Mar;21(3):495-501.
- van Soeren MH, Diehl-Jones WL, Maykut RJ, Haddara WM. Pathophysiology and implications for treatment of acute respiratory distress syndrome. AACN Clin Issues. 2000 May;11(2):179-97.
- Vazquez de Anda GF, Lachmann RA, Gommers D, Verbrugge SJ, Haitsma J, Lachmann B. Treatment of ventilation-induced lung injury with exogenous surfactant. Intensive Care Med. 2001 Mar;27(3):559-65.
- Veldhuizen R, Nag K, Orgeig S, Possmayer F. The role of lipids in pulmonary surfactant. Biochim Biophys Acta. 1998 Nov 19;1408(2-3):90-108.
- Veldhuizen RA, McCaig LA, Akino T, Lewis JF. Pulmonary surfactant subfractions in patients with the acute respiratory distress syndrome. Am J Respir Crit Care Med. 1995 Dec;152(6 Pt 1):1867-71.
- Veldhuizen RA, Yao LJ, Lewis JF. An examination of the different variables affecting surfactant aggregate conversion in vitro. Exp Lung Res. 1999 Mar;25(2):127-41.
- Veldhuizen RAW, Marcou J, Yao L-J, McCaig L, Ito Y, Lewis J F. Alveolar surfactant aggregate conversion in ventilated normal and injured rabbits. Am. J. Physiol. 1996. 270: L152-L158
- Verbrugge SJC, Bohm SH, Gommers D, Zimmerman LJI, Lachmann B. Surfactant impairment after mechanical ventilation with large alveolar surface area changes and effects of positive end-expiratory pressure. British Journal of Anaesthesia, 1998 80(3): 360-364
- Weaver TE, Conkright JJ. Function of surfactant proteins B and C. Annu Rev Physiol. 2001;63:555-78.
- Weaver TE, Na CL, Stahlman M. Biogenesis of lamellar bodies, lysosome-related organelles involved in storage and secretion of pulmonary surfactant. Semin Cell Dev Biol. 2002 Aug;13(4):263-70.
- Weg JG, Balk RA, Tharratt RS, Jenkinson SG, Shah JB, Zaccardelli D, Horton J, Pattishall EN. Safety and potential efficacy of an aerosolized surfactant in human sepsis-induced adult respiratory distress syndrome. JAMA. 1994 Nov 9;272(18):1433-8.
- Wright JR, Dobbs LG. Regulation of pulmonary surfactant secretion and clearance. Annu Rev Physiol. 1991;53:395-414.
- Wright JR. Pulmonary surfactant: a front line of lung host defense. J Clin Invest. 2003 May;111(10):1453-5.
- Wu H, Kuzmenko A, Wan S, Schaffer L, Weiss A, Fisher JH, Kim KS, McCormack FX. Surfactant proteins A and D inhibit the growth of Gram-negative bacteria by increasing membrane permeability. J Clin Invest. 2003 May;111(10):1589-602.
- Zhu BL, Ishida K, Quan L, Fujita MQ, Maeda H. Immunohistochemistry of pulmonary surfactant-associated protein A in acute respiratory distress syndrome. Leg Med (Tokyo). 2001 Sep ;3(3):134-40.

