Опыт применения отечественного рекомбинантного активированного фактора VII
при выполнении лапароскопической спленэктомии у пациентки с хронической иммунной тромбоцитопенией
Reviewing maternal deaths to make pregnancy safer
Описан клинический случай успешного применения отечественного рекомбинантного активированного фактора VII (препарат Коагил-VII) при лапароскопической спленэктомии у пациентки с хронической иммунной тромбоцитопенией, рефрактерной к терапии 1-й линии, включая глюкокортикостероиды, внутривенный иммуноглобулин, ритуксимаб. Эффективность и безопасность применения препарата Коагил-VII доказана клинически и с помощью интегральных лабораторных тестов – тромбоэластографии и тромбодинамики, позволяющих оценить все звенья свертывающей системы крови.
Ключевые слова: хроническая иммунная тромбоцитопения, лапароскопическая спленэктомия, рекомбинантный активированный фактор VII, тромбоэластография, тромбодинамика
Иммунная тромбоцитопения (ИТП) относится к приобретенным аутоиммунным заболеваниям крови, в 40% случаев является причиной геморрагического синдрома в гематологической практике. Ежегодно диагностируется 2 и 12 случаев ИТП на 100 тыс. взрослого и детского населения соответственно и ежегодно 1–3% тяжелых случаев заканчиваются летальным исходом [1, 2]. Механизм развития тромбоцитопении при данном заболевании заключается в фагоцитозе и деструкции тромбоцитов макрофагами селезенки вследствие образования антител (АТ) к их мембранным антигенам, обусловленного аномальным ответом на антигены. Накопленные к настоящему времени факты свидетельствуют о том, что антитромбоцитарные АТ являются основным патогенетическим фактором в развитии ИТП. Анти геном-мишенью являются гликопротеины (GP) поверхности тромбоцитов – GPIIb/IIIa или реже – GPIb/IX [3, 4]. В последнем случае механизмом деструкции тромбоцитов является комплементзависимый лизис. Роль селезенки в развитии тромбоцитопении не ограничивается фагоцитозом и деструкцией тромбоцитов макрофагами, помимо этого, селезенка является и местом продукции антитромбоцитарных АТ. Спектр терапевтического воздействия при ИТП достаточно широк: применение глюкокортикостероидов и иммуносупрессивных препаратов, инфузии внутривенного иммуноглобулина (ВВИГ), применение агонистов тромбопоэтиновых рецепторов. Спленэктомия показана при хронической ИТП с тяжелыми кровотечениями при безуспешной консервативной терапии [5–9]. Существует несколько оперативных доступов при выполнении спленэктомии в зависи мости от размера селезенки: лапароскопический, абдоминальный, лапароскопический с ручным ассистированием. Главное преимущество лапароскопической спленэктомии перед традиционной абдоминальной заключается в малой травматичности вмешательства, которая достигается за счет отсутствия широких разрезов брюшной стенки, выполнения всех этапов операции под постоянным зрительным контролем без выведения селезенки в рану и повреждения соседних органов [10–14]. Вместе с тем лапароскопическая хирургия имеет ряд ограничений технологического характера. Активное кровотечение затрудняет визуализацию и препятствует безопасному оперированию. Аспирация крови в случаях интенсивного кровотечения приводит к потере объема рабочего пространства в брюшной полости, а излившаяся кровь поглощает свет, ухудшая условия видимости. Инсуффляция газа в брюшную полость при выполнении лапароскопического вмешательства и, соответственно, увеличение внутрибрюшного давления являются фактором риска тромбообразования, что необходимо учитывать при назначении гемостатической терапии [15–18]. Нередко операцию приходится выполнять в условиях глубокой тромбоцитопении и геморрагического синдрома, что чревато интра- и послеоперационными кровотечениями. Обеспечение гемостаза в подобных ситуациях является далеко не решенной проблемой. Транс фузионная тактика при выполнении спленэктомии при ИТП имеет свои особенности. Трансфузии донорских тромбоцитов могут использоваться при угрожающих жизни кровотечениях для получения кратковременного гемостатического эффекта [9], однако на практике проводятся редко. Принятый в Гематологическом научном центре (ГНЦ) Минздравсоцразвития России (Москва) протокол гемостатической терапии при выполнении спленэктомии включает использование свежезамороженной плазмы (СЗП), которая сбалансирована по компонентам прокоагулянтной, антикоагулянтной и фибринолитической систем. Трансфузии СЗП частично компенсируют дефицит тромбоцитарного звена гемостаза за счет повышения коагуляционного потенциала крови. Однако не всегда рутинная терапия является эффективной и обеспечивает надежный гемостаз [5, 7, 17].
Помимо стандартных коагулогических тестов, для контроля гемостаза в последнее время активно используют тромбоэластографию (ТЭГ) и тромбодинамику. Ключом к трактованию ТЭГ является широко обсуждаемая в последнее время клеточная модель свертывания крови. По данным, полученным в ряде исследований [19, 20] с использованием электронной микроскопии фаз свертывания, описанные в модели изменения четко соответствуют показателям ТЭГ: R – инициация (время от начала измерения до образования первых волокон фибрина), K – усиление (скорость достижения плотности сгустка) и угол ?– распространение (скорость укрепления сгустка). Основным показателем ТЭГ, характеризующим состоятельность тромбоцитарного звена гемостаза, является максимальная прочность сгустка (МА), но при глубоких нарушениях функции тромбоцитов изменения захватывают и интервал K, характеризующий фазу усиления, проходящую на поверхности активированных тромбоцитов.
Тромбодинамика – новый метод диагностики состояния системы свертывания крови на основе анализа пространственно-временной динамики роста фибринового сгустка в системе без перемешивания. В отличие от всех уже применяемых в клинической практике методов оценки состояния плазменного звена гемостаза, в которых активация свертывания происходит одновременно во всем исследуемом объеме плазмы, в основу тромбодинамики положен принцип запуска свертывания на плоской поверхности с нанесенным на нее активатором свертывания – тромбопластином, содержащим тканевый фактор (ТФ) и липиды. Тем самым достигается имитация повреждения стенки сосуда и начала формирования в этом месте тромба, препятствующего кровопотере. В тесте отсутствует перемешивание образца плазмы, характерное для рутинных коагулогических методов, вследствие чего появляется возможность наблюдать процесс роста сгустка в глубь образца плазмы. Так воссоздаются оба процесса, происходящих в организме, – активация свертывающей системы в месте повреждения эндотелия и дальнейшее распространение процесса свертывания в пространстве. Метод тромбодинамики основан на принципе пространственного разделения процесса активации свертывания и роста фибринового сгустка и позволяет оценивать как качество функционирования отдельных составляющих системы гемостаза, так и всей системы плазменного гемостаза в целом [21–25]. На рис. 1 представлен принцип метода тромбодинамики. На рис. 1, априведены типичные фотографии растущего сгустка в плазме крови здорового донора в моменты времени 0, 15, 30, 45 и 60 мин, получаемые при проведении анализа тромбодинамики на аналитической системе «Регистратор тромбодинамики» (ООО «Гемакор», Россия). На основании исходных фотографий с помощью специального программного обеспечения рассчитываются профили светорассеяния растущего сгустка (см. рис. 1, б). Анализ полученных профилей светорассеяния в разные моменты времени (см. рис. 1, в) дает основные численные параметры тромбодинамики: время задержки роста сгустка (Тлаг), начальную (Vнач., вблизи активатора) и стационарную (Vстац.) скорости роста сгустка, размер сгустка через 30 мин, время образования спонтанных сгустков в объеме плазмы (Tспонт., показатель гиперкоагуляции; см. рис. 1, г).
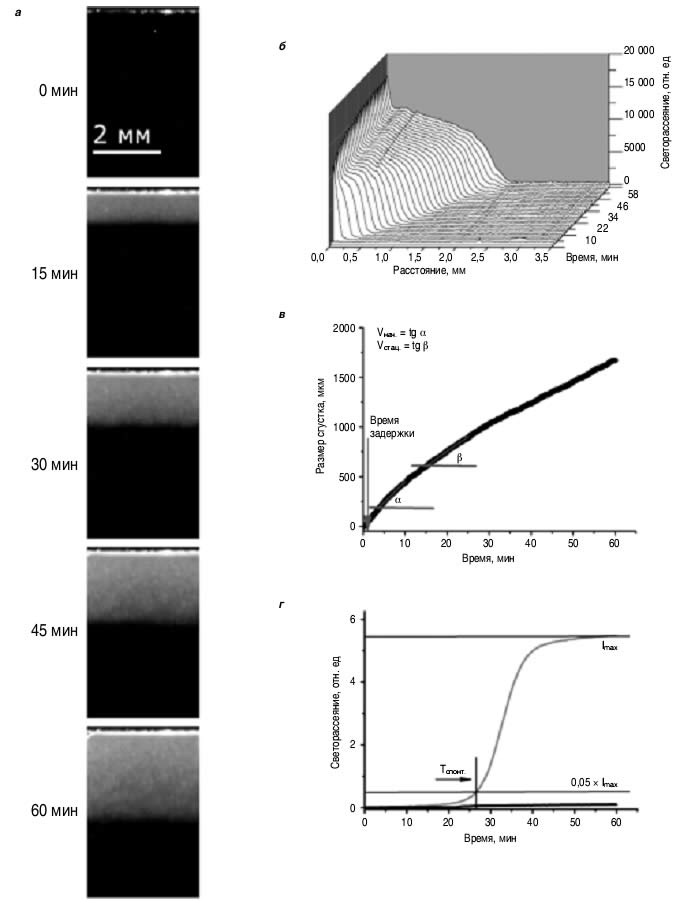 |
| Рис. 1. Исследование пространственной динамики роста сгустка (тромбодинамики). а– рост сгустка в нормальной плазме(последовательность кадров); б– профили светорассеяния от растущего сгустка в нормальной плазме;при достижении полумаксимальной плотности сгусток считается функциональным, и этот принцип используется для расчета зависимости размера сгустка от времени; в– зависимость размера сгустка отвремени; аппроксимирующие линии – наклоны участков кривой, которые используются для вычисления скоростей роста сгустка (начальной – Vнач.и стационарной – Vстац.); г– изменение светорассеяния в объеме плазмы с течением времени.Образование спонтанных сгустков регистрируется при превышении 5% от максимальной интенсивности светорассеяния (Imax). Продемонстрирован пример отсутствия спонтанных сгустков в нормальной плазме (черная кривая) и образования спонтанных сгустков при гиперкоагуляции (серая кривая). |
Приводим описание случая лапароскопической спленэктомии у пациентки с хронической ИТП.
Клинический случай
Пациентка М., 21 года, масса тела 72 кг, поступила в ГНЦ Минздравсоцразвития России в марте 2012 г. с диагнозом: хроническая иммунная тромбоцитопения, рефрактерная к терапии глюкокортикостероидными гормонами, рецидивирующее течение. В дебюте заболевания (апрель 2010 г.) отмечались выраженный геморрагический синдром, маточное кровотечение и кровотечение из разрыва кисты яичника, что потребовало хирургического вмешательства. Диагноз был поставлен по месту жительства на основании тромбоцитопении (количество тромбоцитов в периферической крови 10,0 ?109/л), выраженного геморрагического синдрома, раздражения мегакариоцитарного ростка костного мозга. Больная в дальнейшем наблюдалась по месту жительства в течение 2 лет, тяжелое состояние было обусловлено частыми обострениями геморрагического синдрома в виде носовых и маточных кровотечений. Диапазон терапевтических методов, использованных по месту жительства пациентки, был весьма широк: несколько курсов глюкокортикостероидной терапии (метилпреднизолон 500 мг в сутки в течение 3 сут внутривенно, затем преднизолон внутривенно 150 мг в сутки с постепенным снижением дозы до 30 мг в сутки в течение нескольких суток, затем преднизолон перорально в дозе 1 мг/кг в сутки в течение 1 мес с постепенным снижением дозы), ВВИГ, ритуксимаб (Мабтера®), плазма ферез. Стойкого эффекта не получено, при отмене глюкокортикостероидов количество тромбоцитов снижалось до 5,0–10,0 ?109/л. Длитель ная гормональная терапия привела к диффузному остеопорозу. В связи с неэффективностью проводимой терапии, выра женным геморрагическим синдромом больная поступила в ГНЦ Минздравсоцразвития России для проведения сплен эктомии. При поступлении состояние пациентки тяжелое, выраженный геморрагический синдром в виде маточного кровотечения, геморрагических высыпаний петехиального типа на коже. Количество тромбоцитов в периферической крови 26,0 ?109/л, выявлены специфические АТ к GPIIb/IIIa тромбоцитов. Данные ТЭГ указывали на гипокоагуляцию (рис. 2). Учитывая нормальные размеры селезенки (120 ?70 ?50 мм), для выполнения операции был выбран лапароскопический доступ как наиболее оптимальный. Начали операцию на фоне трансфузии СЗП. Выполнение спленэктомии, которая сама по себе не является технически сложной операцией, у данной пациентки было сопряжено с определенными трудностями, обусловленными близким расположением хвоста поджелудочной железы, рассыпным типом кровоснабжения, наличием висцерального ожирения и диапедезной кровоточивости, связанной с повышенной хрупкостью микрососудов из-за предшествующего гормонального лечения. Отмечалась выраженная диффузная кровоточивость, сгустки не образовывались, что затрудняло проведение хирургического вмешательства. С целью обеспечения гемостаза было принято решение ввести рекомбинантный активированный фактор VII (rFVIIa) в дозе 80 мкг/кг. Однократно было введено 6 мг препарата Коагил-VII (ОАО «Фармстандарт», Россия). Эффективность терапии отслеживали визуально по кровоточивости раневой поверхности и по данным коагулогических тестов (см. рис. 2, 3, таблицу). По данным ТЭГ через 15 мин после введения препарата Коагил-VII отмечено улучшение показателей гемостаза – увеличение максимальной прочности сгустка (МА) и скорости достижения плотности сгустка (укорочение интервала K), тем не менее у пациентки сохранялась гипокоагуляция (см. рис. 2).
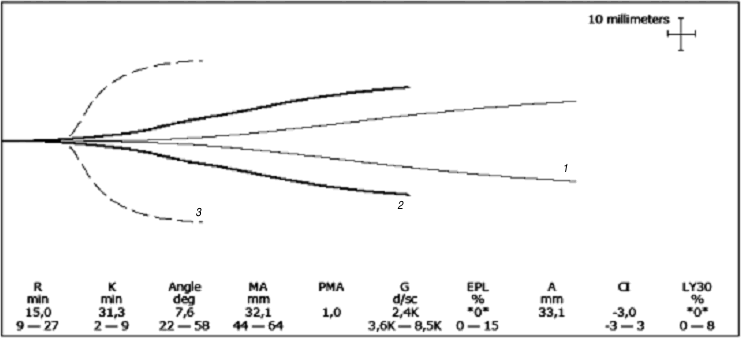 |
| Рис. 2. Динамика ТЭГ у пациентки М. в результате применения препарата Коагил-VII. 1– до введения препарата; 2– через 15 мин после введения препарата; 3– средняя графическая норма. |
Таблица.
Изменения показателей тромбодинамики в результате введения препарата Коагил-VII
| Показатель | Норма | Коагил-VII | |
| до введения | после введения | ||
| Тлаг, мин | 0,3–1,5 | 0,9 | 0,9 |
| Vнач., мкм/мин | 36–56 | 66 | 67 |
| Vстац., мкм/мин | 20–30 | 36 | 51 |
| Размер сгустка на 30-й минуте, мкм |
740–1120 | 1341 | 1775 |
| Тспонт., мин | > 60 | 54 | 28 |
Препарат Коагил-VII относится к препаратам с шунтирующим механизмом действия, эффективность которых связана с избирательным многократным усилением фрагмента системы свертывания крови. В описываемом случае это проявилось гиперкоагуляцией по данным исследования тромбодинамики (см. таблицу, рис. 3). Следует отметить, что по данным тромбодинамики компенсаторная гиперкоагуляция регистрировалась у пациентки еще до введения препарата Коагил-VII (вследствие ослабления тромбоцитарного гемостаза). Динамика показателей теста под влиянием препарата Коагил-VII иллюстрирует шунтирующий механизм действия препарата. Метод тромбодинимики, как ориентированный на систему свертывания крови и высокочувствительный главным образом к гиперкоагуляционным состояниям, наиболее наглядно демонстрирует механизм действия препарата Коагил-VII в описываемом случае.
 |
| Рис. 3. Изменения тромбодинамики у пациентки М. в результате применения препарата Коагил-VII. |
Хотя показатели лабораторных тестов не достигли нормальных значений, клинически был получен значимый гемостатический эффект. Через несколько минут после введения препарата Коагил-VII отмечено образование рыхлых сгустков и уменьшение кровоточивости. Операция с момента введения rFVIIa продлилась 2 ч и была успешно завершена лапароскопическим доступом. Интраоперационная кровопотеря составила 300 мл. Тромбозов не зафиксировано. Послеоперационный период протекал без осложнений. Был отмечен эффект от спленэктомии. Количество тромбоцитов в периферической крови увеличилось до 120,0 ?109/л, агрегация тромбоцитов с АДФ составила 70%, с ристомицином – 88%, с коллагеном – 63%. Проявлений геморрагического синдрома не было. Пациентка была выписана на 9-е сутки после операции.
С целью коррекции гемостаза во время операции было решено первым этапом выполнить трансфузию СЗП, поскольку, как было отмечено выше, СЗП сбалансирована по компонентам прокоагулянтной, антикоагулянтной и фибринолитической систем. Однако ожидаемого эффекта мы не получили. Отмечалась выраженная диффузная кровоточивость тканей, что затрудняло выполнение операции. После введения препарата Коагил-VII в дозе 80 мкг/кг в течение первых нескольких минут было зафиксировано клиническое улучшение, выражающееся в уменьшении кровоточивости, что позволило завершить операцию с незначительной общей кровопотерей. Интерес представляют результаты лабораторных тестов. По данным ТЭГ, отмечалось улучшение показателей гемостаза, хотя графическая кривая все еще находилась в зоне гипокоагуляции, в то время как данные тромбодинамики свидетельствовали о гиперкоагуляции со спонтанным образованием сгустков. Данное различие связано с тем, что при ТЭГ регистрируется совместный ответ тромбоцитарного и плазменного звеньев гемостаза, так что суммарный ответ после введения препарата Коагил-VII все еще находится в области гипокоагуляции, тогда как метод тромбодинамики отражает исключительно состояние плазменного звена гемостаза, и после введения препарата Коагил-VII отмечается максимальное его усиление. Эти данные отражают механизм действия препарата Коагил-VII, который приводит к повышенному образованию тромбина на поверхности тромбоцитов, следовательно, даже при малом количестве тромбоцитов в месте повреждения стенки сосуда rFVIIa способен обеспечить формирование количества тромбина, достаточного для адекватного гемостаза. Таким образом, увеличениепродукции тромбина в присутствии rFVIIa может компенсировать недостаток тромбоцитов при тромбоцитопенических состояниях. В настоящее время всесторонне изучается эффективность rFVIIa при использовании вне зарегистрированных показаний (off-label), в том числе и при тромбоцитопении, его тромбогенный потенциал. Именно на поверхности активированных тромбоцитов происходит активация FХ при введении rFVIIa, что ведет к образованию большого количества тромбина, достаточного для превращения фибриногена в фибрин, а также активация ингибитора фибринолиза. При введении избыточного количества rFVIIa пациен ту он продолжает активировать FX в течение всего времени существования rFVIIa в организме, и весь образующийся при этом FXa включается в протромбиновый комплекс. Прямая активация FX на активированных тромбоцитах в отсутствие ТФ значительно улучшает генерацию тромбина, что объясняет механизм гемостатического действия rFVIIa при кровотечениях, возникающих у пациентов с нормальным содержанием факторов свертывания. Интегральными лабораторными тестами объективной оценки системы гемостаза на сегодняшний день являются ТЭГ и тромбодинамика. Метод ТЭГ наиболее широко используется во время операции, поскольку позволяет оценить все звенья свертывающей системы крови (плазменное и тромбоцитарное звенья и систему фибринолиза). Это выгодное отличие ТЭГ от стандартных коагулогических тестов, которые позволяют оценить лишь некоторые звенья коагулогического каскада или активность отдельных факторов свертывания, но не весь каскад в целом. Полученные в результате ТЭГ данные о времени образования сгустка, скорости его роста, величине, упругости и растворении сгустка в процессе фибринолиза позволяют оценить практически все ключевые моменты в системе гемостаза и своевре менно назначить патогенетически обоснованную терапию. Тромбодинамика – достаточно новый коагулогический метод, высокочувствительный одновременно к гипо- и гиперкоагуляционным проявлениям. Данный тест позволяет оценить отдельные стадии формирования фибринового сгустка: запуск от активирующей поверхности (имитация раневой поверхности) и рост в пространстве (формирование протяженного плотного сгустка, препятствующего кровотечению). Этот подход позволяет учитывать не только кинетические, но и диффузионные особенности процесса свертывания крови.
Увеличение количества тромбоцитов и улучшение агрегации после спленэктомии явились косвенным доказа тельством того, что был элиминирован патологический пул АТ, локализованный в селезенке. Таким образом, у описываемой пациентки спленэктомия была единственно правильным методом 2-й линии терапии хронической ИТП. Спленэктомия на сегодняшний день во всем мире является методом выбора 2-й линии терапии при неэффективности 1-й линии терапии. Это признают большинство исследователей, которые отмечают эффект в 80% случаев [9]. В приведенном наблюдении представляет интерес возможность использования при технически сложной операции у больной с тромбоцитопенией современного эффективного, быст родействующего и безопасного при соблюдении необходимого коагулогического контроля препарата Коагил-VII. При ве денное клиническое наблюдение демонстрирует эффективность rFVIIa при выполнении хирургического вмешательства в условиях тромбоцитопении. Поскольку FVIIa–ТФ-зави си мый путь коагуляции имеет большое значение для первоначальной активации тромбоцитов, введение экзогенного rFVIIa гарантирует, что небольшое количество тромбоцитов будет максимально активировано. Это объясняет, почему у пациентов с тромбоцито пенией может наблюдаться ответ на введение сравнительно небольших доз rFVIIa. Данное наблюдение показывает необходимость терапии препаратом Коагил-VII под контролем ТЭГ и тромбодинамики для интегральной оценки эффективности и безопасности, в первую очередь в плане тромбообразования, особенно, если речь идет о лапароскопической спленэктомии. Совмест ное выполнение предлагаемых лабораторных тестов в динамике позволяет следить за результатом проводимой гемостатической терапии и наметить пути ее коррекции. В то же время следует отметить, что при выполнении хирургического вмешательства остановка кровотечения является ведущей в определении эффективности гемостатической терапии.
Литература
- Cohen Y.C., Djulbegovic B., Shamai-Lubovitz O., Mozes B. The bleeding risk and natural history of idiopathic thrombocytopenic purpura in patients with persistent low platelet counts. Arch Intern Med 2000; 160(11): 1630–8.
- Michel M. Immune thrombocytopenic purpura: epidemiology and implications for patients. Eur J Haematol Suppl 2009; 71: 3–7.
- Abrahamson P.E., Hall S.A., Feudjo-Tepie M., Mitrani-Gold F.S., Logie J. The incidence of idiopathic throbocitopenic purpura among adults: a population-based study and literature review. Eur J Haematol 2009; 83(2): 83–9.
- Cines D.B., Blanchette V.S. Immune throbocytopenic purpura. N Engl J Med 2002; 346(13): 995–1008.
- Воробьев А.И., ред. Руководство по гематологии. Т. 2. М.: Ньюдиамед; 2002.
- Anglin B.V., Rutherford C., Ramus R., Lieser M., Jones D.B. Immune thrombocytopenic purpura during pregnancy: laparoscopic treatment. JSLS 2001; 5(1): 63–7.
- Bresler L., Guerci A., Brunaud L., Ayav A., Sebbag H., Tortuyaux J.M., et al. Laparoscopic splenectomy for idiopathic thrombocytopenic purpura: outcome and long-term results. World J Surg 2002; 26(1): 111–4.
- Rodeghiero F., Stasi R., Gernsheimer T., Michel M., Provan D., Arnold D.M., et al. Standartization of terminology, definitions and outcome criteria in immune throbocytopenic purpura of adults and children. Blood 2009; 113(11): 2386–93.
- Provan D., Stasi R., Newland A., Blanchette V., Bolton-Maggs P., Bussel J., et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood 2010; 115(2): 168–86.
- Hellman P., Arvidsson D., Rastad J. Handport-assisted laparoscopic splenectomy in massive splenomegaly. Surg Endosc 2000; 14(12): 1177–9.
- Litwin D.E., Darzi A., Jakimiwicz J., Kelly J.J., Arvidsson D., Hansen P., Callery M.P., et al. Hand-assisted laparoscopic surgery (HALS) with the HandPort system: initial experience with 68 patients. Ann Surg 2000; 231(5): 715–23.
- Mahon D., Rhodes M. Laparoscopic splenectomy: size matters. Ann R Coll Surg Engl 2003; 85(4): 248–51.
- Marcaccio M.J. Laparoscopic splenectomy in chronic idiopathic thrombocytopenic purpura. Semin Hematol 2000; 37(3): 267–74.
- Карагюлян С.Р., Гржимоловский А.В., Данишян К.И., Шавлохов В.С., Захаров Г.Н., Галузяк В.С. и др. Хирургические доступы к селезенке. Анналы хирургической гепатологии 2006; 11(2): 92–9.
- Шутов С.А., Гржимоловский А.В., Карагюлян С.Р., Данишян К.И., Щербакова О.В., Марьин Д.С. Лапароскопическая комбинированная спленэктомия при спленомегалии. Проблемы гематологии и переливания крови 2005; 2: 45–52.
- Карагюлян С.Р., Гржимоловский А.В., Данишян К.И., Шавлохов В.С., Захаров Г.Н., Шутов С.А. Выбор способа спленэктомии при заболеваниях системы крови. Гематология и трансфузиология 2007; 52(1): 3–11.
- Карагюлян С.Р., Гржимоловский А.В., Шутов С.А., Данишян К.И. Технически сложная спленэктомия: выбор метода операции. Анналы хирургической гепатологии 2008; 13(2): 12–6.
- Гржимоловский А.В., Шутов С.А., Карагюлян С.Р., Данишян К.И. Лапароскопически ассистированная спленэктомия. Анналы хирургической гепатологии 2008; 13(2): 17–21.
- Kawasaki J., Katori N., Kodaka M., Miyao H., Tanaka K.A. Electron microscopic evaluations of clot morphology during thrombelastography. Anesth Analg 2004; 99(5): 1440–4.
- Johansson P.I., Svendsen M.S., Salado J., Bochsen L., Kristensen A.T. Investigation of the thrombin-generating capacity, evaluated by thrombelastogram, and clot formation evaluated by thrombelastography of platelets stored in the blood bank for up to7 days. Vox Sang 2008; 94(2): 113–8.
- Ovanesov M.V., Ananyeva N.M., Panteleev M.A., Ataullakhanov F.I., Saenko E.L. Initiation and propagation of coagulation from tissue factor-bearing cell monolayers to plasma: initiator cells do not regulate spatial growth rate. J Thromb Haemost 2005; 3(2): 321–31.
- Ovanesov M.V., Panteleev M.A., Sinauridze E.I., Kireev D.A., Plyushch O.P., Kopylov K.G., et al. Mechanisms of action of recombinant activated factor VII in the context of tissue factor concentration and distribution. Blood Coagul Fibrinolysis 2008; 19(8): 743–55.
- Panteleev M.A., Balandina A.N., Emelianenko V.M., Fadeeva O.A., Galstian G.M., Karamzin S.S., et al. Spatially heterogeneous experimental model of blood coagulation: from basic research to diagnostics of prothrombotic and bleeding tendencies. In: Conference Proceedings of the 21st International Thrombosis Congress. Milan, Italy, July 7–6, 2010: 422.
- Soshitova N.P., Karamzin S.S., Balandina A.N., Fadeeva O.A., Kretchetova A.V., Galstian G.M., et al. Spatial clot growth can predict prothrombotic changes of coagulation state in sepsis. In: Conference Proceedings of the XXIII Congress of the International Society of Thrombosis and Haemostasis (ISTH). Kyoto, Japan, July 23–28, 2011: abstr. P-TU-364.
- Balandina A.N., Kumskova, M.A., Kopylov K.G., Karamzin S.S., Fadeeva O.A., Panteleev M.A., et al. Prediction of bleeding tendencies in hemophilia a patients on prophylactic treatment using a novel reaction-diffusion assay of hemostasis. In: Conference Proceedings of the XXIII Congress of the International Society of Thrombosis and Haemostasis (ISTH). Kyoto, Japan, July 23–28, 2011. abstr. P-WE-574.

