European Journal of Anaesthesiology Volume 27, number 4, April 2010
Update on anaesthetic approach to pulmonary hypertension
Yee Wei Teo, Donna L. Greenhalgh
Обновленный анестезиологический подход к легочной гипертензии
Пациенты с легочной гипертензией, которым планируется операция, входят в группу значительного риска по заболеваемости и смертности. Это приводит к трудной ситуации для анестезиолога, что требует обсуждения стратегии для минимизации влияния на таких пациентов. Недавние разработки позволили лучше понять патофизиологические механизмы данной патологии и помогли в развитии новых методов лечения. Ниже представлена работа по предоперационной оценке и оптимизации лечения. Начинается новый подход к терапии блокаторами кальциевых каналов, аналогами простациклина, антагонистами рецепторов к эндотелину и ингибиторами фосфодиэстеразы-5. Это вызывает несомненный интерес у анестезиологов. Ниже представлены стратегии по лечению острых эпизодов декомпенсированной легочной гипертензии во время операции. Будут обсуждены новые многообещающие методы лечения, включая ингаляционную терапию milrinone и аналогами простациклина во время операции.
Ключевые слова: анестезия ( anesthesia ), синдром Эйзенменгера ( Eisenmenger syndrome ), легочная гипертензия ( pulmonary hypertension )
Легочная гипертензия – это патологическое состояние, при котором наблюдается повышение давления в сосудистой сети легких. Данная патология состоит из группы заболеваний, в результате которых происходит повышение давление в легочной артерии, что приводит к недостаточности правых отделов сердца.
Термин легочная артериальная гипертензия ( pulmonary arterial hypertension - PAH ) отличается от легочной гипертензии и является подгруппой легочной гипертензии. РАН является легочной гипертензией при отсутствии четкой причины развития, хотя в последнее время описаны некоторые факторы риска развития РАН.
Нормальное среднее давление в легочной артерии составляет 8-20 мм рт. ст. в покое (1). При легочной гипертензии показатель давления превышает 25 мм рт. ст. в покое. Говоря о РАН, необходимо учитывать дополнительный гемодинамический критерий заклинивающего давления легочных капилляров в 15 мм рт. ст. и легочного сосудистого сопротивления ( pulmonary vascular resistance – PVR ), как минимум, 3 единицы Вуда (1 единица Вуда = 1 мм рт. ст. · мин-1 = 80 дин · сек · см-5 ) при отсутствии причины (2, 3).
Пациенты с легочной гипертензией, которым предстоит операция, входят в группу выраженного риска по периоперационной заболеваемости и смертности. При внесердечной операции частота смертности достигает 7% (4). Дыхательная недостаточность и недостаточность правых отделов сердца являются наиболее частыми причинами смерти.
Классификация
Клинически легочная гипертензия делится на группы заболеваний, которые обладают схожей патофизиологией, клиническими проявлениями и терапевтическими подходами.
Исторически, легочная гипертензия классифицировалась как первичная или вторичная легочная гипертензия, в зависимости от причины. Подобный подход был отменен, так как по клинической классификации термины РАН и non - PAH заменили первичную и вторичную легочную гипертензию. По современной классификации данная патология делится на 5 групп, по схожим патофизиологическим механизмам и методам лечения (таблица 1). Она была пересмотрена в 2008 году с учетом обновленной информации.
Таблица 1. Клиническая классификация легочной гипертензии
(пересмотр 2008 года)
Группа 1: легочная артериальная гипертензия
|
Группа 2: легочная гипертензия вследствие патологии левых отделов сердца
|
Группа 3: легочная гипертензия вследствие заболеваний легких и/или гипоксии
|
Группа 4: хроническая тромбоэмболическая легочная гипертензия |
Группа 5: легочная гипертензия с неясными мультифакторными механизмами
|
Патогенез легочной артериальной гипертензии
В развитии РАН принимают участие множество патогенетических механизмов. Различные процессы приводят к выраженной клеточной пролиферации сосудов легких на фоне снижения апоптоза и преобладания вазоконстрикции и тромбообразования (6-10). Это ведет к уменьшению просвета сосудов.
На клеточном уровне, развитию РАН способствуют различные механизмы. Лучшее понимание этих механизмов привело к развитию новых терапевтических направлений по лечению.
У пациентов с РАН наблюдается снижение выработки и активности синтазы окиси азота эндотелия ( nitric oxide synthase – NOS ), что приводит к уменьшению выработки окиси азота эндотелия. В норме, окись азота стимулирует гуанилат циклазу с целью усиление выработки циклического гуанилат монофосфата ( cyclic guanylate monophosphate – cGMP ). cGMP является вторичным переносчиком, который уменьшает приток ионов кальция в клетки гладкой мускулатуры легочной артерии ( pulmonary arterial smooth muscle cells – PASMCs ) для поддержания состояния расслабления и ингибирования пролиферации. Под воздействием фосфодиэстеразы-5 (PDE-5) cGMP превращается в неактивную форму 5GMP . На фоне снижения выработки окиси азота у пациентов с РАН, уменьшается количество cGMP . Это приводит к спазму и пролиферации гладкой мускулатуры легочной артерии. К препаратам, которые действуют на данный процесс, относятся ингибиторы PDE 5. Они подавляют PDE 5, чтобы уменьшить распад cGMP и блокаторов кальциевых каналов, что приводит к уменьшению притока ионов кальция в PASMCs , что уменьшает кальций-зависимое сужение. Данный механизм является основой применения ингаляционных форм окиси азота при лечении острых эпизодов легочной гипертензии.
У пациентов с РАН наблюдается повышенная продукция и сниженный клиренс эндотелина-1 (ET-1) в сосудистой сети легких. ЕТ-1 является потенциальным вазоконстриктором и стимулирует пролиферацию PASMC . На данный патофизиологический механизм действуют антагонисты рецепторов к эндотелину.
Простациклин является сильным вазодилататором с антитромбоцитарной активацией и антипролиферативными свойствами. Выработка простациклинсинтазы снижена у пациентов с РАН, что ведет к дефициту простациклина. Это нарушает баланс между вазоконстрикцией, тромбозом и пролиферацией. Аналоги простациклина используются для лечения РАН с целью уменьшения этого дефицита.
Тригерные клетки пролиферации при травме эндотелия, медиаторы тромбоза и дисфункция тромбоцитов обеспечивают состояние тромбообразования. Для лечения данного механизма применяется терапия антикоагулянтом warfarin .
Исследования легочной гипертензии
Целью рабочей группы является подтвердить диагноз и установить причину легочной гипертензии. При наличии клинической картины данной патологии, наиболее подходящим методом исследования является эхокардиография.
Эхокардиография с Допплеровским исследованием позволяет оценить функцию правого желудочка, показатели давления и увеличения полостей сердца, подтвердить диагноз легочной гипертензии. Эхокардиография позволяет оценить любую кардиологическую причину легочной гипертензии, включая патология клапанов сердца, заболевания левых отделов сердца или врожденную патологию.
РАН является диагнозом исключения и необходимо исключить все возможные причины данной патологии, так как методы лечения сильно зависят именно от причины (рис. 1). Выполняются легочные функциональные тесты, исследования во сне, вентиляционно-перфузионное сканирование и определение серологических маркеров.
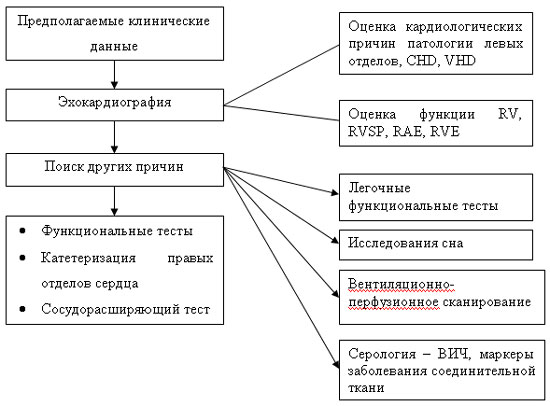 |
| Рисунок 1. Тактика рабочей группы при подозрении на легочную гипертензию. CHD – врожденные заболевания сердца. РН – легочная гипертензия. RAE – увеличение правого предсердия. RV – правый желудочек. RVE – увеличение правого желудочка. RVSP – систолическое давление правого желудочка. VHD – заболевание клапанов сердца. |
Если причину не удалось установить, то проводится катетеризация правых отделов сердца для подтверждения диагноза перед началом терапии.
Острые сосудорасширяющие тесты проводят параллельно с катетеризацией. При ответе на данный тест необходимо начать терапию блокаторами кальциевых каналов per os . Данная группа пациентов получают наиболее продолжительное положительное действие от лечения (11).
Предоперационная оценка и коррекция
При предоперационной оценке особое внимание обращается на причину легочной гипертензии, а также тяжесть и степень заболевания.
До операции необходимо обследовать пациента и установить причину (рис. 1). РАН не является распространенным заболеванием. Превалирует данная патология во Французской популяции – около 15 миллионов человек (12). У большинства пациентов, которым планируется оперативное лечение, легочная гипертензия развивается вследствие патологии сердца и легких или тромбоэмболии.
Пациенты с легочной артериальной гипертензией
Пациентов с РАН необходимо обследовать на маркеры неудовлетворительного прогноза и степень прогрессирования заболевания. К этим маркерам относятся: признаки недостаточности правых отделов сердца, плохой функциональный статус, низкий сердечный индекс, высокое давление в правом предсердии, повышение уровня натриуретического пептида, значительная дисфункция правого желудочка и увеличение размеров правого желудочка по ЭХО (13). Необходимость операции необходимо пересмотреть при наличии данных факторов. Средняя выживаемость пациентов IV класса по NYHA составляет 6 месяцев. В таких случаях операцию можно выполнять только по экстренным показаниям (14).
Оптимизация состояния пациентов с РАН включает как общие моменты, так и поддержание специфической терапии. Желательно получить совет по ведению от специалиста по РАН, который лечит данного конкретного пациента. Хотя информации, полученной в ходе контролируемых клинических исследований по общим аспектам терапии, нет, следующие рекомендации основаны на данных неконтролируемых исследований и мнениях экспертов (15).
Рекомендуется оксигенотерапия для поддержания сатурации O2 выше 90% для того, чтобы избежать гипоксической легочной вазоконстрикции. Диуретики показаны при признаках перегрузки правого желудочка. Применение антикоагулянтов под контролем МНО (целевые значения 1,5-2,5) рекомендуется при прогрессировании заболевания. При этом перед операцией может быть показана переходная терапия на гепарин.
Существуют 4 основных класса РАН-специфической терапии. Терапию данными препаратами необходимо продолжить в периоперационном периоде. Препараты и меры предосторожности в периоперационном периоде описаны ниже.
Блокаторы кальциевых каналов используется в подгруппе пациентов, которые остро реагируют на вазодилататоры. Около 10-20% пациентов с РАН демонстрируют сосудистую реакцию, и только половина пациентов хронически отвечают на данный тест (11, 16). Таким пациентам можно назначить nifedipine , amlodipine и diltiazem . Данные препараты не помогают пациентам, которые не отвечают на тест. Verapamil не используется вследствие его отрицательного инотропного эффекта. Во время периоперационного периода прием блокаторов кальциевых каналов необходимо возобновить как можно быстрее, если позволяют показатели системного кровяного давления. Если нет возможности энтерального приема препарата, то можно применять сублингвальные формы nifedipine . Также можно использовать другие группы сосудорасширяющих препаратов, например, аналоги простациклина.
Аналоги простациклина используется при РАН вследствие их сильного легочного сосудорасширяющего действия. У пациентов с РАН снижена выработка синтазы простациклина, что приводит к нарушению выработки простациклина. К применению одобрены epoprostenol , treprostenil и iloprost . Применение внутривенных форм epoprostenol (также известен как простациклин, PGI2, flolan ) наиболее доказано. Существуют данные, которые указывают на улучшение выживаемости при идиопатической РАН с улучшением функционального статуса и показателей гемодинамики (17, 18). Однако epoprostenol необходимо вводить внутривенно с определенным риском и большой стоимостью. Прекращение введения может привести к синдрому отмены, ухудшению течения легочной гипертензии и смерти. Для введения препарата treprostinil необходимо постоянное внутривенное или подкожное введение, а препарат iloprost применяется в виде аэрозоля и это требует частого введения.
Известно, что аналоги простациклина ингибируют агрегацию тромбоцитов. Данных о переносимости нейроаксиальной анестезии нет. Разумно не применять нейроаксиальную анестезию у пациентов, которые длительное время применяют аналоги простациклина, вследствие отсутствия убедительных доказательных данных.
Антагонисты рецепторов к эндотелину являются новой группой препаратов, которые блокируют рецепторы к эндотелину и уменьшают сосудосуживающее действие эндотелина-1 на сосудистую сеть легких. Пероральные формы bosentan и ambrisentan одобрены FDA в качестве препаратов для лечения РАН. На фоне приема bosentan наблюдается улучшение переносимости физических нагрузок и более позднее наступление декомпенсации (19). К побочным эффектам относятся: потенциальная тератогенность, гепатотоксичность и анемия. Таким образом, перед операцией необходим контроль показателей работы печени и уровня гемоглобина. Прямого действия на анестетики данные препараты не оказывают. Однако наблюдается действие на энзимы печение CYP3A и CYP2C9, что может нарушить действие препаратов, которые также связаны с этими энзимами. С другой стороны, применение препаратов, которые ингибируют CYP3A и CYP2C9 (amiodarone, erythromycin, diltiazem), приведет к увеличению уровня bosentan .
Ингибиторы PDE5 снижает разрушение cGMP , что приводит к вазодилатации. Sildanefil является селективным ингибитором PDE5 и одобрен при лечении РАН с целью улучшения симптоматики и функциональной емкости (20). Применение нитратов, которые также связаны с cGMP, необходимо избегать, так как они могут вызвать тяжелую гипотонию.
Пациенты с нелегочной артериальной гипертензией
Такие пациенты требуют оценки и активного лечения причины данной патологии.
Пациенты с заболеваниями дыхательной системы должны получать лечения для оптимизации функции дыхания, включая оксигенотерапию для поддержания сатурации более 90%. Рутинная РАН-специфическая терапия не показано пациентам с хроническими заболеваниями легких (21, 22).
Кардиологические пациенты должны иметь данные последнего осмотра с указанием необходимой терапии хронической сердечной недостаточности.
Недавно проводилась оценка необходимости назначение РАН-специфической терапии таким пациентам. Однако убедительных данных в необходимости подобной терапии нет.
Пациентам с хронической тромбоэмболической легочной гипертензией требуется терапия антикоагулянтами с переходной терапией на гепарины в периоперационном периоде. Некоторым пациентам показано выполнение хирургической тромбэндартерэктомии, которая может значительно улучшить их состояние. Предварительные данные свидетельствуют о положительном влиянии РАН терапии, если операция невыполнима. Однако данные эти ненадежные (21).
Лечение во время операции
Цели для гемодинамики
- Свести к минимуму и своевременно начать терапию при PVR
- Поддерживать общее сосудистое сопротивление (SVR) для адекватной перфузии сердца
- Мониторинг для диагностики декомпенсации правого желудочка
- Ранее лечение декомпенсации работы правого желудочка с целью предотвращения летального исхода
Во время операции необходимо оптимизировать наполнение правого желудочка, контролировать легочное давление и поддерживать системное перфузионное давление. Необходимо учитывать патофизиологические нарушения со стороны легочной гипертензии во время общего обезболивания, чтобы достигнуть этих целей.
Важным фактором является поддержание адекватной преднагрузки и сократительной способности миокарда вследствие повышенной постнагрузки правого желудочка.
Синусовый ритм очень важен. Пациенты плохо переносят аритмии, так как предсердный компонент важен для адекватного наполнения правого желудочка. Поэтому кардиоверсию или лекарственная терапия должны проводиться незамедлительно.
Патологически повышается PVR, и селективные легочные вазодилататоры могут принести пользу.
Необходима адекватная системная перфузия для того, чтобы избежать ишемии правого желудочка. Большинство анестетиков снижают SVR, что требует активное лечение сосудосуживающими препаратами.
Мониторинг при легочной гипертензии
Основу мониторинга составляют инвазивный контроль кровяного давления и регулярная оценка газового состава крови.
Катетер в легочной артерии позволяет постоянно контролировать важные параметры, включая: артериальное легочное давление, заклинивающее давление легочных капилляров, SVR, PVR и сердечный выброс. Однако введение легочного катетера может привести к нарушениям ритма, что повышает риск тромбоза катетера.
Контроль давления в центральных венах является альтернативой, но не обеспечивает информацией по такому количеству показателей. Необходима клиническая оценка для решения вопроса об инвазивном мониторинге.
Минимально инвазивные мониторы сердечного ритма дают небольшую возможность получить дополнительную информацию. Пищеводный Допплеровский монитор основан на определении скорости аортального кровотока для определения сердечного выброса. Устройства по анализу пульсового контура основаны на том принципе, что систолическая часть волны артериального давления пропорциональна ударному объему. Эти мониторы позволяют определять снижение сердечного выброса, но не могут дать специфическую информацию о состоянии правых отделов сердца и статусе легочной сосудистой сети.
Интраоперационная чрезпищеводная и трансторакальная эхокардиография очень полезна для прямой оценки наполнения и сократительной способности правого и левого желудочков. Многие кардиологические анестезиологи и реаниматологи тренируются в использовании эхокардиографии и пользуются данным методом во время периоперационного периода.
Анестезиологическое пособие
Анестезиологическое пособие не должно провоцировать пусковые механизмы легочной вазоконстрикции, включая гипоксию, гиперкапнию, ацидоз и гипотермию. Данные состояния необходимо быстро и агрессивно купировать.
Учитывая практически отсутствие доказательной базы по выбору метода анестезии, техника пособия и выбор препаратов должны зависеть от целей гемодинамики и операции. Описано успешное применение местного и общего обезболивания (23).
При применении нейроаксиального обезболивания необходимо следить за функцией дыхания и поддерживать системное перфузионное давление для того, чтобы избежать развития ишемии правого желудочка. Рекомендуется выполнение эпидуральной анестезии с медленным титрованием, а не спинальной анестезии.
Что же касается общего обезболивания, то описана сбалансированная техника с применением высоких доз опиоидов с целью притупления сердечнососудистых реакций на стимулы. Высокие дозы опиоидов не обладают прямым действием на легочную сосудистую сеть, позволяют уменьшить дозу и снизить частоту побочных эффектов.
Рекомендуется применять небольшие дыхательные объемы с целью предупреждения перерастяжения (hyperinflation), низкие положительные и дыхательные объемы при вентиляции легких, чтобы уменьшить вероятность повышения PVR . Необходимо избегать развития гиперкапнии (24).
Лечение острой декомпенсированной легочной гипертензии
Данная стратегия рекомендуется на основании положительного влияния на гемодинамику, однако данных об исходе мало.
- Агрессивное лечение гипоксии, гиперкапнии, ацидоза и гипотермии. Оксигенотерапия приводит к расширению сосудов легких и должна использоваться (25).
- Болюсное введение растворов при снижении центрального венозного давления ниже 12- 15 мм рт. ст. Прекратить при отсутствии улучшений (26).
- Начать инотропную поддержку для поддержки сократительной способности, особенно правого желудочка. Dobutamine и milrinone снижают PVR.
Dobutamine является инотропом, который преимущественно действует на β1-адренергические рецепторы. Внутривенное введение dobutamine в дозе 2-μг/кг/мин повышает сократительную способность и снижает PVR . Сочетание с окисью азота улучшает сердечный индекс и снижает PVR (27). Однако влияние на периферические β1-адренорецепторы приводит к вазодилатации и может потребовать дополнительное введение вазопрессоров. Milrinone является селективным ингибитором PDE3. Он повышает сократительную способность миокарда и снижает PVR и SVR . Снижение PVR оказывает положительное воздействие и milrinone может применяться в сочетании с окисью азота и другими легочными вазодилататорами (28, 29). Однако его влияние на SVR может также потребовать введения вазопрессоров для борьбы с системной гипотонией. Нагрузочная доза milrinone составляет 50μг/кг в/в с последующим введением со скоростью 0,25-0,75 μг/кг/мин.
Dopamine и adrenaline не являются препаратами первого выбора, но могут успешно применяться при системной гипотонии. На фоне применения dopamine значительного снижения PVR не наблюдается, а тахикардия на фоне применения препарата может привести к ишемии (30). Формально adrenaline не используется при легочной гипертензии и также может вызвать тахикардию.
Levoismendan является новым inodilator и применяется при сердечной недостаточности. Он действует как кальциевый синтетайзер, повышая чувствительность миоцитов к кальцию, тем самым усиливая сократительную способность без повышения уровня внутриклеточного кальция. Данный препарат используется как альтернативный инотроп при сердечной недостаточности (31). Однако его роль при лечении легочной гипертензии еще не установлена. Различные исследования показывают разные результаты (32, 33). - Начать терапию для расширения сосудов легких.
Ингаляционная форма окиси азота (iNO) стимулирует гуанилат циклазу, что повышает уровень cGMP и приводит к вазодилатации. Для уменьшения легочной гипертензии и улучшения сердечного индекса iNO применяется в дозе 20-40 ppm (34, 35). Он не обладает системным сосудорасширяющим действием и быстро инактивируется.
Для уменьшения легочной гипертензии также используются ингаляционный простациклин и iloprost (аналог простациклина), которые стимулируют цАМФ и вызывают вазодилатацию (36-39). Ингаляционный простациклин может вводитсья с помощью системы небулайзера в дыхательный сегмент контура. По литературным данным дозировка варьируется. Обычно проводится постоянная терапия через небулайзер 0,2-0,3 мл/мин 10-20 µг/мл простациклина, что создает режим дозирования 30-40 нг/кг/мин.
Стартовая доза внутривенной формы epoprostenol составляет 1-2 нг/кг/мин с последующим повышением на 1-2 нг/кг/мин каждые 15 минут. Системная гипотония может ограничить применение данного препарата.
Ингаляционная форма milrinone через небулайзер является селективным легочным вазодилататором. Путь введения может уменьшить системное воздействие. Данные небольших исследований показывают многообещающие результаты по применению, а комбинация с ингаляционными аналогами простациклина может усиливать эффект (40, 41). Обычно применяется 1 мг/мл milrinone через небулайзер сл скоростью 0,2-0,3 мл/мин в течение 10-20 минут. - Поддерживать системное давление.
Норадреналин действует на адренорецепторы, с преобладанием α1-сосудосуживающим действием. Он повышает и PVR, и SVR у пациентов с легочной гипертензией и поддерживает сердечный выброс. В основном, он используется для терапии системной гипотонии (42).
Вазопрессин действует через V1 рецепторы, вызывая сужение сосудов, и используется как альтернативный вазопрессор при септическом шоке. В экспериментальных условиях, он приводит к легочной вазодилатации и системной вазоконстрикции. Однако это положительное влияние не всегда наблюдается в клинической практике (43). Его роль в лечении легочной гипертензии еще не установлена, но описание некоторых случаев указывают на успешное применение для поддержания SVR (44, 45). - Если ничего не помогает, то можно попытаться использовать устройство для работы правого желудочка (right ventricular assist device – RVAD) или аортальную баллонную помпу (intraaortic balloon pump – IABP). RVAD помогает когда недостаточность правых отделов сердца развивается вторично недостаточности левых отделов сердца (46). IABP улучшает перфузионное давление миокарда и улучшает взаимодействие желудочков. Данное устройство может быть полезным в некоторых случаях (47, 48).
Пациенты с синдромом Эйзенменгера
Синдром Эйзенменгера отражает любое состояние, при котором тяжелая легочная гипертензия приводит к инверсии сброса крови слева направо или двойному направлению кровотока, что приводит к длительному соединению между системным и легочным кровотоком (49).
Раньше, при синдроме Эйзенменгера проводилась поддерживающая терапия, с единичными подходящими случаями для пересадки сердца и легких. Недавние небольшие исследования показали успешные результаты по лечению, лежащей в основе данной патологии, РАН. На фоне применения антагониста рецепторов к эндотелину (bosentan), ингибитора PDE5 (sildanefil) и аналогов простациклина наблюдались улучшения гемодинамики и переносимости физических нагрузок (50-52).
При оказании анестезиологического пособия пациентам с синдромом Эйзенменгера может наблюдаться повышение PVR или снижение SVR, что приведет к большему сбросу крови слева направо с последующей гипоксемией. Необходимо корректировать SVR.
Существует мало доказательств влияния легочных вазодилататоров. У некоторых пациентов с синдромом Эйзенменгера может сохраняться элемент сосудистой реакции и есть описания успешного применения легочных вазодилататоров. Во время операции необходимо избегать развития легочной гипертензии. Для этого могут использоваться iNO . Необходимо избегать чрезмерного применения сосудосуживающих препаратов или внезапного повышения SVR . Повышение сброса крови слева направо может привести к недостаточности правых отделов сердца.
Существует риска парадоксальной эмболии, о чем должны помнить анестезиолог и хирург. Повышенная вязкость крови вследствие полицетемии (как следствие гипоксии) требует тщательной оценки баланса жидкости и благоразумной гемодилюции.
Послеоперационный уход
Такие пациенты требуют тщательного мониторинга в послеоперационном периоде. Стратегии, которые четко выполнялись во время операции, должны быть продолжены в послеоперационном периоде. Необходимо избегать развитие гипоксии, гиперкапнии, ацидоза и гипотермии. Обязательным является адекватное обезболивание с целью профилактики катехоламиновой вазоконстрикции. Легочные вазодилататоры, которые применялись во время операции, должны постепенно отменяться. Возможен «ребаунд-эффект» в течение этого периода времени.
Заключение
Такие пациенты создают трудную для лечения популяцию с высокой частотой заболеваемости и смертности, особенно на фоне анестезии и операции. Однако с последними улучшениями методов лечения и мониторинга, данная ситуация может измениться к лучшему.
Список литературы
- Kovacs G, Berghold A, Scheidl S, Olschewski H. Pulmonary arterial pressure during rest and exercise in healthy subjects: a systematic review. Eur Respir J 2009; 34:888-894.
- McGoon M, Gutterman D, Steen V, et al. Screening, early detection and diagnosis of pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest 2004; 126:1 4S-34S,
- Galie N, Torbicki A, Barst R, et al. Guidelines on diagnosis and treatment of pulmonary arterial hypertension. The Task Force on Diagnosis and Treatment of Pulmonary Arterial Hypertension of the European Society of Cardiology. Eur Heart J 2004; 25:2243-2278.
- Ramakrishna G, Sprung J, Ravi BS, et al. Impact of pulmonary hypertension on the outcomes of noncardiac surgery: predictors of perioperative morbidity and mortality. J Am Coll Cardiol 2005; 45:1691-1699.
- Simonneau G, Robbins IM, Beghetti M, et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2009; 54 ( 1 Suppl): S43-S54
- Christman BW, McPherson CD, Newman JH, et al. An imbalance between the excretion of thromboxane and prostacyclin metabolites in pulmonary hypertension. N Engl J Med 1992; 327:70-75.
- Langleben D, Dupuis J, Hirsch A, etal. Pulmonary endothelin-1 clearance in human pulmonary arterial hypertension. Chest 2005; 128 (6 suppl ):622S
- Giaid A, Saleh D. Reduced expression of endothelial nitric oxide synthase in the lungs of patients with pulmonary hypertension. N Engl J Med 1995 333:214-221.
- Dorfmuller P, Perros F, Balabanian K, Humbert M. Inflammation in pulmonary arterial hypertension. Eur Respir J 2003; 22:358-363.
- Welsh CH, Hassell KL, Badesch DB, et ai. Coagulation and fibrinolytic profiles in patients with severe pulmonary hypertension. Chest 1996; 110 :710-717.
- Sitbon O, Humbert M, Jais X, et al. Long-term response to calcium channel blockers in idiopathic pulmonary arterial hypertension. Circulation 2005 111:3105-3111.
- Humbert M, Sitbon O, Chaouat A, etal. Pulmonary arterial hypertension in France : results from a national registry. Am J Respir Grit Cam Med 2006 173:1023-1030.
- McLaughlin W, Presberg KW, Doyle RL, et al. Prognosis of pulmonary hypertension: ACCP evidence-based clinical practice guidelines. Chest 2004; 126:78S-92S.
- DAlonzo GE, Barst RJ, Ayres SM, ef al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med 1991; 115 :343-349.
- McLaughlin W, Archer SL, Badesch DB, et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J Am Coll Cardiol 2009; 53 :1573-1619.
- Rich S, Kaufmann E, Levy PS. The effect of high doses of calcium-channel blockers on survival in primary pulmonary hypertension. N Engl J Med 1992 ;327 :76-81.
- McLaughlin VV, Shillington A, Rich S. Survival in primary pulmonary hypertension: the impact of epoprostenol therapy. Circulation 2002; 106: 1477-1482.
- Sitbon O, Humbert M, Nunes H, et al. Long-term intravenous epoprostenol infusion in primary pulmonary hypertension: prognostic factors and survival. J Am Coll Cardiol 2002; 40 :780-788.
- Rubin LJ, Badesch DB, Barst RJ, et al. Bosentan therapy for pulmonary arterial hypertension. N Engl J Med 2002; 346:896-903.
- Galie N, Ghofrani HA, Torbicki A, et al., Sildenafil Use in Pulmonary Arterial Hypertension (SUPER) Study Group. Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med 2005; 353 :2148-2157.
- Hoeper MM, Barbera JA, Channick RN, et al. Diagnosis, assessment, and treatment of nonpulmonary arterial hypertension pulmonary hypertension. J Am Coll Cardiol 2009; 54 (1 Suppl ):S85-S96.
- Stolz D, Rasch H, Linka A, etal. A randomized, controlled trial of bosentan in severe COPD. Eur Respir J 2008; 32 :619-628.
- Blaise G, Langleben D, Hubert B. Pulmonary arterial hypertension: pathophysiology and anesthetic approach. Anesthesiology 2003; 99:1415-1432.
- Zamanian RT, Haddad F, Doyle RL, Weinacker AB. Management strategies for patients with pulmonary hypertension in the intensive care unit. Crit Care Med 2007 ;35 :2037-2050.
- Roberts DH, Lepore JJ, Maroo A, et al. Oxygen therapy improves cardiac index and pulmonary vascular resistance in patients with pulmonary hypertension. Chest 2001; 120 :1547-1555.
- Piazza G, Goldhaber SZ. The acutely decompensated right ventricle: pathways for diagnosis and management. Chest 2005; 128 :1836-1852.
- Vizza CD, Rocca GD, Roma AD, et al. Acute hemodynamic effects of inhaled nitric oxide, dobutamine, and a combination of the two in patients with mild to moderate secondary pulmonary hypertension. Crit Care 2001; 5:355-361.
- Chen EP, Bittner HB, Davis RD Jr, et al. Milrinone improves pulmonary hemodynamics and right ventricular function in chronic pulmonary hypertension. Ann Thorac Surg 1997; 63 ; 814-821
- Khazin V, Kaufman Y, Zabeeda D, et al. Milrinone and nitric oxide: combined effect on pulmonary artery pressures after cardiopulmonary bypass in children. J Cardhthorac Vase Anesth 2004; 18:156-159.
- Holfoway EL, Polumbo RA, Harrison DC . Acute circulafory effects of dopamine in patients with pulmonary hypertension. Br Heart J 1975; 37: 482-485
- Mebazza A, Nieminen MS, Packer M, et al. Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE randomized trial. JAMA 2007; 297: 1883-1891
- Kleber FX, Bollmann T, Borst MM, et al. Repetitive dosing of intravenous levosimendan improves pulmonary hemodynamics in patients with pulmonary hypertension: results of a pilot studY. J Clin Pharmacol 2009; 49: 109-115
- Cavusogtu Y, Beyaztas A, Birdane A, Ata N. Levosimendan is not effective in reducing pulmonary pressures in patients with idiopathic pulmonary arterial hypertension: report of two cases. J Cardiovasc Med ( Hagerstown ) 2009; 10 :503-507.
- Beck JR, Mongero LB, Kroslowitz RM, et al. Inhaled nitric oxide improves hemodynamics in patients with acute pulmonary hypertension after high-risk cardiac surgery. Perfusion 1999; 14 :37-42.
- Pepke-Zaba J, Higenbottam TW, Dinh-Xuan AT, et al. Inhaled nitric oxide as a cause of selective pulmonary vasodilatation in pulmonary hypertension. Lancer 1991; 338 :1173-1174.
- Hache M, Denault AY, Belisle S, et ai Inhaled prostacyclin (PGI2) is an effective addition to the treatment of pulmonary hypertension and hypoxia in the operating room and intensive care unit. Can J Anaesth 2001; 48 :924-929.
- De Wet CJ, Affleck DG, Jacobsohn E, et al. Inhaled prostacyclin is safe, effective, and affordable in patients with pulmonary hypertension, right heart dysfunction, and refractory hypoxemia after cardiothoracic surgery. J Thorac Cardiovasc Surg 2004; 127 :1058-1067.
- Schroeder RA, Wood GL, Plotkin JS, Kuo PC. Intraoperative use of inhaled PGI 2 for acute pulmonary hypertension and right ventricular failure. Anesth Analg 2000; 91 :291-295.
- Haraldsson A, Kieler-Jensen N, Nathorst-Westfeit U, ef al. Comparison of inhaled nitric oxide and inhaled aerosolized prostacyclin in the evaluation of heart transplant candidates with elevated pulmonary vascular resistance. Chest 1998; 114 :780-786.
- Wang H, Gong M, Zhou B, Dai A. Comparison of inhaled and intravenous milrinone in patients with pulmonary hypertension undergoing mitral valve surgery. Adv Ther 2009; 26 :462-468.
- Haraldsson SA, Kieler-Jensen N, Ricksten SE. The additive pulmonary vasodilatory effects of inhaled prostacyclin and inhaled milrinone in postcardiac surgical patients with pulmonary hypertension. Anesth Analg 2001; 93: 1439-1445.
- Kwak YL, Lee CS, Park YH, et al. The effect of phenylephrine and norepinephrine in patients with chronic pulmonary hypertension. Anaesthesia 2002; 57 :9-14.
- Smith AM. Elliot CM, Kiely DG, Channer KS. The role of vasopressin in cardiorespiratory arrest and pulmonary hypertension, QJM 2006; 99 :127-133.
- Price LC, Forrest P, Sodhi V, et al. Use of vasopressin after caesarean section in idiopathic pulmonary arterial hypertension. Br J Anaesth 2007; 98 :652-555.
- Braun ЕВ , Ра lin CA, Hague CW. Vasopressin during spinal anesthesia in a patient with primary pulmonary hypertension treated with intravenous epoprostenol. Anesth Analg 2004; 99 :36-37.
- Keogh AM, Mayer E, Benza RL, ef al. I nterventional and surgical modalities of treatment in pulmonary hypertension. J Am Coll Cardiol 2009; 54 (1 SuppI ):S67-S77.
- Boeken U, Feindt P, Litmathe J, et al. (ntraaortic balloon pumping in patients with right ventricular insufficiency after cardiac surgery: parameters to predict failure of IABP support. Thorac Cardiovasc Surg 2009; 57 :324-328.
- Nordhaug D t Steensrud T, Muller S, ef al. Intraaortic balloon pumping improves hemodynamics and right ventricular efficiency in acute ischemic right ventricular failure. Ann Thorac Surg 2004; 78 :1426-1432.
- Wood P. The Eisenmenger syndrome. BMJ 1958; 2: 701-709.
- Galie N, Beghetti M, Gatzbulis MA, et al. Bosentan therapy in patients with Eisenmenger syndrome: a muliicenter, double-blind, randomized, placebo-controlled study. Circulation 2006; 114 :48-54.
- Chau EM, Fan KY, Chow WH. Effects of chronic sildenafil in patients with Eisenmenger syndrome versus idiopathic pulmonary arterial hypertension, Int J Cardiol 2007; 120 :301 -305.
- Fernandes SM, NewburgerJW, Lang P, etal. Usefulness of epoprostenol therapy in the severely ill adolescent/adult with Eisenmenger physiology. Am J Cardiol 2003; 91 :632-635.

