Гидроксиэтилкрахмал 130/0,4 способствует
более быстрому и выраженному повышению
PO2 в тканях при острой
нормоволемической
гемодилюции у здоровых добровольцев,
чем
гидроксиэтилкрахмал 70/0,5 и
гидроксиэтилкрахмал 200/0,5
Статья опубликована в журнале ANESTH ANALG 2003; 96: 936-43.
Гемодилюция при инфузии гидроксиэтилкрахмала (ГЭК) приводит к стабилизации гемодинамики и улучшению реологических свойств крови; эти эффекты имеют важное клиническое значение. Клинически улучшение реологических свойств крови проявляется повышением PO2 в тканях. В этом проспективном рандомизированном двойном слепом перекрестном исследовании мы изучили влияние острой нормоволемической гемодилюции на гемодинамические показатели и PO2 в скелетных мышцах при инфузии ГЭК 130/0,4 и обычно применяемых растворов ГЭК. В исследовании участвовали 12 здоровых добровольцев, случайным образом разделенных на группы. С интервалом в 8 суток у участников производили забор крови в количестве 18% расчетного ОЦК в течение 30 минут и затем вводили им 6% раствор ГЭК 130/0,4, ГЭК 70/0,5 или ГЭК 200/0,5 (перекрестный дизайн исследования) в соотношении по объему 1:1,2. В течение 6 ч после инфузии у них оценивали гемодинамические показатели, PO2 в четырехглавой мышце бедра, гематокрит, уровень ГЭК в плазме, вязкость плазмы, онкотическое давление плазмы и агрегация тромбоцитов. Показатели гемодинамики, гематокрит и агрегация тромбоцитов между группами не различались. При инфузии ГЭК 200/0,5 онкотическое давление и вязкость плазмы были выше, чем при инфузии ГЭК 70/0,5 (P < 0,05). ГЭК 130/0,4 вызывал самое быстрое и выраженное повышение PO2 в мышцах по сравнению с исходным: при его инфузии PO2 повышалось на 93% через 30 мин, при инфузии ГЭК 70/0,5 — на 33% через 90 мин, а при инфузии ГЭК 200/0,5 — на 40% через 150 мин; P < 0,05. Итак, исследование показало, что новый препарат гидроксиэтилкрахмала — ГЭК 130/0,4 — способствует более быстрому и выраженному повышению PO2 в тканях при острой нормоволемической гемодилюции у здоровых добровольцев, чем гидроксиэтилкрахмал 70/0,5 и гидроксиэтилкрахмал 200/0,5. (Anesth Analg 2003;96:936 –43)
Препараты гидроксиэтилкрахмала — это коллоидные растворы, применяемые в повседневной практике для возмещения ОЦК, например при кровотечении, а также для острой нормоволемической гемодилюции; они уменьшают потребность в переливании компонентов и препаратов крови (1), улучшают реологические свойства крови, снижая ее вязкость, и снижают тонус сосудов (2, 3). В норме улучшение реологических свойств крови приводит к повышению PO2 в тканях; это повышение можно измерить с помощью поверхностных или полярографических игольчатых электродов (4). Измерение PO2 в мышцах позволяет достоверно судить о снабжении тканей кислородом (5—8). Повышение PO2 способствует лучшему заживлению ран и снижению частоты инфекционных осложнений, наблюдаемых после операций на ободочной кишке (9).
Препараты ГЭК различаются по средней молекулярной массе, концентрации раствора, степени и схеме замещения (то есть по количеству и положению гидроксиэтильных радикалов на молекулах глюкозы). Гидроксиэтильные радикалы, особенно в положении C2 молекулы глюкозы, препятствует разрушению полимера под действием амилазы, увеличивая тем самым T1/2 ГЭК.
В ранее проведенных исследованиях было показано, что влияние различных препаратов ГЭК на микроциркуляцию и оксигенацию тканей зависит от вышеприведенных характеристик. В клиническом испытании, в котором участвовали больные в тяжелом состоянии, находящиеся в реанимационном отделении, введение всего лишь 500 мл ГЭК 70/0,5 приводило к повышению PO2 в скелетных мышцах, в то время как при инфузии ГЭК 200/0,5 этот показатель не менялся, а при инфузии ГЭК 450/0,5 — даже ухудшался (12). Новый препарат, ГЭК 130/0,4, отличается от уже применяемых молекулярной массой (его молекулярная масса — 130, а других препаратов — 70, 200, 450 и 470), степенью замещения (0,4, а не 0,5—0,7) и схемой замещения (отношение числа гидроксиэтильных радикалов в положениях C2 и C6 — 9:1, а у других препаратов ГЭК — 4—5:1). Эти отличия определяют размер молекулы in vivo (то есть после попадания в кровоток), от которого, в свою очередь, зависит характер влияния на реологические свойства крови и оксигенацию тканей.
В настоящем проспективном рандомизированном двойном слепом перекрестном исследовании мы сравнили влияние характеристик молекулы различных препаратов ГЭК (130/0,4; 70/0,5 и 200/0,5) на гемодинамику, реологические свойства крови и оксигенацию тканей у добровольцев при острой нормоволемической гемодилюции.
Методы
После одобрения протокола местной этической комиссией 12 здоровых добровольцев подписали информированное согласие и были включены в исследование. Демографические данные участников представлены в Таблице 1. Ни у кого из участников не было аллергических реакций в анамнезе, анемии (определяемой как уровень гемоглобина менее 12 г% у женщин и менее 14 г% у мужчин), артериальной гипотонии, ортостатических нарушений и каких-либо нарушений свертывания. В течение 3 месяцев до исследования никому из них не проводилась инфузия ГЭК или других коллоидных растворов. Добровольцы не должны были принимать препараты, влияющие на свертывающую систему (например, аспирин и гепарин) в течение 4 суток перед экспериментом. Не разрешалось курить в день эксперимента и за 12 ч до него. Кроме того, в число критериев исключения вошли беременность, электролитные нарушения и заболевания почек.
Утром в день эксперимента участников провожали в смотровую, которую организовали в реанимационном отделении нашего отдела, где их взвешивали. Всем добровольцам проводили неинвазивный мониторинг АД, мониторинг ЭКГ в 6 отведениях с системой оповещения об изменениях сегмента ST, мониторинг частоты дыхания и пульс-оксиметрия. Все данные записывались с помощью подключенной к мониторам системы электронной обработки данных. Температура ядра тела контролировалась с помощью ушного термистора и поддерживалась на постоянном уровне с помощью согревающих одеял; с этой же целью температура воздуха в помещении поддерживалась на уровне 24°C (посредством кондиционирования с закрытым контуром). Кроме того, постоянно регистрировалась температура кожи в месте измерения PO2, и при определении этого показателя учитывалась поправка на температуру. В течение всех 8 часов, которые продолжался эксперимент, участники лежали на спине с головным концом кровати, приподнятым на 25°, и дышали комнатным воздухом.
ОЦК рассчитывался как 8% от фактической массы тела участника. Всех участников распределили на 3 группы с помощью специальной программы компьютерной рандомизации (перекрестный дизайн исследования), которая гарантировала, что каждому участнику будут введены все три препарата с интервалом не менее 8 дней, чтобы предотвратить эффект наложения. Ни сами участники, ни исследователи не знали, какой препарат на данном этапе вводится каждому участнику; все препараты находились в одинаковых стерильных пакетах для инфузии. Изучались следующие препараты: 6% раствор ГЭК 130/0,4 (Волювен, Фрезениус Каби, Бад Хомбург, Германия), 6% раствор ГЭК 70/0,5 (Реохес, Б. Браун, Мельзунген, Германия) и 6% раствор ГЭК 200/0,5 (ХАЕС-стерил, Фрезениус Каби).
Прежде чем начать измерение исходных показателей (M0), каждому из добровольцев под местной анестезией ввели в вены обоих предплечий катетеры большого диаметра (2 мм). Катетер в левом предплечье использовался для забора крови, а в правом предплечье — для введения ГЭК. В течение 30 минут у каждого участника забирали объем крови, равный 18% его (ее) расчетного ОЦК, в стерильный пакет для донорской крови (CPD-A1, Зарштедт, Германия). Одновременно через катетер в другой руке вводили раствор ГЭК в объеме, в 1,2 раза превышающем объем взятой порции крови. Через 30 минут после окончания инфузии было проведено повторное измерение всех параметров (M1). В дальнейшем все параметры оценивались с интервалом в 60 минут вплоть до 6 часов после завершения инфузии (M2—M7).
По окончании последнего измерения участникам переливали обратно взятую у них кровь, а через час после стабилизации всех основных физиологических показателей их отпускали домой. Во все периоды (M0—M7) проводилось измерение ЧСС, систолического, диастолического и среднего АД, SaO2, гематокрита, онкотического давления плазмы, вязкости плазмы и PO2 в четырехглавой мышце бедра.
Таблица 1.
Демографические характеристики и объем забора крови и инфузии ГЭК*
| Возраст, годы | 25,7 ± 2 |
| Рост, см | 174 ± 7 |
| Вес, кг | 67,3 ± 10 |
| Пол (м/ж) | 6/6 |
| Расчетный ОЦК, мл | 5370 ± 850 |
| Объем забора крови, мл | 960 ± 305 |
| Объем инфузии ГЭК, мл | 1161 ± 183 |
* Число участников — 12, результаты представлены в виде среднего ± стандартное отклонение.
Гематокрит определялся после 5-минутного центрифугирования венозной крови (5000 оборотов в минуту) с использованием шкалы объемных процентов. Вязкость плазмы определялась после центрифугирования с помощью вискозиметра (Реомат, Фрезениус Каби), а онкотическое давление плазмы измерялось с помощью онкометра (BMT 851, Томе, Германия) Измерение PO2 проводилось на латеральной широкой мышце бедра (часть четырехглавой мышцы бедра) с помощью быстрореагирующего контролируемого микропроцессором полярографического игольчатого электрода диаметром 12,5 мкм (Eppendorf needle ®, Хельцель Медикал Системс, Кальтенкирхен, Германия). После инфильтрации кожи и подкожной клетчатки 5 мл 0,5% раствора бупивакаина электрод вводился в мышцу на глубину 2 см; с его помощью можно получить 200 измерений PO2 за 5 минут в коническом участке мышцы объемом 2—3 см3. После каждых 20 измерений электрод автоматически перемещался на 0,7 мм вперед, а затем — на 0,3 мм назад в пределах соответствующего участка мышцы, чтобы избежать компрессии мышечных волокон. После 200 измерений электрод извлекали из ноги, калибровали и вводили в другой участок мышцы для следующей серии измерений; каждому добровольцу электрод вводили 8 раз в день. Таким образом, в каждый период получали 2400 измерений PO2 (по 200 измерений у 12 участников). По окончании экспериментальной части исследования было проанализировано частотное распределение величин PO2 во всех 2400 измерениях, выраженное в виде гистограммы, и вычислены 10-й, 50-й и 90-й процентили PO2 (Sigma-PO2-Histograph KIMOC 6650 ® , Хельцель Медикал Системс).
В периоды M0, M1, M3 и M6 проводился забор венозной крови для определения концентрации ГЭК в плазме (лаборатория Фрезениус Каби) и агрегации тромбоцитов с использованием стандартизованных диагностических наборов с концентрацией ристоцетина 0,63 мкг/мл и 1,25 мкг/мл и концентрацией коллагена 2 мкг/мл (агрегометр — Blood Lumi-Aggregometer ®, Хроно-Лог, Хейвертаун, шт. Филадельфия). Определение агрегации тромбоцитов в цельной крови основано на измерении импеданса после стимуляции тромбоцитов ристоцетином и коллагеном (13). Для определения концентрации ГЭК в пробирку с литием и гепарином (Зарштедт) забирали 10 мл венозной крови, немедленно центрифугировали и хранили при температуре –30°C до анализа. ГЭК осаждался с использованием ацетона и подвергался гидролизу трифторуксусной кислотой для определения глюкозы ферментными методами с последующим вычислением количества ГЭК.
Добровольцев распределяли на группы с помощью компьютерной программы рандомизации. Данные измерений представлялись в виде среднего ± стандартное отклонение, за исключением особо оговоренных случаев. Для показателей с нормальным распределением различия между группами анализировались по вариации результатов повторных измерений с последующим сравнением путем вычисления парного критерия Стьюдента. Различия между группами оценивались путем вычисления вариации с последующим сравнением с помощью непарного критерия Стьюдента с поправкой Бонферрони для уровня значимости a. Были вычислены среднее арифметическое и стандартное отклонение в каждой группе для 10-го, 50-го и 90-го процентилей значений PO2 по результатам 200 измерений у каждого добровольца. Полученные данные сравнили между собой и с исходными данными с помощью двустороннего парного критерия Стьюдента. Кроме того, для анализа общей разницы между 10-м 50-м и 90-м процентилями всех групп использовали тест Фридмана для множественных парных данных. Все различия были признаны статистически значимыми (P < 0,05).
Поскольку мы не ожидали существенных различий в абсолютных величинах PO2 между группами, мы проверяли гипотезу, что среднее значение для 10-го процентиля через 3 часа гемодилюции значительно повысится во всех группах. Основываясь на данных недавних исследований, мы предположили, что исходный показатель составит примерно 20 ± 10 мм рт. ст. и повысится на 15 мм рт. ст. во всех группах, а различие между группами окажется не более 15 мм рт. ст. Мы допускали ошибку I типа a = 0,05, в то время как другие гипотезы признавались нулевыми при ошибке II типа b = 0,1. Мощность этого анализа достигает 0,9, что показывает, что необходимо увеличить размер каждой группы по крайней мере до 11 участников. Чтобы компенсировать недостаток данных и возможное выбывание из исследования, мы установили размер группы в 12 добровольцев.
Результаты
Ни у одного из 12 участников не наблюдалось осложнений, связанных с процедурой гемодилюции либо с реакцией на какой-либо из препаратов ГЭК. Средний объем забора крови и инфузии растворов ГЭК представлены в Таблице 1. Между группами не было выявлено различий уровней гематокрита, параметров гемодинамики и агрегации тромбоцитов (Таблицы 2-4 и 5 ).
Таблицы 2-4.
Гематокрит, параметры гемодинамики, SaO2
(по данным пульс-оксиметрии) и
температура кожи в месте измерения PO2
| ГЭК 70/0,5 | |||||
| САД, мм рт. ст. | ЧСС, мин–1 | SaO2, % | T, °C | ||
| M0 | 41,4 ± 2,2 | 86 ± 8 | 70 ± 15 | 98 ± 1 | 32,0 ± 1,3 |
| M1 | 31,8 ± 3,2 | 80 ± 10 | 67 ± 13 | 98 ± 2 | 31,8 ± 1,8 |
| M2 | 33,3 ± 3,1 | 80 ± 9 | 68 ± 11 | 98 ± 2 | 31,7 ± 1,5 |
| M3 | 34,0 ± 3,1 | 80 ± 6 | 68 ± 11 | 97 ± 3 | 33,1 ± 0,7 |
| M4 | 34,1 ± 2,3 | 81 ± 8 | 71 ± 13 | 98 ± 1 | 33,2 ± 1,1 |
| M5 | 34,5 ± 2,6 | 77 ± 8 | 69 ± 12 | 98 ± 1 | 33,4 ± 0,8 |
| M6 | 34,7 ± 2,9 | 79 ± 8 | 70 ± 13 | 98 ± 1 | 33,5 ± 0,7 |
| M7 | 34,9 ± 2,6 | 80 ± 7 | 69 ± 10 | 98 ± 1 | 32,0 ± 1,3 |
Данные представлены в виде среднего ± стандартное отклонение. Ht — гематокрит, САД— среднее АД, T — температура кожи в месте измерения PO2.
| ГЭК 130/0,4 | |||||
| Ht, об.% | САД, мм рт. ст. | ЧСС, мин–1 | SaO2, % | T, °C | |
| M0 | 41,8 ± 3,5 | 86 ± 8 | 75 ± 13 | 97 ± 2 | 32,9 ± 1,0 |
| M1 | 31,4 ± 2,9 | 84 ± 12 | 67 ± 11 | 99 ± 1 | 33,5 ± 0,9 |
| M2 | 32,9 ± 3,0 | 82 ± 10 | 68 ± 12 | 98 ± 1 | 33,8 ± 1,0 |
| M3 | 33,2 ± 2,8 | 80 ± 8 | 71 ± 14 | 98 ± 2 | 33,6 ± 0,7 |
| M4 | 33,4 ± 2,5 | 80 ± 9 | 70 ± 13 | 98 ± 1 | 33,6 ± 1,0 |
| M5 | 34,4 ± 3,2 | 81 ± 8 | 71 ± 13 | 98 ± 1 | 33,3 ± 0,9 |
| M6 | 33,8 ± 2,8 | 79 ± 9 | 70 ± 13 | 98 ± 1 | 33,4 ± 0,6 |
| M7 | 34,1 ± 3,3 | 81 ± 9 | 72 ± 10 | 98 ± 1 | 33,5 ± 1,1 |
Данные представлены в виде среднего ± стандартное отклонение. Ht — гематокрит, САД— среднее АД, T — температура кожи в месте измерения PO2.
| ГЭК 200/0,5 | |||||
| Ht, об.% | САД, мм рт. ст. | ЧСС, мин–1 | SaO2, % | T, °C | |
| M0 | 40,3 ± 3,8 | 85 ± 11 | 74 ± 14 | 97 ± 1 | 33,6 ± 1,1 |
| M1 | 31,3 ± 3,1 | 83 ± 7 | 72 ± 11 | 98 ± 1 | 33,8 ± 0,7 |
| M2 | 32,4 ± 3,4 | 82 ± 7 | 71 ± 13 | 98 ± 1 | 33,1 ± 1,4 |
| M3 | 33,2 ± 2,7 | 80 ± 9 | 70 ± 13 | 98 ± 1 | 34,0 ± 1,1 |
| M4 | 33,4 ± 3,0 | 80 ± 9 | 72 ± 12 | 97 ± 2 | 33,9 ± 0,9 |
| M5 | 33,9 ±3,4 | 81 ± 12 | 73 ± 13 | 98 ± 1 | 33,3 ± 1,3 |
| M6 | 33,8 ± 3,8 | 80 ± 7 | 72 ± 13 | 98 ± 2 | 33,9 ± 1,1 |
| M7 | 34,0 ± 3,7 | 79 ± 15 | 76 ± 14 98 | 98 ± 2 | 33,6± 0,7 |
Данные представлены в виде среднего ± стандартное отклонение. Ht — гематокрит, САД— среднее АД, T — температура кожи в месте измерения PO2.
Таблица 5.
Агрегация тромбоцитов
| ГЭК 70/0,5 | ГЭК 130/0,4 | ГЭК 200/0,5 | |||||
| Среднее | σ | Среднее | σ | Среднее | σ | ||
| M0 | Коллаген 2,0 мкг/мл | 14,90 | 3,10 | 14,90 | 3,2 | 13,92 | 3,2 |
| Ристоцетин 0,63 мкг/мл | 11,30 | 4,20 | 11,25 | 3,3 | 11,50 | 3,3 | |
| Ристоцетин 1,25 мкг/мл | 11,00 | 3,20 | 9,30 | 3,9 | 9,17 | 4,2 | |
| M1 | Коллаген 2,0 мкг/мл | 14,10 | 3,80 | 13,70 | 3,1 | 13,08 | 3,6 |
| Ристоцетин 0,63 мкг/мл | 9,70 | 4,10 | 11,40 | 3,5 | 10,83 | 3,4 | |
| Ристоцетин 1,25 мкг/мл | 8,17 | 3,70 | 8,40 | 2,6 | 8,55 | 2,1 | |
| M3 | Коллаген 2,0 мкг/мл | 15,64 | 3,10 | 15,40 | 2,8 | 14,08 | 3,2 |
| Ристоцетин 0,63 мкг/мл | 10,45 | 2,50 | 12,60 | 3,5 | 11,00 | 3,7 | |
| Ристоцетин 1,25 мкг/мл | 8,42 | 4,60 | 8,30 | 5 | 5,92 | 4,5 | |
| M6 | Коллаген 2,0 мкг/мл | 16,33 | 2,40 | 14,80 | 3,5 | 15,75 | 2,7 |
| Ристоцетин 0,63 мкг/мл | 12,00 | 2,80 | 12,00 | 3,7 | 10,60 | 3,8 | |
| Ристоцетин 1,25 мкг/мл | 9,58 | 3,80 | 8,40 | 3,6 | 5,50 | 5,7 | |
| Единица измерения — Ом | |||||||
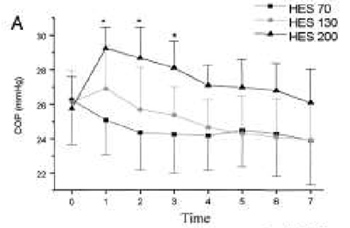
При инфузии ГЭК 200/0,5 наблюдались наибольшие показатели вязкости и онкотического давления плазмы в периоды M1—M3, значительно превышающие аналогичные показатели для ГЭК 70/0,5 (P < 0,05, рис. 1, А и Б). В противоположность этому, динамика концентрации ГЭК в плазме между группами почти не различалась (рис. 2).
Острая нормоволемическая гемодилюция сопровождалась повышением PO2 во всех группах; это видно по смещению совокупных гистограмм PO2 вправо, в сторону более высоких величин (рис. 3). Однако при инфузии ГЭК 130/0,4 достигалось наибольшее повышение PO2 по сравнению с исходным уровнем. Это подтверждает общее отличие группы ГЭК 130/0,4 от других групп; при проведении теста Фридмана различия оказались статистически значимыми и для 10-го (P = 0,004), и для 50-го (P =0,000), и для 90-го процентиля (P = 0,010). В противоположность этому, при инфузии ГЭК 70/0,5 и 200/0,5 не было выявлено статистически значимых общих различий. При инфузии ГЭК 70/0,5 для 10-го процентиля величина P составила 0,265, для 50-го — 0,505 и для 90-го — 0,571; при инфузии ГЭК 200/0,5 эти цифры были соответственно 0,117; 0,068 и 0,049. Повышение 10-го процентиля PO2, представляющего собой нижнюю границу нормы для оксигенации тканей, относительно исходного уровня было наиболее заметным и быстрым в группе ГЭК 130/0,4 (рис. 4). Наибольший показатель был на 93% выше исходного (M4) при инфузии ГЭК 130/0,4, на 33% выше исходного при инфузии ГЭК 70/0,5 (M6) и на 40% выше исходного при инфузии ГЭК 200/0,5 (M7) (P < 0,05). При инфузии ГЭК 130/0,4 максимальное относительное повышение 50-го процентиля составило 45% (M4), а 90-го — 32% (M6), то есть тоже было более выраженным и ранним, чем при инфузии ГЭК 70/0,5 (50-й процентиль — +20% [M7], 90-й процентиль — +13% [M7]) и ГЭК 200/0,5 (50-й процентиль — +23% [M7] и 90-й — +21% [M4]), однако эти отличия были статистически незначимыми.
Обсуждение результатов
Это проспективное рандомизированное двойное слепое перекрестное исследование показало, что новый препарат гидроксиэтилкрахмала, ГЭК 130/0,4, при острой изоволемической гемодилюции у здоровых добровольцев оказывает на гемодинамику, число эритроцитов и агрегацию тромбоцитов примерно такое же влияние, как и уже используемые препараты, ГЭК 70/0,5 и ГЭК 200/0,5. Все три препарата ГЭК улучшают оксигенацию тканей; об этом свидетельствует значительное абсолютное повышение PO2 в скелетных мышцах. Однако было обнаружено, что ГЭК 130/0,5 превосходит другие препараты ГЭК по скорости развития этого эффекта и степени повышения PO2. При инфузии ГЭК 130/0,4 наблюдалось более раннее и выраженное относительное повышение PO2 по сравнению с исходным уровнем, чем при инфузии ГЭК 70/0,5 и ГЭК 200/0,5, особенно при сравнении небольших величин PO2 (10-й процентиль).
ГЭК 130/0,4 сопоставим по гемодинамической эффективности с ГЭК 200/0,5 при восполнении ОЦК во время кардиохирургических операций и обширных операций на органах брюшной полости (14—16). Нарушения свертывания при использовании ГЭК 130/0,4 были не столь выраженными, как при использовании препаратов ГЭК с большей молекулярной массой или степенью замещения (14, 17, 18). В противоположность уже имеющимся данным, в нашем исследовании мы не выявили различий во влиянии исследуемых препаратов ГЭК на агрегацию тромбоцитов. Однако мы вводили эти препараты здоровым добровольцам, у которых не было операционной кровопотери, а объем инфузии препаратов ГЭК (примерно 1,2 л) был меньше, чем в упомянутых клинических и лабораторных исследованиях. Следовательно, в случаях, когда доза
ГЭК не превышает 2 г/кг (33 мл/кг 6% раствора), что примерно соответствует рекомендуемому в клинической практике объему инфузии 2 л/сут, можно не опасаться значительных нарушений свертывания.
Однако наши результаты показывают, что динамика PO2 при инфузии различных препаратов ГЭК в значительной мере зависит от их характеристик — молекулярной массы, степени и схемы замещения, — определяющих их клиническое действие, в том числе влияние на микроциркуляцию и оксигенацию тканей. Эти данные совпадают с данными более ранних исследований, проводимых у больных в тяжелом состоянии, когда только ГЭК 70/0,5 обеспечивал значительное повышение PO2 в течение 90 минут от начала инфузии, а при применении ГЭК 200 и ГЭК 450 такого эффекта не наблюдалось (12). В этом исследовании ГЭК 450 не только не увеличивал, но даже снижал PO2; кроме того, он чаще всего вызывал нарушения свертывания, оседал в клетках ретикулоэндотелиальной системы и других тканей (19), поэтому мы выбрали для сравнения с ГЭК 130/0,4 только ГЭК 70/0,5 и ГЭК 200/0,5. Разработчики ГЭК 130/0,4 преследовали цель улучшить внутрисосудистое распределение препарата. Низкая степень замещения (0,4) могла бы ускорить деградацию препарата; чтобы воспрепятствовать этому и предотвратить слишком быстрое снижение концентрации препарата в плазме, было увеличено соотношение количества гидроксиэтильных радикалов в положениях С2 и C6 до 9:1 вместо 4:1. В результате были достигнуты уменьшение накопления в тканях и отсутствие кумуляции в плазме при многократной инфузии (11, 20) при сохранении влияния на ОЦК (14, 15, 18).
Кроме того, разброс молекулярной массы у ГЭК 130/0,4 невелик; это достигается за счет уменьшения фракций с высокой и низкой молекулярной массой. Размер большинства молекул превышает почечный порог для фильтрации. Особенности технологического процесса направлены на то, чтобы увеличить фракцию со средней молекулярной массой. Поскольку дозы ГЭК и концентрация ГЭК в плазме в нашем исследовании различались мало, разницу в величине PO2 нельзя объяснить только присутствием в плазме того или иного препарата ГЭК в определенной концентрации. Одно из возможных объяснений более раннего и выраженного повышения PO2 при инфузии ГЭК 130/0,4 может заключаться в том, что оптимальная масса молекул ГЭК, способствующая улучшению реологических свойств крови и оксигенации тканей, возможно, лежит между 60 000 и 130 000, а инфузия ГЭК 130/0,4 приводит к поступлению в кровоток в первые часы большего количества молекул такой массы, чем инфузия других препаратов ГЭК. То есть ГЭК имеет оптимальную молекулярную массу in vivo, что обеспечивает быстрое повышение PO2. В противоположность этому, при инфузии ГЭК 70/0,5 молекулы с массой менее 60 000 фильтруются почками в течение 30 мин. Об этом свидетельствует более низкая концентрация ГЭК в плазме больных из группы ГЭК 70/0,5 в первые часы после инфузии. ГЭК 200/0,5 для того, чтобы достичь оптимального реологического эффекта, должен распасться в кровотоке на более мелкие молекулы, а на это уходит несколько часов. Сразу после инфузии концентрация ГЭК 130/0,4 в плазме примерно такая же, как ГЭК 200/0,5; через 2 ч после инфузии она лежит посредине между концентрациями ГЭК 200/0,5 и ГЭК 70/0,5, а через 6 ч после инфузии становится примерно такой же, как ГЭК 70/0,5. Следовательно, ГЭК 130/0,4 обеспечивает оптимальное сочетание способности быстро улучшать реологические свойства крови и повышать PO2—c одной стороны и достаточно быстрой деградации и элиминации с мочой (T1/2a = 1,4 ч, T1/2b = 12 ч), позволяющих предотвратить длительную циркуляцию препарата в плазме и его накопление в тканях — с другой (21).
 |
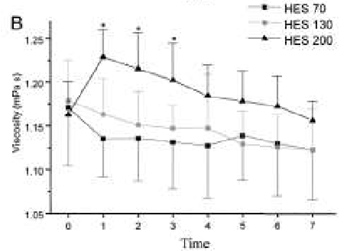 |
| Рисунок 1. Онкотическое давление плазмы (А) и вязкость плазмы (B) до и после острой нормоволемической гемодилюции растворами ГЭК 70/0,5, ГЭК 130/0,4 и ГЭК 200/0,5. P < 0,05 (при сравнении с ГЭК 70/0,5). |
|
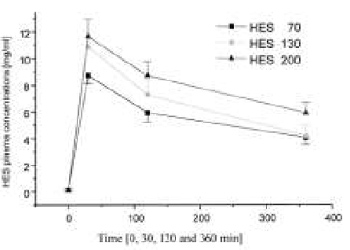 |
| Рисунок 2. Концентрация ГЭК в плазме до и после острой нормоволемической гемодилюции растворами ГЭК 70/0,5, 130/0,4 и 200/0,5. |
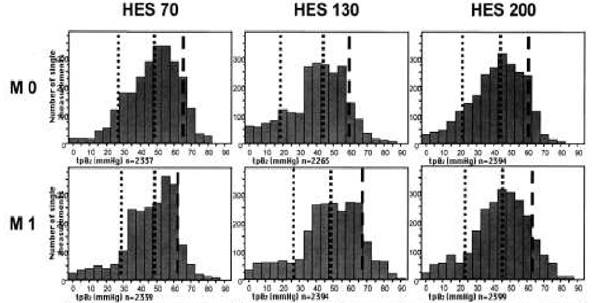 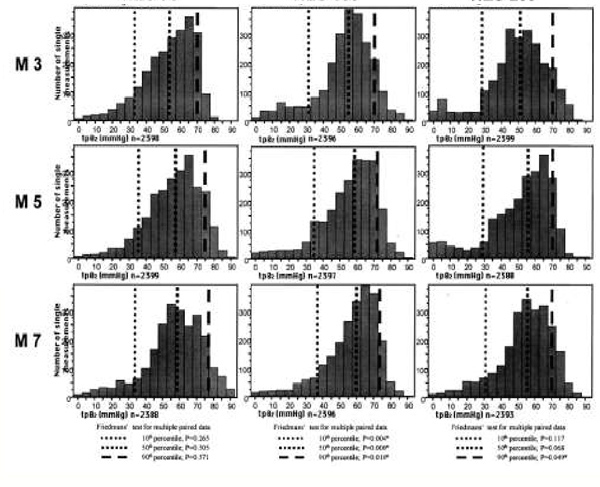 |
| Рисунок 3. Совокупные гистограммы PO2 в скелетных мышцах до и после острой нормоволемической гемодилюции (M1—M7) растворами ГЭК 70/0,5, 130/0,4 и 200/0,5. Пунктирные линии соответствуют 10-му, 50-му и 90-му процентилям, n обозначает общее число измерений. Различия 10-го, 50-го и 90-го процентиля между группами оценивались с помощью теста Фридмана для множественных парных данных (*P<0,05). |
В одном исследовании было показано также улучшение оксигенации дельтовидной мышцы у больных, получавших ГЭК 130/0,4 для восполнения ОЦК во время обширных операций на брюшной полости (22). Инфузия эквивалентного объема раствора Рингера с лактатом, напротив, приводила к снижению PO2 в мышце на срок до 24 часов. В этом исследовании применялись гибкие полярографические датчики, которые вводились в мышцу и оставались в одном и том же месте на протяжении всего времени, пока проводилось измерение PO2. В отличие от авторов этого исследования, мы заново вводили датчик каждый раз, когда нужно было измерить PO2, и датчик слегка смещался в толще мышцы после каждых 20 из серии в 200 измерений, что обеспечивало большее число результатов PO2 и позволяло точнее судить о PO2 в разных участках соответствующей мышцы. Хотя оксигенация скелетных мышц, казалось бы, не столь важна, как оксигенация жизненно важных органов, эти мышцы в весовом отношении составляют значительную часть тканей человека, они легко доступны для исследования и поэтому могут использоваться для измерения PO2 у больных (6, 7, 22). В опытных руках измерение PO2 в мышце характеризуется высокой воспроизводимостью и вполне подходит для определения тенденций к снижению или повышению напряжения кислорода в тканях, а следовательно — к улучшению или ухудшению их оксигенации. Однако по величине PO2 в мышце нельзя судить об оксигенации организма в целом или отдельных органов, хотя в экспериментах на животных и показана корреляция между PO2 в мышцах и печени во время острой нормоволемической гемодилюции (23).
В условиях нашего исследования на добровольцах мы не могли сделать каких-либо выводов о различиях ударного объема и сердечного выброса при острой нормоволемической гемодилюции тремя разными растворами ГЭК, поскольку сочли себя не вправе проводить инвазивный мониторинг гемодинамики у этих здоровых молодых людей. Однако клинические исследования во время кардиохирургических операций не обнаружили различий диастолического давления в желудочках и сердечного индекса у больных, получавших инфузию ГЭК 130/0,4 и ГЭК 200/0,5 (14, 15).
Кто-то мог бы сказать, что раствор ГЭК 200/0,5 имеет более высокое онкотическое давление и поэтому удерживает воду в сосудистом русле, что может привести к более выраженной гемодилюции и улучшению реологических свойств крови. Однако гематокрит в группе ГЭК 200/0,5 был не ниже, чем в группах ГЭК 130/0,4 и ГЭК 70/0,5, следовательно, существенные различия вязкости плазмы маловероятны. При инфузии ГЭК 200/0,5, в отличие от ГЭК 70/0,5 и ГЭК 130/0,4, вязкость плазмы повышалась, что, вероятно, сводило на нет незначительные преимущества ГЭК 200/0,5 в плане улучшения реологических свойств крови и оксигенации тканей.
В заключение следует сказать, что настоящее исследование острой нормоволемической гемодилюции у здоровых добровольцев показало, что инфузия ГЭК 130/0,4 приводит к более быстрому и выраженному повышению PO2 по сравнению с исходным уровнем, чем инфузия ГЭК 70/0,5 и ГЭК 200/0,5. Этот эффект может объясняться оптимальным размером молекул in vivo, обеспечивающим улучшение реологических свойств крови и оксигенации тканей в первые часы после инфузии.
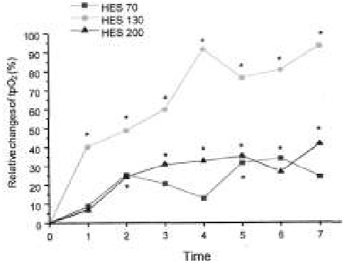 |
| Рисунок 4. Относительные изменения 10-го процентиля PO2 в скелетных мышцах после острой нормоволемической гемодилюции растворами ГЭК 70/0,5, 130/0,4 и 200/0,5. Значительные отличия абсолютных значений от исходного уровня отмечены звездочками. |
Авторы выражают благодарность всем добровольцам за участие в данном исследовании, а также персоналу реанимационного отделения Отдела анестезиологии за помощь в наблюдении за добровольцами. Мы благодарим также доктора Биттнера, О. Бека и доктора Хильдебранда из аналитическо-исследовательского отдела фирмы Фрезениус Каби за то, что они взяли на себя определение концентрации ГЭК в плазме.
Литература
- Freyburger G, Dubreuil M, Boisseau MR, Janvier G. Rheological properties of commonly used plasma substitutes during preopertive normovolaemic acute haemodilution. Br J Anaesth 1996;76:519 –25.
- Doss DN, Estafanous FG, Ferrario CM, et al. Mechanism of systemic vasodilation during normovolemic hemodilution. Anesth Analg 1995;81:30 –4.
- Holbeck S, Grande PO. Effects on capillary fluid permeability and fluid exchange of albumin, dextran, gelatin, and hydroxyethyl starch in cat skeletal muscle. Crit Care Med 2000;28: 1089–95.
- Hauss J, Spiegel HU, Schonleben K, Bunte H. Monitoring of tissue-pO2 for invasive diagnostics in angiology and vascular surgery. Angiology 1987;38:13–21.
- Standl TG, Reeker W, Redmann G, et al. Haemodynamic changes and skeletal muscle oxygen tension during complete blood exchange with ultrapurified polymerized bovine haemoglobin. Intensive Care Med 1997;23:865–72.
- Boekstegers P, Riessen R, Seyde W. Oxygen partial pressure distribution within skeletal muscle: indicator of whole body oxygen delivery in patients? Adv Exp Med Biol 1990;277:507–14.
- Boekstegers P, Weidenhofer S, Kapsner T, Werdan K. Skeletal muscle partial pressure of oxygen in patients with sepsis. Crit Care Med 1994;22:640 –50.
- Freitag M, Standl T, Horn EP, et al. Acute normovolaemic haemodilution beyond a haematocrit of 25%: ratio of skeletal muscle tissue oxygen tension and cardiac index is not maintained in the healthy dog. Eur J Anaesthesiol 2002;19:487–94.
- 9. Greif R, Akca O, Horn EP, et al. Supplemental perioperative oxygen to reduce the incidence of surgical-wound infection: Outcomes Research Group. N Engl J Med 2000;342:161–7.
- Vogt NH, Bothner U, Lerch G, et al. Large-dose administration of 6% hydroxyethyl starch 200/0.5 total hip arthroplasty: plasma homeostasis, hemostasis, and renal function compared to use of 5% human albumin. Anesth Analg 1996;83:262–8.
- Bepperling F, Opitz J, Leuschner J. HES 130/0.4, a new HES specification: tissue storage after multiple infusions in rats. Crit Care 1999;3:S153.
- Schulte am Esch J, Bause HW, Kochs E. Influences of various respiratory and circulatory conditions on muscle tissue oxygenation in critically ill patients. In: Vincent JL, ed. Yearbook of intensive care and emergency medicine. New York:Springer-Verlag, 1992:303–9.
- Ingerman-Wojenski CM, Silver MJ. A quick method for screening platelet dysfunctions using the whole blood lumiaggregometer. Thromb Haemost 1984;51:154 –6.
- Gallandat Huet RC, Siemons AW, Baus D, et al. A novel hydroxyethyl starch (Voluven) for effective perioperative plasma volume substitution in cardiac surgery. Can J Anaesth 2000;47: 1207–15.
- Boldt J, Lehmann A, Rompert R, et al. Volume therapy with a new hydroxyethyl starch solution in cardiac surgical patients before cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2000;14:264 –8.
- Haisch G, Boldt J, Krebs C, et al. The influence of intravascular volume therapy with a new hydroxyethyl starch preparation (6% HES 130/0.4) on coagulation in patients undergoing major abdominal surgery. Anesth Analg 2001;92:565–71.
- Franz A, Braunlich P, Gamsjager T, et al. The effects of hydroxyethyl starches of varying molecular weights on platelet function. Anesth Analg 2001;92:1402–7.
- Langeron O, Doelberg M, Ang ET, et al. Voluven, a lower substituted novel hydroxyethyl starch (HES 130/0.4), causes fewer effects on coagulation in major orthopedic surgery than HES 200/0.5. Anesth Analg 2001;92:855–62.
- Knutson JE, Deering JA, Hall FW, et al. Does intraoperative hetastarch administration increase blood loss and transfusion requirements after cardiac surgery? Anesth Analg 2000;90: 801–7.
- Jung F, Koscielny C, Mrowietz G, et al. Elimination kinetics of different hydroxyethyl starches and effects on blood fluidity. Clin Hemorheol 1994;14:189 –202.
- Waitzinger J, Bepperling F, Pabst G, et al. Pharmacokinetics and tolerability of a new hydroxyethyl starch (HES) specification (HES 130/0.4) after single-dose infusion of 6% or 10% solutions in healthy volunteers. Clin Drug Invest 1998;16:151–60.
- Lang K, Boldt J, Suttner S, Haisch G. Colloids versus crystalloids and tissue oxygen tension in patients undergoing major abdom-inal surgery. Anesth Analg 2001;93:405–9.
- Horn EP, Standl T, Burmeister M, et al. Additional augmentation of liver tissue oxygen tension following hemodilution with bovine hemoglobin. Anesth Analg 2000;90:S427.

