Особенности инфузионной терапии в геронтологической клинике
Статья опубликована в журнале КЛИНИЧЕСКАЯ ГЕРОНТОЛОГИЯ, 2, 2003
Одним из основных звеньев патогенеза многих критических состояний — острой кровопотери, сепсиса, шокового состояния различной этиологии и др. — является гиповолемия, что определяет объемозамещающей (восполнение дефицита объема циркулирующей крови), или инфузионной*, терапии одно из ведущих мест в их лечении [6]. По признанию большинства исследователей и клиницистов «нормальный внутрисосудистый объем — краеугольный камень жизнеобеспечения» [12].
(* Объемозамещение, безусловно, не единственная задача инфузионной терапии, однако применительно к теме данной лекции понятия «инфузионной» и «объемозамещающей» терапии можно считать тождественными.)
Инфузионная терапия у пациентов пожилого возраста имеет ряд существенных особенностей. Во-первых, — тактика ее проведения. Во-вторых, — побочные эффекты препаратов, применяемых для восполнения объема циркулирующей крови.
В отличие от других возрастных категорий больных, лица пожилого возраста более чувствительны к гиповолемии [5]. Это обусловлено, с одной стороны, сопутствующей сосудистой патологией с нарушением кровоснабжения органов и тканей, главным образом миокарда, головного мозга, почек. Нарушение перфузии этих органов как проявление дефицита сосудистого объема у пациентов данной возрастной категории развивается быстрее. С другой стороны, снижение сердечного выброса и нарушение регуляции сосудистого тонуса определяют их большую чувствительность к перегрузке жидкостью или гиперволемии с высоким риском, прежде всего, отека легких [5], т.е. терапевтическая широта применительно к объему инфузионной терапии у больных пожилого возраста меньше, чем в других возрастных группах.
Эти обстоятельства требуют более жесткого контроля у них водного баланса и гемодинамических показателей, расширяют показания к инвазивному контролю гемодинамики [2].
В клинической практике для коррекции гиповолемии применяются инфузионные растворы и трансфузионные среды, которые можно объединить общим термином — объемозамещающие растворы. Последние разделяют на 2 большие группы: кристаллоидные (или солевые) и коллоидные.
Специалисты по инфузиоиной терапии уже более 100 лет продолжают дискуссию о преимуществах того или иного класса объемозамещающих растворов (или «коллоидно-кристаллоидная война», как ее часто именуют в литературе) и рациональном соотношении солевых растворов и коллоидов в терапии критических состояний. Проведено множество исследований, данные которых очень часто противоречивы. Так, например, мета-анализ рандомизированных исследований выявил у пациентов с тяжелой травмой увеличение смертности на 4% при применении коллоидов по сравнению с кристаллоидами [26]. В то же время ряд исследований проде монстрировали прямую зависимость между увеличением объема кристаллоидов в первые 24 ч после травмы и смертностью у пациентов с травмой и геморрагическим шоком [23]. Очевидно, что и коллоидные и кристаллоидные растворы имеют свои положительные и отрицательные свойства и оптимально сочетанное применение в каждом конкретном случае.
В клинической практике применяются 3 типа кристаллоидных растворов, различных по осмолярности: гипотонические (5% раствор декстрозы, или глюкозы), изотонические (0,9% раствор натрия хлорида и раствор Риигера) и гипертонические (7,5% раствор хлорида натрия).
Основным недостатком кристаллоидов является их быстрое, перераспределение из сосудистого русла в межклеточное пространство: 75—80% растворов кристаллоидов через 1—2 ч после инфузии оказывается в интерстиции [19]. В связи со столь непродолжительным волемическим эффектом для поддержания объема циркулирующей крови при изолированном применении кристаллоидов требуется их большой объем. Это чревато риском гиперволемии, развития отечного синдрома, артериальной гипертензии, что особенно опасно у пожилых пациентов [21].
Коллоидные объемозамещающие растворы разделяют на естественные (компоненты и продукты переработки крови), к которым относятся свежезамороженная плазма и альбумин, и синтетические (табл. 1).
Таблица 1.
Классификация синтетических коллоидных объемозамещающих растворов
1. Производные желатина
|
2. Декстраны
|
3. Производные гидроксиэтилированного крахмала
|
Примечание. * Препарат Voluven, формально относясь к средне-молекулярным гидроксиэтилкрахмалам, существенно отличается от них меньшей выраженностью побочных эффектов.
В настоящее время, по мнению большинства специалистов, свежезамороженная плазма и растворы альбумина не являются препаратами выбора по восполнению объема циркулирующей крови [19,22]. Это связано с их высокой стоимостью и главным образом — серьезными осложнениями, характерными для естественных коллоидов. Для свежезамороженной плазмы — это в первую очередь высокий риск переноса гематогенных вирусных инфекций [25]. Например, риск инфицирования гепатитом С при трансфузионной терапии достигает 1 : 5000 трансфузий [24].
Из побочных эффектов альбумина в геронтологической практике наиболее актуальны следующие. Во-первых, для критических состояний пациентов, особенно пожилого возраста, характерна повышенная проницаемость капилляров. При этом условий альбумин значительно быстрее покидает сосудистое русло, увеличивая онкотическое давление во внесосудистом секторе [7], что приводит к развитию отечного синдрома и наиболее опасному его проявлению — отеку легких. По некоторым данным, 30% альбумина после вггутривенного введения распространяется в сосудистом русле и 70% — в межклеточном пространстве [18]. Во вторых, для него характерно прямое отрицательное инотропное действие [17], что может усугубить сердечную недостаточность, частую у пожилых пациентов.
Поэтому в инфузионной терапии в настоящее время в основном применяют синтетические коллоидные растворы [9]. Выделяют три основных типа этих препаратов: производные декстрана, гидроксиэтилированного крахмала и желатина. Декстраны и гидроксиэтилированный крахмал являются по своей структуре полисахаридами. Препараты гидроксиэтилированного крахмала производятся из кукурузы молочно-восковой спелости или картофеля. Декстран — полисахарид, получаемый из культур бактерий-продуцентов. Желатин — полипептид из коллагена крупного рогатого скота.
Классификация производных желатина основана на особенностях технологии производства (дальнейшей обработки полученного животного сырья), По основной характеристике объемозамещающих препаратов — молекулярной массе - производные желатина практически не различаются. Средняя молекулярная масса оксиполижелатина — 30 кДа, мочевиносвязанного и сукцинилированного — 35 кДа.
Подразделение производных препаратов декстрана и гидроксиэтилкрахмала основано на молекулярных характеристиках. В основе их классификации лежит различие по молекулярной массе.
Молекула последнего, в отличие от декстрана и производных желатина, имеет несколько основных характеристик. Помимо молекулярной массы, это степень и характер молекулярного замещения [9]. Степень замещения — это доля остатков глюкозы, замещенная гидроксильной группой. Характер молекулярного замещения — соотношение замещений в различных позициях остатка глюкозы. Важной характеристикой молекулы гидроксиэтилкрахмала является соотношение замещений в С2- и С6-положениях глюкозного остатка.
В связи с этим препараты гидроксиэтилкрахмала классифицируются: на высоко-замещенные (степень замещения 0,6—0,8) и низко-замещенные (0,4—0,5); на препараты с высоким соотношением С2/С6 (более 8) и с низким (менее 8). Группа высокомолекулярных высокозамещенных крахмалов исторически была синтезирована первой и получила название гексакрахмалов, или helastarch, позднее введенная в клиническую практику группа среднемолекулярных низкозамещенных препаратов получила название пентакрахмалов, или pentastarch.
Как сказано выше, основным действием коллоидных объемозамещающих растворов является поддержание объема циркулирующей крови. Волемический эффект их определяется силой связывания воды и длительностью пребывания в сосудистом русле. Сила связывания воды прямо пропорциональна концентрации и обратно пропорциональна молекулярной массе коллоидного препарата. Волемический эффект коллоидов характеризуется объемным коэффициентом (отношение увеличения объема циркулирующей крови к объему введенного раствора), продолжительностью объемного действия и пери одом полувыведения (табл 2).
Таблица 2.
Характеристики полемического эффекта коллоидных
объемозамещающих растворов
1шт. препарата |
Объемный коэффициент | Продолжительность действия, ч | Период полувыведения, ч |
| Альбумин 5% | 1-1,5 | 4 | |
| Альбумин 20% | до 4,0 |
4-6 |
|
| Декстрины среднемолекулярные низкомолекулярные |
0,8-1,2 1,4—1,6 |
4-11 2-4 |
6 -8 5-6 |
| Производные гидроксиэтилкрахмала высокомолекулярные среднемолекулярные 6% среднемолекулярные 10% низкомолекулярные |
1,0 0 8-10 1,2-1,4 0,8-1,0 |
6-10 3 4 3-4 3-4 |
8-10 6-8 6-8 6-8 |
| Производные желатина мочевиносвязанный оксижелатин сукцинилированный |
0,5-0,7 0,7-0,8 0,7-0,8 |
около I около I 3-4 |
1-2 1-2 3-4 |
Все лекарственные препараты помимо основного фармакологического действия неизбежно дают и побочный эффект. Не являются исключением и синтетические коллоиды. Им свойственны такие побочные эффекты, как:
- Модифицирующее действие на систему гемостаза.
- Модифицирующее действие на реологические свойства крови.
- Влияние на функцию почек.
- Аллергические реакции.
- Накопление в ретикуло-эндотелиальной системе.
В геронтологической практике наиболее актуальны три первых эффекта.
Модифицирующее действие на систему гемостаза. Свойство изменять гемостатический потенциал крови в той или иной степени присуще всем синтетическим коллоидам и является по сути самым серьезным фактором, ограничивающим их применение [3,19,28]. Этот эффект особенно актуален у пациентов в критическом состоянии. Известно, что все критические состояния сопровождаются развитием ДВС-синдрома различной степени тяжести [7]. По некоторым данным у 10—20% пациентов отделений интенсивной терапии отмечается критическая тромбоцитопения с числом тромбоцитов менее 50х109/л [16].
Кроме того, значительному проценту пожилых пациентов свойственны исходные изменения в системе гемостаза, большей частью повышение коагуляционного потенциала крови [20]. Так, в хирургической клинике пожилой возраст считается одним из значимых факторов риска послеоперационных тромботических осложнений [11]. Однако в ряде случаев у лиц данного возрастного контингента имеют место гипоко-агуляционные состояния и снижение функции тромбоцитов, преимущественно ятрогенного характера при длительном приеме антиагрегантов и антикоагулянтов.
Из механизмов действия коллоидов на гемостаз можно выделить наиболее изученные: 1) гемодилюция — снижение числа тромбоцитов, концентрации белков системы гемостаза за счет разведения; 2) специфическое взаимодействие коллоидов с факторами свертывания, компонентами фибринолитической системы и ингибиторами фибринолиза; 3) непосредственное взаимодействие с мембранами тромбоцитов, клетками эндотелия сосудов [3].
Гемодилюции подвержены все компоненты системы гемостаза, однако данный механизм клинически наименее значим.
Специфическим взаимодействием определяется наибольшее повреждающее действие коллоидов на гемостаз [27,30,32]. Этот механизм свойствен нескольким компонентам системы гемостаза, в первую очередь комплексу VIII фактора свертывания*. По данным различных исследований, возможно преимущественное взаимодействие с прокоагулянтом либо фактором Виллебранда или же оно может охватывать весь комплекс фактора. Результат взаимодействия — снижение активности компонентов VIII фактора значительно большее, нежели можно было бы объяснить гемодилюцией, сопровождающееся, как правило, снижением временных показателей коагулограммы.
(* VIII фактор — комплекс белковых молекул, выполняющих в гемостазе различные функции. Это коагуляционный компонент (VIII : С, или прокоагулянт, антигемофильный глобулин) и фактор Виллебранда (VIИ : FW), крупномолекулярный белок, контролирующий тромбоцитарный гемостаз и необходимый, в частности, для адгезии тромбоцитов к эндотелию [1].)
Другой компонент системы свертывания, подвергающийся специфическому действию коллоида, — фибронектин. Молекула коллоидов связывается с фибронектином, образовавшийся комплекс встраивается в структуру тромба. При этом образование его ускоряется, но тромб получается более рыхлым и легче подвергается деструкции.
Третий компонент системы гемостаза (как системы поддержания состояния крови), подверженный действию обсуждаемого механизма — плазмин. При применении декстрана рядом авторов отмечено укорочение времени урокиназозависимого лизиса эуглобулинового сгустка, что говорит об активации фибринолиза. Причина этого — взаимодействие молекулы декстрана с фибрином и плазмином с образованием комплекса между ними. Такой комплекс препятствует ингибированию плазмина а2-антиплазмином, т. е. ослабляет действие физиологических анти-фибринолитиков. Аналогичное действие описано и для производных гидроксиэтилкрахмала.
Непосредственное взаимодействие с мембранами тромбоцитов наряду с предыдущим механизмом играет существенную роль в гемостазиологическом эффекте коллоидных растворов, хотя и не так распространено. В литературе подобный эффект — так называемое силиконизирующее или обволакивающее действие (образование пленки из молекул коллоидов, препятствующей адгезии и агрегации тромбоцитов) описан преимущественно для декстранов. Не исключается подобный эффект и для препаратов гидроксиэтилкрахмала.
Таким образом, действие коллоидных объемозамещающих растворов на систему гемостаза разнонаправленно, хотя в большинстве случаев коллоиды снижают гемостатический потенциал крови. Направленность изменений определяется, с одной стороны, снижением активности коагуляционного гемостаза, активацией фибринолиза, снижением функции тромбоцитарного звена; с другой, — ускорением формирования тромба за счет интеграции в его структуру (см. рисунок).
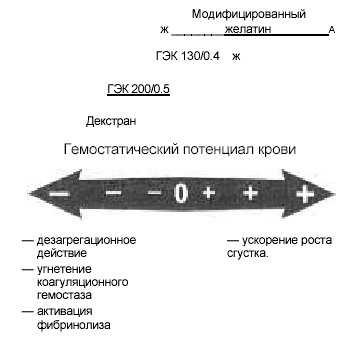 |
Влияние различных синтетических коллоидных объемозамещающих растворов на гемостатический потенциал крови. |
Характер и выраженность изменений гемостаза при применении коллоидов зависят от многих причин, из которых ведущее значение имеют четыре [3].
1. Характер коллоидов. На первом месте по влиянию на гемостаз бесспорно стоят препараты декстрана, далее следуют производные желатина и гидроксиэтилкрахмала, наименьшее влияние на гемокоагуляцню оказывает альбумин [15].
2. Молекулярная масса и другие структурные характеристики препаратов. Декстран-70 оказывает меньшее влияние на гемостаз, в частности на тромбоцитарное звено, чем декстран-40 (один из наиболее эффективных анти-агрегантных препаратов).
Выраженность изменений гемостаза при применении растворов гидроксиэтилкрахмала зависит, помимо молекулярной массы, и от степени молекулярного замещения. В большей степени снижают гемостатический потенциал препараты высокомолекулярного гидроксиэтилкрахмала с высокой степенью замещения — гексакрахмалы, в частности гидроксиэтилкрахмал 450/0,7. Меньшее влияние отмечено у пентакрахмалов, в первую очередь препаратов гидроксиэтилкрахмала 200/0,5, но и при их применении отмечено снижение активности VIII фактора агрегации тромбоцитов. Вообще из всего модельного ряда препаратов гидроксиэтилкрахмала только для растворов 130/0,4 не характерно антиагрегантное действие.
Низкомолекулярные (70/0,5) и среднемолекулярные низкозамещенные (130/0,4) в отличие от других препаратов гидроксиэтилкрахма ла, по данным всех исследователей, оказывают минимальное гипокоагуляционное действие, они склонны вызывать даже гиперкоагуляцию, в первую очередь увеличением активности фактора Виллебранда [13,31].
3. Объем инфузии и длительность применения препарата [3].
По этому вопросу данные исследователей несколько различаются, однако в целом можно вы делить три рубежа объемов, одинаковых для всех коллоидных объемозамещающих растворов.
- до 500 мл, или 5—7 мл/кг в сутки, действие коллоидов практически не проявляется или не выходит за рамки гемодилюции;
- до 1000—1500 мл, или до 20 мл/кг массы тела в сутки, проявляются специфичные для коллоидов эффекты (взаимодействие с факторами свертывания, форменными элементами крови), однако геморрагический синдром не возникает или не усиливается;
- опасной с точки зрения геморрагических осложнений считается массивная инфузия коллоидных растворов (свыше 25% объема цирку лирующей крови, или более 1500—2000 мл в сутки).
4. Исходное состояние гемостаза. Изменения в системе гемостаза при применении коллоидов более выражены у пациентов с исходной его патологией, такой, как гемофилия, болезнь Виллебранда, тромбоцитопении различного генеза и др.
Как сказано выше, в геронтологической практике чаще встречаются гиперкоагуляционные состояния, в связи, с чем возможность повышения коагуляционного потенциала крови, обусловленная применением синтетических коллоидов у пожилых больных, более опасна, нежели в других возрастных группах. Диапазон изменений системы гемостаза при применении синтетических коллоидов представлен на рисунке. В большей степени тромбогенное действие характерно для препаратов модифицированного желатина [4].
Вообще, за счет свойства ускорять формирование сгустка все коллоиды обладают потенциальной возможностью гиперкоагуляционного действия, однако проявляется оно только при применении препаратов модифицированного желатина. Очевидно в случае декстранов и гидроксиэтилкрахмала указанный эффект нивелируется другими, разобранными выше.
Увеличение коагуляционного потенциала крови при проведении инфузионной терапии связывают и с изолированной инфузией кристаллоидных растворов [4].
Модифицирующее действие на реологические свойства крови. Реологические свойства крови тесно связаны с системой гемостаза. Помимо склонности к гиперкоагуляции, для пожилых пациентов характерны и нарушения реологии крови: повышение вязкости крови, агрегации эритроцитов.
Влияние коллоидов на реологию крови разнонаправленно и определяется, с одной стороны, гемодилюцией, с другой, — собственно свойствами молекул коллоида [18]. Реологические свойства крови под влиянием коллоидов могут изменяться в сторону как улучшения текучести крови, так и ее ухудшения текучести крови. Характер и выраженность этих изменений зависят от структурных характеристик коллоидов (тип препарата, молекулярная масса и др.), длительности применения и доз.
Выраженность и направленность изменений вязкости плазмы под воздействием инфузии препаратов гидроксиэтилкрахмала представлены в табл. 3. Высокомолекулярные высокозамещенные препараты увеличивают вязкость плазмы, среднемолекулярные ее практически не меняют, а низкомолекулярные — уменьшают. Зависимость агрегации эритроцитов от молекулярных характеристик гидроксиэтилкрахмала несколько иная. Высокомолекулярные растворы ее увеличивают. Средне- и низкомолекулярные — снижают [32].
Таблица 3.
Зависимость реологического эффекта производных ГЭК
от молекулярной характеристики
| Тип препарата (мол. масса/степень замещения) | Соотношение с2/с6 | Изменение вязкости плазмы |
| 450/0,7 | 13 | +++ |
| 200/0,62 | 10 | ++ |
| 200/0,5 | + | |
| 200/0,5 | 6 | +/- |
| 70/0,5 | 4 | -/------- |
В экспериментах in vitro выявлено ухудшение реологических свойств крови: повышение вязкости плазмы, снижение пластических свойств эритроцитов при использовании раствора модифицированного желатина — препарата Гелофузина, проявляющееся повышением вязкости плазмы снижением пластических свойств эритроцитов [10].
Влияние на функцию ночек. Известно, что хроническая почечная недостаточность (ХПН) той или иной степени нередко встречается у пожилых пациентов. Генез ХПН различен, в большинстве случаев он обусловлен сосудистым поражением, например, при сахарном диабете, гипертонической болезни. Нередко субклиническое течение ХПН, проявляющееся только в «стрессовых» для почек условиях.
Действие коллоидных объемозамещающих растворов на функцию ночек, как и в других случаях, двояко. С одной стороны, устранение гиповолемии улучшает условия для клубочковой фильтрации, с другой, — с их применением связывают тяжелое поражение структур нефрона вплоть до некроза. В литературе описан так называемый синдром острого гиперонкотического повреждения почек (acute hyperoncotic kidney failure) в результате применения коллоидов. Существует несколько гипотез патогенеза поражения почек при применении коллоидных объемо-замещающих растворов, По одной из них развитие острой почечной недостаточности связано с накоплением низкомолекулярных фракций в почечных канальцах и повышением осмолярности мочи, что и запускает некротические изменения в клетках канальцевого эпителия. По другой, предложенной М. Mogan и С. Kapsner, поражение почек обусловлено дисбалансом между гидростатическим давлением (почечное перфузионное давление) и онкотическим давлением (плазмы крови) на мембране клубочков. Повышение онкотического давления плазмы, связанное с применением гиперонкотических растворов, вплоть до резорбции клубочковой фильтрации, в конечном итоге приводит к ишемии и повреждению канальцевого эпителия [29].
Первое место по нефротоксичности занимают гиперонкотические растворы: декстраны, в особенности низкомолекулярный декстран-40, высокомолекулярные препараты гидроксиэтил-крахмала (группа hetaslarch), 10% раствор среднемолекулярного гидроксиэтилированного крахмала, 20% растворы альбумина. Промежуточное положение занимают растворы среднемолекулярных гидроксиэтилкрахмалов. Ряд авторов считают безопасным с точки зрения почечной функции применение препаратов группы pentastarch даже в больших (превышающих 20 мл/кг) дозах. Наименьшее нефротоксическое действие большинство исследователей отводят производным желатина [29].
Таким образом, пациенты пожилого возраста более чувствительны и к основному действию инфузионной терапии, и к ее побочным эффектам, впрочем, что касается и многих других методов лечения. Это предъявляет повышенные требования к клиническому и лабораторному контролю состояния пациентов при проведении инфузионной терапии, прежде всего контролю гемодинамики, включая инвазивный контроль центральной гемодинамики, системы гемостаза и функции ночек.
Учитывая эффективность волемического действия и выраженность побочных эффектов синтетических коллагенов, пациентам пожилого и старческого возраста более показаны растворы среднемолекулярных гидроксиэтилкрахмалов.
Литература
- Баркаган З.С., Момот А.11. Диагностика и контролируемая терапия нарушений гемостаза. М.: Ньюдиамед; 2001.
- Буланов А.Ю, Городецкий В.М., Шулутко Е.М.. Прасолов Н.В., Николаев А.П.. Опыт интенсивной терапии острой интраоперационной кровопотери у больных пожилого возраста, IV международная конференция «Пожилой больной. Качество жизни». Клин, геронтол. 1999; 3.
- Буланов А.Ю., Городецкий В.М., Шулутко Е.М. Коллоидные объемозамещающие растворы и гемостаз. Российский журнал анестезиологии и интенсивной терапии 1999; 2: 25-31.
- Буланов А.Ю., Городецкий В.М., Шулутко Е.М. и др. Растворы модифицированного желатина и гемостаз: новые аспекты старой проблемы. Вестник интенсивной терапии 2002; 4:91-93.
- Буров П.Е. Анестезия и интенсивная терапия в гериатрической урологии, В кн.:.Избранные главы гериатрической урологии. Под ред. Л.М. Гориловского. М.: Ньюдиамед; 2000.
- Воробьев А.П., Городецкий В.М., Шулутко Е.М., Васильев С.А, Острая массивная кровопотеря. М.: Гэотармед; 2001.
- Воробьев П.А. Синдромы диссеминированного внутрисосудистого свертывания крови. 1996. М.: Ныодиамед.
- Галстян Г.М., Городецкий В.М, Применение растворов альбумина в клинической практике. Гематол. и трансфузиол. 1993; 5: 44-47..
- Молчанов И.В., Гольдина О.А., Горбачевский Ю.В. Растворы гидрокмэтилированного крахмала – современные и эффективные плазмозамещающие средства инфузионной терапии. Монографический обзор. М.: Издательство НЦССХ им. А.Н. Бакулева РАМН; 1998. 138.
- Ройтман Е.В., Морозов Ю.А. Гемореологические эффекты препарата «Гелофузин». Вестник службы крови России 2002; 2: 20-22.
- Российский Консенсус «Профилактика послеоперационных венозных тромбоэмболических осложнений». 2000.
- Шифман Е.М., Тиканадзе А.Д. Инфузионная терапия периоперационого периода. Петрозаводск; 2001.
- Baron J.F. A new HydroxyethylStarch: HES 130/0.4, Voluven. Tranfusion alternatives in transfusion medicine 2000; 2 ( 2 ) : 13-21.
- Boldl J., Haisch G., Suttner S. et al. Are laclate Ringer's solutionaml normal saline solution equal with regard to coagulation? Anesth. Analg. 2002; 94 (2): 378-384.
- de Jonge El, Levi M. Effects of different plasma substitutes on blood coagulation: a comparative review. Crit. care med. 2001; 29(6): 1261-1267.
- Drews R.E., Weinberger S.E. Trombocytopenic disorders in critical ill patients. Amer. J. Respir. Ctit. Care Med. 2000; 162 (2): 347-351.
- Ferguson N.D., Stewart Т.Е., Etchells E.E. Human al bumin administration in critically ill patients. Intensive Care Med. 1999; 25: 323-325.
- Hensel ML, Wrobel R., Volk T. Et al. Changes in coagulation physiology and rheology after preoperative normovolemic hemodilution. Anasthesiol Intensivmed Notfallmcd Schmerzther. 199G; 31:481-487.
- Haljamae H. Use of fluids in trauma. International J. intensive care 1999; 6(1): 20-30.
- Jacobs L.G. Nusbaum N. Perioperative management and reversal of antithrombotic therapy. Clin. Geriatr. Med. 2001; 17{I): 189-202.
- Kasper S.M., Dahlmann H., Mellinghoff II, et al. Lactated Ringer's solution versus hydroxyethyl starch for volume replacement in autologous blood donors with cardiovascular disease: a controlled, randomized trial. Vox sang. 1998; 75(1): 26-31.
- Kruskall M.S., Mintz P.D., Bergin J.J. Transfution therapy in emergency medicine. Amer. Emerg. Med. 1988; 17(4): 327-335.
- Lang K., Boldt J., Suttner S., Haisch G. Colloids versus crystalloids and tissue oxygen tension in patients undergoinhg major abdominal surgery. Aneslh. Analg. 2001; 93(2): 405-409.
- Saverese D., Waitkus II., StewartF.M., Gallery M. Bloodless medicine'and surgery. Intensive Care Med. 1999; 14: 20-33.
- Sazama K. Reports of 355 transfusion-associated deaths. Transfusion. 1990; 30: 583-590.
- Schierhout G., Roberts I. Fluid resuscitation with col loid or crystalloid solutions in critically ill patients: a sys tematic review of randomized trials. British Medical Journal. 1988; 316: 961-964.
- Strauss R.G. Review of the effects of hydroxyethyl starch on the blood coagulation system. Transfusion 1981; 21: 299-302.
- Strauss R.G. Volume replacement and coagulation: a comparative review. J. Cardiothor. Anesth. 1988; 2: 24-32.
- Ragaller M.J.R., Theilen H., Koch T. Volume replace ment in critically ill patients with acute renal failure. J. Amer. Soc. Nephrol. 2001:12:. 33-39.
- Treib J., Haass A., Pindur G. Coagulation disorders caused by hydroxyethyl starch. Thromb. Haemost. 1997; 78: 974-983."
- Treib. J., Baron J.F. Hydroxyethyl starch: effects on hemostasis. Ann. Fr. Aneslh. Reanim. 1998; 17(1): 72-81.
- Treib J., Baron J . F . , Grauer M.T., Strauss R.G. An international view of hydroxyethyl starches. Intensive Care Med. 1999; 25: 258-268*.

