Преэклампсия – синдром внутрибрюшной гипертензии беременных.
Станет ли гипотеза теорией?
Дмитрий Васильевич Маршалов1, Ефим Муневич Шифман2, Игорь Аркадьевич Салов1, Алексей Петрович Петренко1
1-Саратовский государственный медицинский университет им. В.И. Разумовского, г. Саратов, Россия;
2-Московский областной научно-исследовательский клинический институт им. М.Ф Владимирского, г. Москва, Россия
Реферат
На основе анализа литературы и собственных данных авторами представлены современные аспекты этиологии и патогенеза преэклампсии с позиции синдрома внутрибрюшной гипертензии. Материал собран на большой репрезентативной выборке, включающей 647 пациенток на различных сроках гестации. Было показано, что повышенный уровень внутрибрюшного давления при сроке 20–24 нед беременности в ряде случаев предшествовал развитию преэклампсии. Уровень внутрибрюшного давления, предшествующий развитию преэклампсии, у беременных с ожирением был статистически значимо выше, чем у пациенток с нормальной массой тела (р <0,001). Наряду с уровнем внутрибрюшного давления в развитии преэклампсии важную роль играет темп его прироста, причём в большей степени, чем абсолютная величина внутрибрюшного давления. Беременные с быстрым и существенным ростом внутрибрюшного давления (более 4 мм рт.ст. за 2 нед гестации) имеют большую вероятность осложнённой беременности, чем пациентки с приростом внутрибрюшного давления не более 2 мм рт.ст. за данный интервал времени (р <0,001), при этом чем больше прирост внутрибрюшного давления, тем в более ранние сроки развивается осложнение. Также в статье приведены сведения о динамике внутрибрюшного давления во время беременности, связи внутрибрюшной гипертензии с показателями маточно-плацентарного кровотока, почечной гемодинамики, кишечной перфузии и проницаемости, уровнем эндотоксемии у беременных. На основании результатов собственных исследований авторы предлагают модель развития преэклампсии как следствия синдрома внутрибрюшной гипертензии.
Ключевые слова: беременность, внутрибрюшная гипертензия, преэклампсия, эндотоксин грамотрицательных микроорганизмов.
Введение
В последние годы в научной медицинской литературе появились яркие, интересные публикации, связывающие развитие преэклампсии (ПЭ) с внутрибрюшной гипертензией (ВБГ). В этих работах пересматриваются существующие ныне теории возникновения ПЭ и предлагаются новые патогенетические механизмы, этиология которых в той или иной мере связана с повышенным внутрибрюшным давлением (ВБД) во время беременности [4, 6, 15, 35, 48, 42].
В основе новых гипотез лежат результаты работы R.H. Paramore и предложенная им в начале прошлого столетия «механистическая» концепция развития ПЭ [30]. Как и любые пионерские изыскания, гипотеза о первопричинности ВБГ при ПЭ прошла путь относительного забвения и только в последние годы возродилась в научных публикациях вспышкой живейшего интереса к данной проблеме [18, 21, 27]. В 2000-х годах появились публикации, в которых обсуждалась возможная связь ВБГ и ПЭ, однако первичность ВБГ ставилась под сомнение [19, 34]. Определение казуальности связи ВБД и ПЭ было затруднено, так как авторы исследовали ВБД на этапе уже свершившегося осложнения.
Первую модернизацию механистической концепции развития ПЭ провели в 2011 г., причём практически одновременно и независимо друг от друга сразу три автора [6, 38, 42]. Вместе с тем, детали концепции имели определённые различия, не противоречащие, а дополняющие друг друга. A. van Dalfsen и H.J. Sugerman в основу своей гипотезы положили дисбаланс ренин-ангиотензин-альдостероновой системы, вызванный, прежде всего, нарушениями почечной перфузии [38, 42]. В последующем этот сценарий развития ПЭ при ВБГ поддержали и другие авторы, дополнив гипотезы A. van Dalfsen и H.J. Sugerman новыми сведениями [4, 15].
В работе Д.В. Маршалова и соавт. наряду с факторами, обусловливающими нарушение спланхнической перфузии при ПЭ, авторы указали на важность иммунологических причин возникновения ПЭ при ВБГ, связанных с повышенной проницаемостью кишечной стенки, бактериальной транслокацией, а также проникновением во внутреннюю среду эндотоксина — липополисахарида (ЛПС), частиц микробных клеток и продуктов их жизнедеятельности [6].
И у этой гипотезы появились последователи. Разрабатывая свою гипотезу, D.J. Sawchuck и B.K. Wittmann расширяют представления о возможных причинах ПЭ, подкрепляя её сведениями о роли факторов внешней и внутренней среды: атмосферного давления, условий проживания, экологии и микробиома кишечника [35].
Авторы, таким образом, дали второе рождение инфекционной теории А. Delore’s 1884 г.
Степень транслокации ЛПС у беременных теоретически зависит от двух факторов: качественного содержания кишечного микробиома и степени кишечной проницаемости. Стало известно, что во время беременности микробиом кишечника претерпевает изменения, характеризующиеся возрастанием титра условно-патогенных грамотрицательных бактерий. При нарушении барьерной функции кишечной стенки происходит транслокация ЛПС в брыжеечные лимфатические узлы и далее — через воротную вену в печень [20, 23].
В клетках Купфера ЛПС инициирует цитотоксический иммунный ответ с участием белка CD14. Выброс провоспалительных цитокинов вследствие активации ЛПС эффекторных клеток приводит к системной воспалительной реакции, окислительному стрессу, формированию атеросклеротических бляшек, и последующей полиорганной недостаточности [24].
В контексте вышеизложенного вызывает сомнение общепринятая точка зрения о ведущей роли плаценты и плода как основных факторов иммунного ответа при ПЭ.
ВБГ — значимый фактор нарушения перфузии кишки, что теоретически может повышать её проницаемость у беременных, вызывать транслокацию бактерий и их компонентов.
Необходимо отметить, что все приведённые гипотезы строились на основании схожести клинических, функционально-лабораторных признаков ПЭ и критических состояний, связанных с ВБГ, базировались на эмпирических данных и логических заключениях, что оставляет огромную область для изучения данной проблемы.
Следует сказать, что публикации, содержащие фактический материал по ВБД во время беременности и в послеродовом периоде, единичны и представляют данные малых выборок [12, 14, 17, 22, 29, 37, 39].
Поводом к написанию этой статьи являлся не конфликт интересов и установление приоритета, а желание поделиться накопленным фактическим материалом с мировым научным сообществом. Для статьи были использованы наиболее важные результаты исследований, проведённых нами в течение ряда лет.
Динамика ВБД у здоровых беременных.
Итак, изучение связи ВБД и ПЭ невозможно без оценки показателей ВБД, предшествующих возникающим осложнениям. Необходимо знать не только фактический уровень ВБД, но и иметь представление о нормальных значениях этого показателя в различные сроки гестации. До настоящего времени данные о референтных значениях ВБД во время беременности отсутствуют.
С 2008 г. мы проводили исследование связи ВБД с физиологией беременности и родов, а также их осложнёнными исходами, включающее наблюдение и лечение 647 пациенток на различных сроках гестации.
Измерение ВБД осуществляли стандартным чреспузырным методом по M.L. Cheatham [16].
В положении пациентки лёжа на спине проводили катетеризацию мочевого пузыря мочевым катетером Фолея, к которому подсоединяли коннектор UnometrTM Abdo-PressureTM. Затем через безыгольный порт Kombi KonTM в м очевой п узырь вводили 20 мл тёплого стерильного изотонического раствора натрия хлорида. После того как система заполнялась раствором, переводили измерительную часть прибора, состоящую из градуированной трубки с шагом измерения 1 мм рт.ст., в вертикальное положение. Устанавливали нулевое значение шкалы у симфиза и измеряли ВБД.
В комплексе исследования ВБД оценивали комплайенс брюшной стенки, который характеризует податливость брюшной стенки и определяет её способность растягиваться при увеличении внутрибрюшного объёма. Комплайенс брюшной стенки определяли расчётным методом по формуле:
комплайенс брюшной стенки = 100 / ДВБД, где ДВБД — разница ВБД после введения в мочевой пузырь 100 мл раствора и исходного ВБД [40].
Проведённые исследования показали, что в 6–8 нед гестации у пациенток с исходно нормальной массой тела и одноплодной беременностью средние значения ВБД составляли 1,40±0,96 мм рт.ст.; во II триместре (20–24 нед гестации) — 11,54±3,40 мм рт.ст., в III триместре (с 27-й по 41-ю неделю) — 18,56±1,35 мм рт.ст.
В отличие от данных M. Schein и соавт., где наблюдался нелинейный рост ВБД при увеличении внутрибрюшного объёма в эксперименте [36], проведённый нами анализ динамики ВБД во время беременности показал линейную зависимость уровня ВБД от срока гестации. Динамика уровня комплайенса брюшной стенки имела обратную линейную зависимость по отношению к ВБД. Средние значения комплайенса брюшной стенки в I триместре составили 43,20±8,77 мл/мм рт.ст., во II триместре — 20,65±5,10 мл/мм рт.ст., в III триместре средние значения уровня комплайенса брюшной стенки продолжали снижаться — 13,03±1,30 мл/мм рт.ст.
Исследования также показали, что уровень ВБД практически не связан с внутрибрюшным объёмом. Коэффициент корреляции связи уровня ВБД и массы плода составил 0,02. Таким образом, в увеличении ВБД первостепенное значение имеет именно растяжимость передней брюшной стенки.
Учитывая возможное влияние на динамику ВБД нескольких факторов, нами был применён метод многофакторного статистического анализа (кластерный анализ, множественная корреляция и регрессия). Анализ корреляционной матрицы позволил определить, что увеличению ВБД способствуют висцеральное расположение жира и отсутствие родов в анамнезе. Эти два фактора напрямую влияют на снижение комплайенса брюшной стенки (r=0,58 и r=0,62 соответственно, р <0,01).
Для установления референтных значений ВБД были проанализированы показатели 308 женщин с исходно нормальной массой тела и физиологическим течением одноплодной беременности.
Критерием исключения из анализа было наличие факторов риска развития ВБГ, таких как многоводие, кишечная дисфункция, послеоперационные рубцы на передней брюшной стенке, спаечный процесс в брюшной полости и андроидный тип ожирения.
Уровень ВБД менялся от Ме [25-й; 75-й перцентиль] = 1 [0; 3] в 6–8 нед беременности до 20 [20; 21] на сроке 40 нед, при этом имея средние значения в различные сроки гестации, рост ВБД за 2-недельный интервал беременности в норме не превышал 1 мм рт.ст.
Связь между ВБД и развитием ПЭ.
Мы провели проспективное исследование, включающее 551 пациентку, из которых были выделены 180 пациенток без ожирения и 371 пациентка с ожирением различной степени тяжести: с I степенью — 212 беременных, со II — 101, с ожирением III степени — 58 женщин. Ожирение представляется одним из существенных факторов риска развития ПЭ.
У 80 пациенток беременность осложнилась развитием ПЭ различной степени тяжести, в том числе у 23 пациенток с нормальной массой тела (12,8% абсолютного числа в подгруппе), у 29 (13,7%) женщин с I степенью ожирения, у 14 (13,9%) беременных с ожирением II степени и 14 (24,1%) женщин с ожирением III степени.
Ранняя ПЭ (до 34 нед) развилась у 28 беременных, в том числе у 11 пациенток с нормальной массой тела, у 13 — с I степенью ожирения, у 2 — с ожирением II степени, у 2 — с ожирением III степени. Поздняя ПЭ (с 34 нед гестации) диагностировалась чаще — в 65% случаев (у 52 беременных): у 12 пациенток с исходно нормальной массой тела (52,2% всех случаев диагностированной ПЭ в подгруппе), при I степени ожирения — у 16 (55,2%), при ожирении II и III степени — у 12 беременных в каждой подгруппе (по 85,7%). Таким образом, при выраженном ожирении ПЭ развивалась достоверно чаще (р <0,05) и преимущественно после 34-й недели гестации.
Для решения вопроса о патогенетической связи и первичности между ВБД и ПЭ мы провели анализ динамики уровня ВБД в I и II триместрах беременности. Результаты исследования показали, что исходные значения (в I триместре) ВБД в группе с неосложнённым течением беременности были незначительно ниже показателей группы с ПЭ. Во II триместре беременности регистрировались достоверные различия между группами с ПЭ и без неё.
При этом у пациенток с нормальной массой тела и неосложнённым течением гестации средние значения ВБД составили 10,83±3,71 мм рт.ст., у беременных с ожирением I степени — 13,78±1,68 мм рт.ст., со II степенью — 14,60±1,52 мм рт.ст., с III степенью ожирения — 16,15±1,14 мм рт.ст. У пациенток, беременность которых в дальнейшем осложнилась развитием ПЭ, значения ВБД в 20–24 нед были следующими: у пациенток с исходно нормальной массой тела — 13,36±3,93 мм рт.ст., с I степенью ожирения — 16,71±0,76 мм рт.ст., со II — 17,86±1,96 мм рт.ст., с III — 19,60±2,06 мм рт.ст.
Таким образом, референтные значения ВБД в 20–24 нед беременности у пациенток с ожирением можно представить следующим образом:
при I степени ожирения они укладываются в диапазон 13–15 мм рт.ст., при II степени — 14– 15 мм рт.ст., при III степени ожирения — 15– 17 мм рт.ст.
Кроме уровня ВБД, на развитие осложнений могут влиять время, за которое ВБД достигает критических значений, и продолжительность сохранения этих показателей. В связи с этим мы также провели исследование зависимости развития ПЭ не только от абсолютных значений ВБД в конкретные сроки гестации, но и от темпов прироста ВБД за определённые временные интервалы, определяемые нами как ΔВБД. Для этого мы рассчитывали кумулятивную вероятность неосложнённой беременности у пациенток с различным темпом роста ВБД в период гестации, используя методику, предложенную Капланом и Мейером.
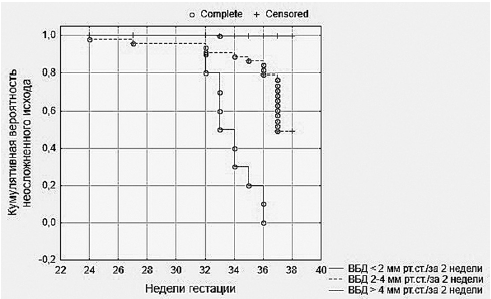
Рис. 1. Кумулятивная вероятность неосложнённой беременности
при трёх вариантах прироста внутрибрюшного давления (ВБД) за 2 нед гестации
Кривые Каплана–Мейера строились для трёх вариантов прироста ВБД:
– ΔВБД <2 мм рт.ст./2 нед беременности;
– ΔВБД=2–4 мм рт.ст./2 нед беременности;
– ΔВБД >4 мм рт.ст./2 нед беременности.
Результаты исследования показали, что при различных темпах прироста ВБД неодинаковы и сроки развития ПЭ: при быстром росте ВБД (большем значении ΔВБД) осложнения беременности развивались в более ранние сроки (рис. 1).
Результаты последующих множественных попарных сравнений функций кумулятивной вероятности неосложнённого исхода беременности в отношении ПЭ показали, что пациентки с большей величиной ΔВБД имеют статистически значимые различия в вероятности неосложнённой беременности с пациентками, имеющими ΔВБД <2 мм рт.ст.
Сроки развития ПЭ при ΔВБД >4 мм рт.ст.
существенно сокращались — медиана времени появления клинических признаков ПЭ у этих пациенток соответствовала 34 нед беременности (25-й перцентиль — 33,0; 75-й перцентиль — 36,0), а при ΔВБД 2–4 мм рт.ст. — 37 нед (25-й перцентиль — 36,0; 75-й перцентиль — 37,0).
Повышенный уровень ВБД при сроке 20–24 нед беременности в ряде случаев предшествовал развитию ПЭ. Уровень ВБД, предшествующий развитию ПЭ, у беременных с ожирением достоверно выше, чем у пациенток с нормальной массой тела (на 18–32%, р <0,001).
Наряду с уровнем ВБД в развитии ПЭ важную роль играет темп его прироста, причём в большей степени, чем абсолютная величина ВБД. Беременные с быстрым и существенным ростом ВБД (более 4 мм рт.ст. за 2 нед гестации) имеют достоверно более высокую вероятность осложнённой беременности, чем пациентки с приростом ВБД не более 2 мм рт.ст. за данный интервал времени (р <0,001), при этом чем больше прирост ВБД, тем в более ранние сроки развивается осложнение.
Механизмы развития ПЭ при ВБГ.
В контексте вышеизложенных предположений приводим результаты некоторых наших исследований, подтверждающие механистическую и иммунологическую концепцию развития ПЭ при ВБГ.
Зависимость показателей маточно-фетоплацентарного кровотока от уровня ВБД у беременных.
Несколько наших исследований было посвящено изучению зависимости частоты гестационных осложнений от динамики ВБД у беременных с острой хирургической патологией во II триместре (22–27 нед гестации) [10, 11]. В случаях развития острого аппендицита, панкреатита и кишечной непроходимости прогрессирующий рост ВБД был инициирующим фактором нарушений маточно-плацентарного кровотока, которые всегда предшествовали другим осложнениям. Непараметрическим методом Спирмена между уровнем ВБД и индексом резистентности маточных артерий была установлена сильная положительная корреляционная связь (r=0,83; p=0,000). Индекс резистентности маточных артерий значимо возрастал с увеличением значений ВБД более 95-го процентиля — 18 мм рт.ст. Связь между уровнем ВБД и индексом резистентности артерии пуповины в эти сроки была слабая: r=0,23; p=0,05.
Было отмечено, что при значимом увеличении ВБД повышалось общее периферическое сосудистое сопротивление, что сказывалось на снижении интенсивности кровотока в маточных артериях и приводило к увеличению индекса резистентности маточных артерий. В ответ на нарушение маточно-плацентарной гемодинамики компенсаторно активировался кровоток лось снижением численных значений индекса резистентности артерии пуповины. О декомпенсации маточно-плацентарного кровотока свидетельствовали изменения в соотношении индекса резистентности маточных артерий и индекса резистентности артерии пуповины, цифровые значения которого становились больше или равными единице [7]. Таким образом, повышенное ВБД, предшествующее нарушениям маточно-плацентарного кровотока, можно признать триггерным фактором в развитии ПЭ.
Зависимость показателей микроциркуляции кишечника от уровня ВБД у беременных.
Мы провели исследование связи ВБД и функционального состояния микроциркуляторного русла кишечника у 47 пациенток, родоразрешённых путём кесарева сечения при сроке 32– 36 нед по экстренным и срочным показаниям.
Критериями исключения были заболевания желудочно-кишечного тракта.
У 18 беременных показанием к родоразрешению была ПЭ различной степени тяжести.
Оценку перфузии кишечника после извлечения плода проводили методом лазерной допплеровской флоуметрии на стенке поперечно-ободочной и тонкой кишки. Дополнительно в периоперационном периоде этим же методом проводили оценку микроциркуляции в заднем своде влагалища как анатомически близком регионе к органам брюшной полости. В анализе использовали показатели ВБД до лапаротомии.
До начала операции при ВБД, соответствующем 25–75-му перцентилю нормы, средние значения показателя микроциркуляции в заднем своде влагалища составляли 44,64±1,87 перф.ед.
При превышении ВБД более 95-го перцентиля показатели перфузии достоверно снижались до 34,63±3,34 перф.ед.
После извлечения плода уровень показателя микроциркуляции в заднем своде влагалища увеличился по сравнению с исходными значениями — на 4,8% при исходно нормальном ВБД и на 13,6% при повышенных значениях ВБД, что обусловлено реперфузией после хирургической декомпрессии.
При нормальных значениях ВБД средние значения показателя микроциркуляции в тонкой кишке соответствовали 41,39±2,12 перф.ед., в толстой кишке — 25,7±1,64 перф.ед. При превышении ВБД более 95-го перцентиля показатели перфузии кишки достоверно снижались на 35,7% в тонкой кишке и 27,4% в толстой. Различия абсолютных значений показателя микроциркуляции в разных отделах кишечника и слизистой оболочке влагалища можно объяснить механическим сдавлением мезентериальных сосудов вследствие ВБГ.
Результаты исследования показали, что между дооперационным уровнем ВБД и интраоперационными показателями микроциркуляции на стенке кишечника и в заднем своде влагалища существовала обратная корреляционная связь средней силы (r=0,58; р <0,001 и r=0,62; р <0,001 соответственно). При проведении анализа взаимосвязи показателей микроциркуляции кишечника и слизистой оболочки влагалища была выявлена прямая корреляция средней силы связи (r=0,68; р <0,001). Полученные результаты указывали на диагностическую ценность неинвазивного исследования микроциркуляции слизистой оболочки заднего свода влагалища, показатели которого отражают изменения перфузии на внутриорганном уровне.
Результаты другого, ещё не опубликованного нашего исследования подтвердили наличие связи показателя микроциркуляции в заднем своде влагалища с динамикой ВБД на этапах, предшествующих развитию клинической картины ПЭ. На основании результатов этих двух исследований можно сделать заключение о первичности нарушений микроциркуляции кишки и их потенциальной роли в развитии ПЭ.
Зависимость кишечной проницаемости от уровня ВБД у беременных.
Параллельно изучению связи региональных изменений микроциркуляции (в заднем своде влагалища) с динамикой ВБД во II триместре было выполнено исследование проницаемости кишечной стенки. Исследование проводили с помощью теста «маннитол/лактулоза».
В результате исследования получены данные, подтверждающие повышение кишечной проницаемости с ростом ВБД: в 20–24 нед гестации при уровне ВБД, соответствующем 25–75-му перцентилю, отношение «маннитол/лактулоза» соответствовало 0,028±0,001, а при ВБД более 95-го перцентиля — 0,035±0,001 (р <0,05). С прогрессированием ВБГ отношение «маннитол/лактулоза» увеличивалось: при ΔВБД 2–4 мм рт.ст. за 2 нед гестации оно соответствовало 0,052±0,003, при ΔВБД >4 мм рт.ст. — 0,084±0,002. У пациенток с умеренной ПЭ оно составляло 0,09±0,002, с тяжёлой ПЭ — 0,158±0,02 (p <0,001).
Таким образом, результаты проведённого исследования подтверждают наличие повышенной кишечной проницаемости у беременных с ВБГ, степень которой зависит от динамики ВБД и коррелирует с тяжестью развившейся ПЭ.
Зависимость эндотоксикоза от уровня ВБД у беременных.
Работы многих исследователей указывают на то обстоятельство, что в прогрессировании ПЭ важную роль играет системный воспалительный ответ, маркёрами которого служат эндотоксемия и активность антиэндотоксинового иммунитета [1, 2, 5, 25, 44]. Значение ВБГ как одной из причин эндотоксемии в развитии ПЭ на настоящий момент гипотетическое.
Мы выполнили исследование связи динамики ВБД во II триместре беременности с уровнем кишечного эндотоксина (E. coli). Уровень эндотоксина определяли в сыворотке крови методом активированных частиц (МАЧ-Endotox spp.) с помощью стандартных наборов.
Установлено, что в 20–24 нед гестации между уровнем ВБД и концентрацией эндотоксина существует прямая положительная корреляционная связь средней силы — r=0,53; p <0,05.
У пациенток с исходно нормальной массой тела концентрация эндотоксина составляла 7,2±0,03 пкг/мл, у беременных с выраженным ожирением — 9,4±1 пкг/мл (p <0,05).
С прогрессированием ВБГ концентрация эндотоксина значимо возрастала: при ΔВБД 2–4 мм рт.ст. за 2 нед гестации она соответствовала 12,7±2,0, при ΔВБД >4 мм рт.ст. — 21,4±3,1, а у пациенток с манифестацией тяжёлой ПЭ — 56,3±4,2 (p <0,001 при сравнении с больными с ΔВБД 2–4 мм рт.ст. за 2 нед гестации). Эту зависимость можно объяснить поступлением гидрофильной формы кишечного эндотоксина, то есть цельной молекулы ЛПС с её полисахаридной частью, на фоне повышенной кишечной проницаемости и истощением антиэндотоксинового иммунитета.
Таким образом, между динамикой ВБД при беременности и концентрацией эндотоксина прослеживается чёткая связь. Выраженная эндотоксемия развивается вследствие быстрого роста ВБД с нарушением регионарной микроциркуляции и проницаемости кишечной стенки. Транслокация бактерий и цельной молекулы ЛПС приводит к запуску системной воспалительной реакции и развитию полиорганных нарушений.
Заключение.
Разобщённость мнений специалистов относительно патогенеза ПЭ и растущее количество доказательств гетерогенности этиологии данного осложнения беременности подтверждает тот факт, что ПЭ — собирательная клиническая категория [31]. В последние годы появились работы, которые показывают различия в клинической картине, морфологических и иммуногистохимических характеристиках плацентарной площадки, уровней биомаркёров сосудистого и плацентарного повреждения у пациенток с различными сроками дебюта клинических проявлений ПЭ [3, 9, 13, 26, 28, 32, 33, 41, 43].
Таким образом, патология инвазии трофобласта — не единственная и, по-видимому, не основная причина ПЭ. Можно предположить существование нескольких сценариев развития ПЭ, одним из которых является ВБГ [8].
Результаты собственных исследований позволяют представить модель этиологии ПЭ, в которой кишечник — входные ворота в ПЭ, а «bacillus eclampsae» — грамотрицательная микрофлора кишечника, синтезирующая ЛПС.
Фактический материал, представленный в данной работе, позволяет сделать шаг от гипотезы к теории.
Литература
- Бондаренко К.Р., Мавзютов А.Р., Озолиня Л.А. Показатели антиэндотоксинового иммунитета при преэклампсии. Клин. лаб. диагностика. 2014; 59 (7): 55–57. [Bondarenko K.R, Mavsiyutov A.R., Ozoliniya L.A. The indicators of anti-endotoxin immunity under preeclampsia. Klinicheskaya laboratornaya diagnostika. 2014; 59 (7): 55–57. (In Russ.)]
- Ветров В.В., Воинов В.А., Иванов Д.О. Неосложнённая преэклампсия. СПб.: Информ-Навигатор. 2012; 168 с. [Vetrov V.V., Voinov V.A., Ivanov D.O. Neoslozhnennaya preeklampsiya. (Uncomplicated preeclampsia.) St. Petersburg: Inform-Navigator. 2012; 168 p.(In Russ.)]
- Воднева Д.Н., Романова В.В. Дубова Е.А. и др. Клинико-морфологические особенности ранней и поздней преэклампсии. Акушерст. и гинекол. 2014; 2:35–40. [Vodneva D.N., Romanova V.V., Dubova E.A. et al. The clinical and morphological features of earlyand lateonset preeclampsia. Akusherstvo i ginekologiya. 2014; 2:35–40. (In Russ.)]
- Давидян Л.Ю., Курклинский А.К., Маланина Е.Н. и др. Этиопатогенетическая и клиническая роль интраабдоминальной гипертензии и кардиоваскулярной дезадаптации в развитии преэклампсии. Соврем. пробл. науки и образования. 2015; 3. htth:// www.science-education.ru/123–17315 (дата обращения: 04.05.2016). [Davidyan L.Yu., Kurklinskiy A.K., Malanina E.N. et al. Ethiopathogenetic and clinical role of intra-abdominal hypertension and cardiovascular maladaptation in preeclampsia development. Sovremennye problemy nauki i obrazovaniya. 2 015; 3 . http://www.science-education.ru/123–17315 (access date: May 4, 2016). (In Russ.)]
- Мавзютов А.Р., Бондаренко К.Р., Еникеев А.Н., Бондаренко В.М. Системная эндотоксинемия как патогенетический фактор осложнения беременности. Ж. микробиол. 2012; 5: 16–21. [Mavzyutov A.R., Bondarenko K.R., Enikeev A.N., Bondarenko V.M. Systemic endotoxemia as a pathogenetic factor of pregnancy complications. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2012; 5: 16–21. (In Russ.)]
- Маршалов Д.В., Шифман Е.М., Петренко А.П., Салов И.А. Роль внутрибрюшной гипертензии в патогенезе акушерских и перинатальных осложнений. Врач. 2011; 8: 2–5. [Marshalov D.V., Shifman E.M., Petrenko A.P., Salov I.A. Role of intraabdominal hypertension in the pathogenesis of obstetric and perinatal complications. Vrach. 2011; 8: 2–5. (In Russ.)]
- Салов И.А., Маршалов Д.В., Петренко А.П., Шифман Е.М. Связь показателей маточно-фетоплацентарного кровотока и уровня внутрибрюшной гипертензии у беременных. Анестезиол. и реаниматол. 2012; 6: 9–12. [Salov I.A., Marshalov D.V., Petrenko A.P., Shifman E.M. Relationship between uteroplacental blood flow and of intra-abdominal hypertension in pregnant women. Anesteziologiya i reanimatologiya. 2012; 6: 9–12. (In Russ.)]
- Салов И.А., Шифман Е.М., Маршалов Д.В., Петренко А.П. Значение внутрибрюшной гипертензии в реализации акушерской и перинатальной патологии у беременных с ожирением. Акушерст. и гинекол. 2012; 4 (1): 99–102. [Salov I.A., Shifman E.M., Marshalov D.V., Petrenko A.P. Signifcance of the intra-abdominal hypertension in realization of obstetric end perinatal pathology at pregnant women with obesity. Akusherstvo i ginekologiya. 2012; 4 (1): 99–102. (In Russ.)]
- Ходжаева З.С., Коган Е.А., Клименченко Н.И. и др. Клинико-патогенетические особенности ранней и поздней преэклампсии. Акушерст. и гинекол. 2015; 1:12–17. [Khodzhaeva Z.S., Kogan Y.A., Klimenchenko N.I. et al. Clinical and pathogenetic features of early and late preeclampsia. Akusherstvo i ginekologiya. 2015; 1: 12–17. (In Russ.)]
- Шапкин Ю.Г., Маршалов Д.В., Ливадный Г.В., Петренко А.П. Влияние уровня внутрибрюшной гипертензии на исходы аппендэктомии у беременных. Фундаментал. исслед. 2012; 5: 374–378. [Shapkin U.G., Marshalov D.V., Livadnuu G.V., Petrenko A.P. Influence of level of the intra-abdominal hypertension on outcomes of the appendectomy at pregnant women. Fundamental’nye issledovaniya. 2012; 5: 374–378. (In Russ.)]
- Шапкин Ю.Г., Маршалов Д.В., Рогожина И.Е. и др. Зависимость исхода аппендэктомии у беременных от уровня внутрибрюшной гипертензии и показателей маточно-фетоплацентарного кровотока. Врач-аспирант. 2012; 5.1 (54): 138–142. [Shapkin Yu.G., Marshalov D.V., Rogozhina I.E. et al. The dependence of the appendectomy outcome in pregnant women on the level of intra-abdominal hypertension and indicators of uterine-fetoplacental blood flow. Vrach-aspirant. 2012; 5.1 (54): 138–142. (In Russ.)]
- Abdel-Razeq S.S., Campbell K., Funai E.F. et al. Normative postpartum intra-abdominal pressure: potential implications in the diagnosis of abdominal compartment syndrome. Am. J. Obstet. Gynecol. 2010; 203 (2): 149e1–4.
- Aksornphusitaphong A., Phupong V. Risk factors of early and late onset pre-eclampsia. J. Obstet. Gynaecol. Res. 2013; 39 (3): 627–631.
- Al-Khan A., Shah M., Altabban M. et al. Measurement of intraabdominal pressure in pregnant women at term. J. Reprod. Med. 2011; 56 (1–2): 53–57.
- Aslanidis Th., Boultoukas Е., Mamopoulos А., Mouloudi E. The role of intra abdominal hypertension and maternal venous compartment in the pathophysiology of preeclampsia. The Greek E-Journal of Perioperative Med. 2014; 12 (a): 28–38.
- Cheatham M.L. Intra-abdominal hypertension and abdominal compartment syndrome. New Horiz. 1999; 7: 96–115.
- Chun R., Baghirzada L., Tiruta C., Kirkpatrick A.W. Measurement of intraabdominal pressure in term pregnancy: a pilot study. Int. J. Obstet. Anesth. 2012; 21 (2): 135–139.
- Chun R., Kirkpatrick A.W. Intra-abdominal pressure, intra-abdominal hypertension, and pregnancy: a review. Ann. Intern. Care. 2012; 2: 1–7.
- Dart B.W.T., Cockerham W.T., Torres C. et al. A novel use of recombinant factor VIIa in HELLP syndrome associated with spontaneous hepatic rupture and abdominal compartment syndrome. J. Trauma. 2004; 57 (1): 171–174.
- Dixon L.J., Barnes M., Tang H. et al. Kupffer cells in the liver. Compreh. Physiol. 2013; 3: 785–797.
- El-Desouki R.A.K.M., Habib F.A. Preeclampsia at the molecular level. Applied Med. Res. 2015; 1 (2): 62–69.
- Fuchs F., Bruyere M., Senat M.V. et al. Are standard intra-abdominal pressure values different during pregnancy? PLOS ONE. 2013; 8 (10): e77324.
- Kaussen T., Srinivasan P.K., Afify M. et al. Influence of two different levels of intra-abdominal hypertension on bacterial translocation in a porcine model. Ann. Intern. Care. 2012; 2 (17): 1–13.
- Koren O., Goodrinh J.K., Cullender T.C. et al. Host remodeling of the gut microbiome and metabolic changes during pregnancy. Cell. 2012; 150 (3): 470–480.
- Li L., Tu J., Jiang Y. et al. Effects of lipopolysaccharide on human first trimester villous cytotrophoblast cell function in vitro. Biol. Reprod. 2015 Dec 23. pii: biolreprod.115.134627. http://www.ncbi.nlm.nih.gov/pubmed/26700943 (access date: 11.05.2016).
- Lisonkova S., Sabr Y., Mayer C. et al. Maternal morbidity associated with early-onset and late-onset preeclampsia. Obstet. Gynecol. 2014; 124 (4): 771–781.
- Malbrain M.L.N.G., De Keulenaer B.L., Oda J. et al. Intra-abdominal hypertension and abdominal compartment syndrome in burns, obesity, pregnancy, and general medicine. Anaest. Int. Ther. 2015; 47 (3): 228–240.
- Masuyama H., Segawa T., Sumida Y. et al. Different profiles of circulating angiogenic factors and adipocytokines between early- and late-onset preeclampsia. Br. J. Obstet. Gynaecol. 2010; 117 (3): 314–320.
- Na Q., Liu C.X., Cui H. et al. Successful treatment of two patients with postpartum disseminated intravascular coagulation complicated by abdominal compartment syndrome. Gynecol. Obstet. Invest. 2012; 73 (4): 337–340.
- Paramore R.H. The intra-abdominal pressure in pregnancy. Obstetrical and Gynaecological Section. Proc. R. Soc. Med. 1913; 6: 291–334.
- Pennington K.A., Schlitt J.M., Jackson D.L. et al. Preeclampsia: multiple approaches for a multifactorial disease. Disease Models & Mechanisms. 2012; 5 (1): 9–18.
- Powers R.W., Roberts J.M., Plymire D.A. et al. Low placental growth factoracross pregnancy identifies a subset of women with preterm preeclampsia; type 1 versus type 2 preeclampsia? Hypertension. 2012; 60 (1): 239–246.
- Raymond D., Peterson E. A critical review of early-onset and late-onset preeclampsia. Obstet. Gynecol. Surv. 2011; 66 (8): 497–506.
- Richter C.E., Saber S., Thung S.F. Eclampsia complicated by abdominal compartment syndrome. Am. J. Perinatol. 2009; 26 (10): 751–753.
- Sawchuck D.J., Wittmann B.K. Pre-eclampsia renamed and reframed: Intra-abdominal hypertension in pregnancy. Medical Hypotheses. 2014; 83 (5): 619–632.
- Schein M., Wittman D.H., Aprahamian C.C., Condon R.E. The abdominal compartment syndrome: the physiological and clinical consequences of elevated intra-abdominal pressure. J. Am. Col. Surg. 1995; 180 (6):745–753.
- Staelens A.S.E., Cauwelaert S.V., Tomsin K. et al. Intra-abdominal pressure measurements in term pregnancy and postpartum: An observational study. PLOS ONE. 2014; 9 (8):e104782.
- Sugerman H.J. Hypothesis: preeclampsia is a venous disease secondary to an increased intra-abdominal pressure. Med. Hypotheses. 2011; 77 (5): 841–849.
- Sun L., Li W., Sun F. et al. Intra-abdominal pressure in third trimester pregnancy complicated by acute pancreatitis: an observational study. BMC Pregnancy and Childbirth. 2015; 15: 223.
- Theodossic S.P., Nick A.M., George M. et al. Abdominal compliance, linearity between abdominal pressure and ascitic fluid volume. J. Emerg. Trauma Shock. 2011; 4 (2): 194–197.
- Valensise H., Vasapollo B., Gagliardi G., Novelli G.P. Early and late preeclampsia: two different maternal hemodynamic states in the latent phase of the disease. Hypertension. 2008; 52 (5): 873–880.
- Van Dalfsen A. Preeclampsia, intrabdominal hypertention and the renal veins. Medi.philica.com. 2011. http://www.philica.com/display _article.php?article_ id=240 (access date: 11.05.2016).
- Widmer M., Cuesta C., Khan K.S. et al. Accuracy of angiogenic biomarkers at 620 weeks’ gestation in predicting the risk of pre-eclampsia: A WHO multicentre study. Intern. J. Women’s Cardiovasc. Health. 2015; 5 (4):330–338.
- Xue P., Zheng M., Gong P. et al. Single administration of ultra-low-dose lipopolysaccharide in rat early pregnancy induces TLR4 activation in the placenta contributing to preeclampsia. PLoS One. 2015; 10 (4):e0124001.
Казанский медицинский журнал, 2016

