Обоснованность единого подхода к профилактике преэклампсии и плацентарной недостаточности
The validity of a unified approach to the prevention of preeclampsia and placental insuffucuency
Резюме
Целью исследования явилась оценка эффективности методов профилактики преэклампсии и плацентарной недостаточности с применением методологических стандартов доказательной медицины.
С применением предиктивного превентивного персонифицированного подхода у 373 беременных группы высокого риска по тяжелым формам плацентарной недостаточности и преэклампсии профилактика осложненного течения беременности проводилась низкими дозами ацетилсалициловой кислоты, препаратом магния, превентивной карбогенотерапией, последовательным применением гестагена дидрогестерона и ангиопротектора диосмина. С учетом гестационных и перинатальных исходов, произведен расчет стандартов эффективности доказательной медицины (СОР, САР, ЧБНЛ, ОШ), которые позволили определить ранговые места для апробированных методов профилактики.
Исследование показало возможность единого подхода к профилактике преэклампсии и тяжелых форм плацентарной недостаточности.
Ключевые слова: преэклампсия, плацентарная недостаточность, профилактика, низкие дозы ацетилсалициловой кислоты, магний-дефицитное состояние, дидрогестерон, диосмин, доказательная медицина
Введение
Несмотря на снижение материнской и перинатальной смертности, отмечена стабильная тенденция к увеличению числа тяжелых осложнений беременности, детерминированных морфофункциональными нарушениями в фетоплацентарной системе, особенно преэклампсии (по данным Росстата 11,1% в 1991 г., 21,6% в 2005 г. и 18,4% в 2014 г.). В структуре причин материнской смертности преэклампсия (ПЭ) занимает стабильное 2-3 место и является ведущим осложнением беременности, приводящим к неблагоприятным перинатальным исходам [1-5]. При этом ни одна из множества теорий о происхождении преэклампсия не позволила разработать надёжные методы ее профилактики, так как они основаны на коррекции отдельных звеньев патогенеза и не затрагивают истинной причины [6-11]. В связи с этим, знания о результативности единых подходов к профилактике ПЭ и тяжелых форм ПН, с учетом их персонифицированного назначения, имеют важное практическое значение.
Целью исследования явилась оценка эффективности методов профилактики преэклампсии и плацентарной недостаточности с применением методологических стандартов доказательной медицины.
Пациентки и методы. На догестационном этапе и в динамике беременности проведено клиническое и лабораторно-инструментальное обследование 373 женщин группы высокого риска по тяжелым формам ПН - I (основная) группа и 30 практически здоровых женщин с физиологическим течением гестации - II (контрольная) группа. В основную группу, для оценки эффективности методов профилактики ПЭ, были включены женщины высокого риска структурно-функциональных нарушений в эмбрио(фето) плацентарном комплексе (по декомпенсации ПН) и реализации ПЭ. Данный подход был обоснован, с одной стороны, единством механизмов формирования ПЭ и ПН, с другой стороны, тем, что беременные со структурно-функциональными нарушениями в ФПК являются группой высокого риска по ПЭ [12-16]. Отбор в I (основную) группу проводился с помощью прогностической шкалы факторов риска декомпенсации ПН [17-22]. Критерии включения в основную группу: 7 и более баллов по прогностической шкале реализации тяжелых форм ПН; обращение за 2-3 месяца до планируемой беременности или ранняя постановка на учет по беременности; информированное добровольное согласие на участие в исследовании и публикацию результатов в научной печати. Критерии исключения: многоплодная беременность, тяжелая экстрагенитальная патология, наследственные заболевания, инфекции, передаваемые половым путем, врожденные аномалии развития плода.
Беременные I группы, согласные на проведение превентивных мероприятий и отказавшиеся от них, в зависимости от имеющихся факторов риска декомпенсации ПН и профилактического средства, были распределены на следующие подгруппы: Iа – 75 женщин с нарушением с ранних сроков гестации сосудисто-тромбоцитарного звена получали низкие дозы ацетилсалициловой кислоты (АСК) (Аспирин®Кардио, Bayer Consumer Care AG, Германия) по 75 мг, per os, 1 раз в день во время еды, проведено 3 курса по 5 недель профилактических мероприятий в сроки 12-16 нед., 22-26 нед., 32-36 нед.; Iб – 72 женщины с исходным магний-дефицитным состоянием получали профилактическую монотерапию препаратом магния (Магне-В6®, Sanofi-Winthrop Industrie, Франция) в течение 3 курсов по 6 недель: первый курс – в 8-13 нед. (первые 2 недели в насыщающей дозировке по 6 табл./сутки, в последующем - в поддерживающей дозировке по 2 табл./сутки, per os, во время еды); второй и третий курс аналогично первому – в 18-23 и 28-33 нед.; Iв – 77 женщин с исходным дефицитом эндогенного карбогена и наличием факторов, предрасполагающих к снижению чувствительности дыхательного цента к углекислому газу, применяли регулируемые дыхательные тренировки (карбогенопрофилактика) путём дыхания через аппарат В.Ф. Фролова ТДИ-01 (ЕАН/ЮНИСКАН: 4903915000019, патент №1790417, разрешение МЗ РФ №311) в течение 30 минут 1раз в сутки после пробуждения, натощак, за столом, дыхание только через рот, всего проведено 4 курса с интервалом 4 недели: с 8 по 11 нед ., с 16 по 19 нед., с 24 по 27 нед., с 32 по 35 нед. беременности; Iг – 78 женщин с привычным невынашиванием в анамнезе и/или «компрометирующим» отцовским фактором получали для профилактики с 6 по 20 нед. беременности гестаген дидрогестерон (Дюфастон®, Solvay Pharma, Нидерланды) по 10 мг 2 раза в день, per os, независимо от приема пищи (с 17 по 20 нед. по 10 мг 1 раз в день – для постепенного снижения дозы препарата), затем ангиопротектор диосмин (Флебодиа 600®, Laboratoires Innothera, Франция) по 600 мг 1 раз в день, per os, натощак, с 21 по 26 и с 31 по 36 нед. гестации; Iд – 71 беременная, отказавшиеся от превентивных мероприятий.
Большей части женщин высокого риска по нарушенному формированию ФПК за 2-3 месяца до планируемого зачатия была проведена догестационная превентивная терапия после выявления имеющихся исходных предрасполагающих факторов: в Iб подгруппе у 65,3% (47 наблюдений), в Iв - у 62,3% (48); в Iг - у 80,8% (63). Превентивная терапия проводилась по тем же схемам, что и во время беременности. В Iа подгруппе периконцепционная подготовка низкими дозами АСК не проводилась, т.к. активация тромбоцитарного звена у женщин высокого риска выявляется на ранних сроках беременности в связи с формированием эмбриоплацентарной дисфункции на фоне дисбаланса комплекса факторов «физиологического повреждения» и «механизмов гестационной адаптации» [23-27], кроме того период эмбриогенеза является противопоказанием для назначения АСК. Средняя продолжительность прегравидарной подготовки составила 2,0 цикла. Кроме того, все женщины получали фолиевую кислоту по 800 мкг/сут., йодомарин по 250 мкг/сут.
Результаты обследования в динамике гестации в сроки 18-24 нед. и 28-34 нед. сопоставлялись с исходными данными обследованиями на прегравидарном этапе и в 6-11 нед., а также с референсными значениями контрольной группы и результатами обследования беременных Iд подгруппы. В крови женщин методами иммуноферментного, иммунофлюоресцентного, биохимического анализов определялось содержание маркеров эндотелиально-гемостазиологической дисфункции – общий IgE, циркулирующие эндотелиальные клетки (ЦЭК), количество тромбоцитов, их адгезивные свойства и максимальная амплитуда агрегации (МААТ), фибронектин (ФН); апоптоза и воспалительного ответа – лимфоциты с фенотипом CD95+ (Л CD95+) и фактор некроза опухоли альфа (ФНОα); децидуализации стромальных клеток – плацентарный α-1 микроглобулин (ПАМГ); клеточной пролиферации (ангиогенеза) и плацентарного энергообеспечения – фактор роста плаценты (ФРП) и плацентарная щелочная фосфатаза (ПЩФ); модуляции иммунного ответа – плацентарный белок РАРР-А. Производился общий анализ крови с дифференциально-критериальной оценкой цитограммы с расчетом интегральных коэффициентов - лейкоцитарных индексов реактивности (ИСЛК - индекс сдвига лейкоцитов крови, ИА - индекс аллергизации). Концентрация магния в сыворотке крови определялась фотоэлектроколориметрическим способом (СФ-26; Magnesium XB, «Biocom», Германия), внутриэритроцитарного магния – по методу Holtmeiera H.J (1998). Концентрация углекислого газа в капиллярной крови определялась газовым анализатором GEM Premier 3000 (Instrumentation Laboratory, США). Количество тромбоцитов определялось на автоматическом счетчике «Тrombocounter» (Франция), агрегация тромбоцитов – на агрегометре Payton (США), адгезивные свойства - по ЛИПК (определялось количество и процент адгезированных тромбоцитов, индекс адгезии). Количество ЦЭК определяли по методу Н.Н. Петрищева (2001) [24 -29].
К тяжелым формам ПН были отнесены все наблюдения декомпенсированной, прогрессирующей декомпенсированной и критической ПН, сопровождающиеся нарушением состояния плода (ЗРП, ХГП), т.к. недостаточность функции плаценты была рассмотрена с точки зрения перинатального аспекта - возможности этого провизорного органа обеспечивать адекватное развитие плода. Диагностика ПН и степени её тяжести проводилась по оценочной шкале с расчетом итогового показателя [25], учитывались результаты УЗИ ФПК, УЗДГ, КТГ. Применялась ультразвуковая система GE Voluson S6 (GE Healthcare, США), фетальный монитор «Corometrics-259» (Индия). Оценку РСССП проводили по И.С. Сидоровой (2005), ИПСП регистрировался на кардиотокографе АУСП-1 («Уникос»). Морфологическое исследование плацент проводилось с учетом критериев А.П. Милованова (2005). В работе использованы методы дескриптивной статистики, корреляционного анализа в параметрическом и непараметрическом вариантах, доказательной медицины, программа Statistica 6.0. Для объективизации оценки эффективности профилактических мероприятий использованы методологические стандарты доказательной медицины [30-37].
Результаты исследования и их обсуждение. В 1д подгруппе ПН реализовалась в 100% (71 наблюдение), в том числе тяжелые формы – в 87,3±8,5% (ЗРП - в 69±7,3% (49), ХГП – в 83,1±8,4% (59)); ПЭ различной степени тяжести – в 52,1±5,6% (37), тяжелая ПЭ – в 19,7±2,5% (14). Внутригрупповой анализ (n=71) результатов лабораторного тестирования, с учетом клинической реализации в виде ранней ПЭ (до 34 нед. гестации, n=26 (36,6±5,1%)) и поздней ПЭ (n=11 (15,5±2,3%)), тяжелых форм ПН, и физиологической гестации (n=30) выявил более ранние (уже ко II триместру) и более выраженные изменения при ранней ПЭ; при поздней ПЭ эти изменения были менее выражены, приближались к значениям, полученным при реализации тяжелых форм ПН, проявлялись к III триместру. Направленность изменений изученных показателей гомеостаза представлена графически на рисунке 1.
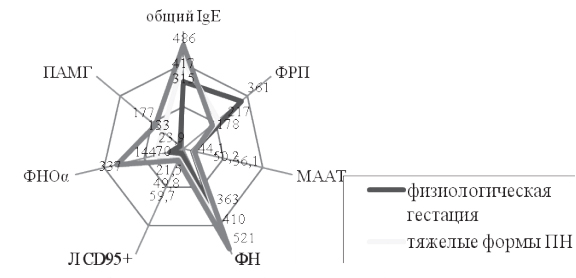 |
| Рис. 1 Показатели, объективизирующие механизмы формирования тяжелых форм ПН и сочетанной реализации ПЭ и ПН |
Динамическая количественная объективизация ведущих механизмов развития ПЭ и ПН показала однонаправленность изменений при изолированной реализации тяжелых форм ПН (n=34) и при сочетанной реализации тяжелых форм ПН и ПЭ (n=37), заключающихся в нарастании отклонений маркеров эндотелиально-гемостазиологической дисфункции, плацентарного ангиогенеза и энергообеспечения, децидуализации, индуцированной трофобластом запрограммированной клеточной гибели иммунокомпетентных клеток, гестационной иммуномодуляциии, дефицита эндогенного карбогена и внутриклеточного магния, общего реактивного потенциала организма. Наиболее ранние изменения и значимые ассоциативные связи (k от 0,51 до 0,93) при лабораторном тестировании выявлялись за 4-6 нед. до клинической манифестации ПЭ. При анализе результатов лабораторного обследования беременных с применением тестов клинической эпидемиологии высокую прогностическую значимость показал диагностический комплекс, включающий определение ЦЭК, ФН, Л CD95+, ПАМГ, МААТ. При значениях данных показателей за 4-6 нед. до манифестации ПЭ: ЦЭК - 4,4±0,22×105 кл/л; ФН - 435±19 мкг/мл, ПАМГ - 103,9±13,9 нг/мл, Л CD95+ - 61,1±5,1%, МААТ - 40,1±1,8% - их можно расценивать в качестве предикторов данного осложнения беременности. Это позволяет рекомендовать необходимый минимум тестов с наибольшей диагностической значимостью: ЦЭК, ФН, ПАМГ, при возможности углубленной диагностики - ЦЭК, ФН, ПАМГ, Л CD95+, МААТ (Se=92,1%, Sp=90,6%, +РV=89,7%, -РV=96,8%, Р=92,2%). Возможность регистрации предикторов ПЭ обосновывает своевременное дифференцированное назначение превентивных мероприятий, а, следовательно, предиктивный и превентивный подход к ведению беременных высокого риска по тяжелым формам ПН и ПЭ.
Целенаправленным отбором в Iа подгруппу были отнесены беременные с исходными нарушениями в сосудисто-тромбоцитарном звене (количество и процент адгезированных тромбоцитов – 48,1±4,1 тыс. и 26,3±1,8%, МААТ - 39,8±3,6%), имеющие достоверные отличия от контроля (р<0,05). В Iб подгруппу были включены женщины с исходным дефицитом магния как в сыворотке крови, так и внутриэритроцитарного (0,69±0,04 ммоль/л и 1,45±0,12 ммоль/л соответственно), что достоверно ниже референсных значений (р<0,05). Iв подгруппу составили женщины с исходным дефицитом эндогенного карбогена (5,1±0,04 об.% против 6,7±0,02 об.% в контроле, р<0,05).
Ретроспективный анализ результатов исследования функционального состояния тромбоцитов в сроки 18-24 и 28-34 нед. у беременных Iа подгруппы показал нормализацию их количества, адгезивных и агрегационных свойств (МААТ – 34,1±1,2% и 45,5±1,4% соответственно срокам) у женщин с наличием эффекта от проводимого профилактического лечения (69,3% - 52 наблюдения) и достоверные отличия от аналогичных показателей 1д подгруппы (МААТ – 38,2±1,7% и 53,2±1,8%), что доказывает эффективность низких доз АСК в качестве профилактического агента у беременных с исходными нарушениями в тромбоцитарном звене. У беременных с реализацией ПЭ (30,7% - 23) активация кровяных пластинок сохранялась (МААТ - 39±1,3% и 55,9±1,9%) с достоверным отличием от контрольных значений, что подтверждает патогенетическую связь нарушений функционального состояния тробоцита и эндотелиоцита и их роль в реализации ПЭ [27-30].
Эффективность коррекции магниевого дефицита жестко коррелировала (k 0,85-0,91) с эффективностью профилактических мероприятий в отношении ПЭ у беременных 1б подгруппы. При отсутствии реализации ПЭ (66,7% - 48) в 18-24 нед. концентрация сывороточного магния составила 0,96±0,08 ммоль/л (при исходном – 0,69±0,04 ммоль/л), внутриэритроцитарного – 1,81±0,13 ммоль/л (при исходном – 1,45±0,12 ммоль/л) - p<0,05, что подтверждает значение магний-дефицитного состояния в реализации осложненного течения гестации [4]. Следует отметить, что во всех наблюдениях реализации ПЭ в 1б подгруппе (33,3% - 24) отсутствовала прегравидарная подготовка и полная коррекция магний-дефицитного состояния, несмотря на курсовую профилактику препаратом магния с ранних сроков гестации.
Динамическая оценка уровня эндогенного карбогена у беременных Iв подгруппы, применявших карбогенопрофилактику, при эффективности мероприятий (80,5% - 62) показала, что уже с 18-24 нед. средняя концентрация эндогенного карбогена составила 6,0±0,08 об.% и достоверно не отличалась от контроля (p>0,05). При результативной карбогенопрофилактике в 28-34 нед. показатель эндогенного карбогена составил 7,1±0,07 об.%, что превышало значение контроля (6,1±0,03 об.%) в 1,2 раза. Анализ неудач профилактики ПЭ в данной подгруппе (19,5% -15) выявил, что все случаи реализации ПЭ касаются наблюдений без периконцепционной подготовки (при начале карбогенопрофилактики с ранних сроков гестации) и сохранении дефицита эндогенного углекислого газа на доклинической стадии реализации ПЭ (в 18-24 нед. - 5,7±0,07 об.% против 6,4±0,05 об.% в группе контроля - p<0,05). Исследование эритроцитарного звена у беременных данной подгруппы указало на возможную стимуляцию эритропоэза превентивной карбогенотерапией, что подтверждается нарастанием уровня гемоглобина, количества эритроцитов и цветового показателя в крови беременных в течении гестации, что также объясняет механизмы профилактики тяжелых осложнений гестации и согласуется с полученными результатами других исследователей [10].
Сравнительная оценка исходов беременностей у женщин, которым проводилось персонифицированное профилактическое лечение, с исходами у беременных, отказавшихся от профилактической терапии, показала достоверные отличия по частоте реализации ПЭ, ПН, ЗРП, ХГП, по степени тяжести данных осложнений и срокам их манифестации (см. таблицу 1).
| Таблица 1 Частота реализации основных осложнений беременности и состояние новорожденных у женщин подгрупп сравнения (M ± δ, %; абс.ч.) |
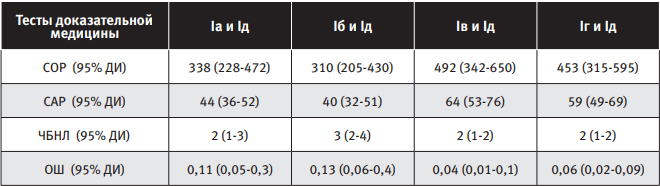 |
*- разница достоверна относительно Iд подгруппы (p<0,05)
Частота развития ПЭ у беременных высокого риска по тяжелым формам ПН существенно отличалась, в зависимости от использованного превентивного агента, и составила в Iа подгруппе – 30,7±3,5% (23 наблюдения), что в 1,7 раза реже, чем в Iд подгруппе; в Iб – 33,3±3,7% (24), что 1,6 раза реже, чем в Iд подгруппе; в Iв – 19,5±2,7% (15), что в 2,7 раза реже, чем в Iд подгруппе; в I г – 23,1±2,8% (18), что реже в 2,3 раза, чем в Iд подгруппе; в Iд - 52,1±5,6% (37). Причем, наиболее часто тяжелые формы ПЭ реализовались в Iд подгруппе - 19,7±2,5% - среди женщин, отказавшихся от проведения превентивных мероприятий, что чаще, по сравнению с подгруппами Iа (8,0±1,8%), Iб (11,1±2,0%), Iв (1,3%), Iг (3,9±1,3%), в 2,5, 1,8, 15,2, 5,2 раза соответственно (p<0,05). В большинстве наблюдений в Iд подгруппе тяжелая ПЭ имела ранние сроки манифестации (до 34 нед.) – 15,5% против 4,2% (после 34 нед. гестации).
Минимальная частота реализации ранней ПЭ отмечена в Iв и 1г подгруппах женщин, использовавших карбогенопрофилактику и дидрогестерон с диосмином, и составила 1,3% (1) и 1,3% (1), что в 2,1, 4,3, 28,2 раза реже, чем в Iа, Iб, Iд подгруппах соответственно (p<0,05). Средняя частота ранней ПЭ в подгруппах с превентивным лечением составила 2,6 %, что в 14,1 раза реже, чем в Iд подгруппе беременных (36,6±5,1%), отказавшихся от каких-либо профилактических мероприятий. Следовательно, персонифицировано подобранное превентивное лечение снижает не только частоту реализации тяжелой ПЭ, но и вероятность ее ранней манифестации, что существенно улучшает прогноз для плода. Частота реализации ПЭ, ее тяжелых форм и тяжелых форм ПН была достоверно ниже в подгруппах с профилактическим лечением (в 2,7 раза, 15,2 раза, в 3,7 раза - соответственно), чем у беременных, отказавшихся от превентивных мер.
Полученные данные с помощью ультразвуковых методов обследования ФПК показали, что наибольшее фетопротекторное действие оказал метод превентивной карбогенотерапии, при котором патологии плода выявлено в 6,4 раза меньше, чем в Iд подгруппе. Следующим по результативности явился метод, заключающийся в последовательном приеме гестагена дидрогестерона и ангиопротектора диосмина: патологии плода выявлено в 5 раз меньше. Частота нарушенного состояния плода у беременных, применявших низкие дозы АСК, была в 2,7 раза ниже, а у женщин, принимавших препарат магния - в 2,3 раза ниже.
Анализ показателей, характеризующих состояние новорожденных, показал, что частота задержки роста и асфиксии среди новорожденных от матерей, которым в антенатальном периоде была проведена превентивная терапия, была в 3,3 раза и в 3,5 раза ниже, чем в 1д подгруппе. Гипоксически-ишемическое поражение ЦНС чаще отмечалось у детей в подгруппе женщин, отказавшихся от профилактического лечения, и составило 14%, против 3% в подгруппах с превентивным лечением. Нарушение адаптации у детей от матерей с профилактическими мероприятиями отмечалось в 2,5 раза реже чем у детей в Iд подгруппе. Перевод детей на второй этап лечения у женщин, применявших персонализированную превентивную терапию, отмечался также достоверно реже, чем в Iд подгруппе. Плодово-плацентарный, масса-ростовой коэффициенты и уровень компенсаторных реакций в плаценте показали лучшие результаты в подгруппе с карбогенопрофилактикой. Близким по результатам был метод профилактики с последовательным приемом дидрогестерона и диосмина.
Стандарты доказательной медицины подтвердили эффективность всех методов профилактики ПЭ в группах высокого риска по тяжелым формам ПН и позволили распределить их в порядке от более эффективных к менее: на первом месте, при учете персонализированного и предикторного назначения, оказался метод карбогенопрофилактики; на втором – метод с последовательным назначением дидрогестерона и диосмина; на третьем – применение низких доз АСК; на четвертом - использование препарата магния (см таблицу 2).
| Таблица 2 Эффективность методов профилактики ПЭ и тяжелых форм ПН в подгруппах сравнения |
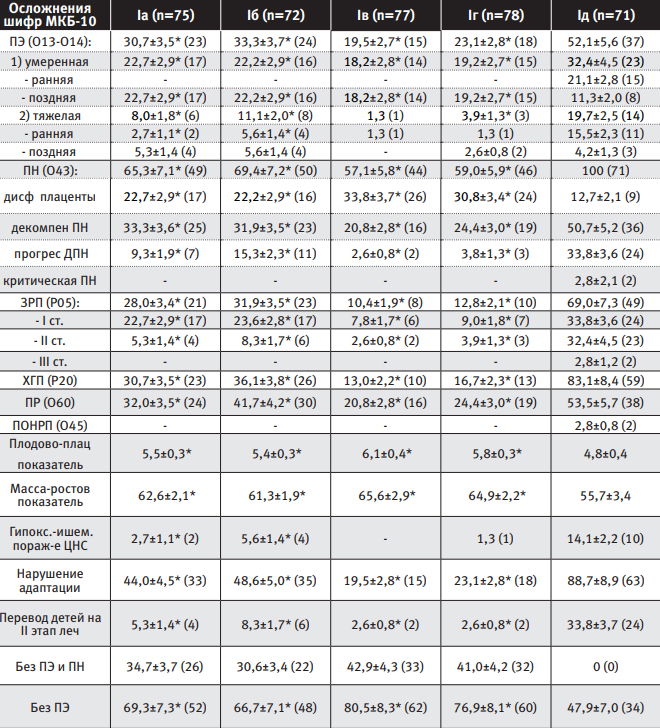 |
Высокая эффективность превентивной легкой кратковременной гиперкапнии связана с активацией кровообращения, в том числе в системе «мать-плацента-плод», повышением эффективности захвата транспорта кислорода, стабилизацией тонуса и проницаемости стенок сосудов, нормализацией баланса газового состава и буферной системы крови, стимуляцией эритропоэза с одновременным возрастанием энергообеспечения клеток [7, 10]. В объяснении высокой эффективности метода карбогенопрофилактики важным является то, что у 62,3% женщин данной подгруппы ранние сроки беременности, как наиболее важные в силу значимости гестационных событий в I-II триместрах (имплантация, органогенез, I и II волны инвазии цитотрофобласта, плацентация), протекали на фоне уже частично скорректированных изменений гомеостаза, обусловленных дефицитом эндогенного карбогена и патологией экстрагенитальных и репродуктивных систем. Кроме того, считаем необходимым подчеркнуть, что данный метод сводит к минимуму фармакологическую нагрузку на мать и плод при сохранении максимальной эффективности профилактики.
Высокую профилактическую эффективность также показал метод последовательного применения гестагена дидрогестерона и ангиопротектора диосмина у беременных высокого риска по эмбрио(фето) плацентарной недостаточности с привычным невынашиванием в анамнезе и/или «компрометирующим» отцовским фактором. Высокая результативность метода, на наш взгляд, связана с тем, что прием дидрогестерона, обладающего гормональным и иммуномодулирующим влиянием, на прегравидарном этапе и в ранние сроки беременности вызывает необходимую степень децидуальных превращений эндометрия, обуславливает оптимальную имплантацию, способствует развитию и росту миометрия и его васкуляризации, оптимизирует перестройку маточно-плацентарных сосудов, блокирует опосредованную через Т-лимфоциты реакцию отторжения плода, под его влиянием иммунокомпетентные клетки синтезируют прогестерон-индуцированный блокирующий фактор, увеличивающий продукцию регуляторных цитокинов и, напротив, блокирующий продукцию провоспалительных цитокинов, дидрогестерон перестраивает иммунобиологический надзор с формированием активной иммунологической толерантности, что немаловажно для нивелирования иммуногенетической предрасположенности при высоком риске ПЭ [6]. Поскольку нарушение функционирования ФПК может произойти на любом сроке беременности, после окончания приема дидрогестерона профилактическая терапия продолжалась путем применения ангиопротектора диосмина, который оказывает флеботонизирующее действие, уменьшает венозный застой, улучшает лимфатический дренаж, улучшает микроциркуляцию путем повышения резистентности и уменьшения проницаемости капилляров, уменьшает адгезию лейкоцитов и их миграцию в сосудистую стенку, улучшает диффузию и перфузию кислорода, обладает противовоспалительным действием, блокирует выработку свободных радикалов, синтез простагландинов и тромбоксана. Помимо этого диосмин улучшает дренажную функцию межворсинчатого пространства, венозных сосудов матки, малого таза и нижних конечностей [9, 10].
Профилактический эффект от приема низких доз АСК у беременных с исходным нарушением тромбоцитарного звена гемостаза связан с нормализацией функциональных свойств тромбоцитов, состояния сосудистого эндотелия. Эндотелиально-гемостазиологическая дисфункция при ПЭ формируется еще на доклинической стадии. Эндотелиоциты и тромбоциты являются эффективными триггерами иммуновоспалительной реакции, которые на микроциркуляторном уровне инициируют воспаление и гемокоагуляцию. Поэтому назначение низких доз АСК беременным высокого риска является обоснованным с точки зрения патогенетических механизмов формирования ПЭ и ПН. Сниженную эффективность данного метода (у 30,7% беременных высокого риска) можно объяснить противопоказанием к применению АСК в I триместре беременности, когда формируется гемохориальный тип плацентации и маточно-плацентарное кровообращение, проходит процесс первой волны инвазии цитотрофобласта [3, 10].
Эффект от превентивного применения препарата магния связан с тем, что при восполнении дефицита происходит коррекция нарушенных процессов, обеспечивающих адекватный кровоток в системе «мать-плацента-плод». Известно, что в условиях магний-дефицитного состояния нарушается трансмембранный потенциал клетки, её энергетическое обеспечение. Являясь антагонистом кальция, магний блокирует медленные кальциевые каналы, что нарушает механизм спазмолитического действия. Недостаток Mg++ тормозит выработку простациклина и монооксида азота, увеличивает активность тромбоксана 2, что провоцирует дисфункцию эндотелия сосудов. Дефицит магния нарушает работу аденилатциклазной системы, усиливает внутрисосудистую агрегацию тромбоцитов, нарушает ретракцию тромбоцитарнофибринового сгустка. Во время беременности дефицит магния провоцирует обострение ЭГП, нарушение деятельности ЦНС, изменение иммунологической реактивности организма, что особенно значимо для женщин высокого риска по ПЭ [4, 8]. Отсутствие эффективности препарата магния в отношении реализации ПЭ, особенно её тяжелых форм, в 33,3% наблюдений можно объяснить недостаточным восполнением дефицита магния на прегравидарном этапе и во время беременности.
Выводы
- При сочетанной реализации тяжелых форм ПН и ПЭ выявлена общая направленность патологических процессов и значимая ассоциативная связь между объективными количественными характеристиками плацентарного ангиогенеза и энергообеспечения, функции сосудистого эндотелия, системы гемостаза, децидуализации, апоптоза, общего реактивного потенциала, иммунных процессов и исходными изменениями – структурно-функциональными нарушениями в эмбрио(фето)плацентарном комплексе, недостатком эндогенного карбогена, магний-дефицитным состоянием, активацией тромбоцитарного звена, что доказывает патогенетическую связь ПН и ПЭ и обосновывает возможность дифференцированного подбора профилактического агента.
- Результативность превентивной терапии ПЭ у беременных высокого риска по нарушенному формированию ФПК определяется сроками ее начала. При сопоставлении эффективности профилактических мероприятий, включающих периконцепционную подготовку, с превентивными мероприятиями, начатыми в период гестации, доказано, что все наблюдения тяжелой ПЭ реализовались при отсутствии прегравидарного этапа превентивного лечения. Периконцепционное действие профилактических агентов нормализует ключевые гестационные процессы (нидация, плацентация, инвазия), предопределяющие последующее течение беременности.
- По степени эффективности методы профилактики ПЭ, согласно методологическим стандартам доказательной медицины, распределились следующим образом: на первом месте - метод карбогенопрофилактики (ЧБНЛ=2 (95% ДИ 1-2); ОШ=0,04 (95%ДИ 0,01-0,1)); на втором – метод с последовательным назначением дидрогестерона и диосмина (ЧБНЛ=2 (95%ДИ 1-2); ОШ=0,06 (95%ДИ 0,02-0,09)); на третьем – применение низких доз ацетилсалициловой кислоты (ЧБНЛ=2 (95%ДИ 1-3); ОШ=0,11 (95%ДИ 0,05-0,3)); на четвертом - использование препарата магния (ЧБНЛ=3 (95%ДИ 2-4); ОШ=0,13 (95% ДИ 0,06-0,4)). Методы профилактики ПЭ эффективны и в отношении ПН, что обосновывает возможность единого подхода к профилактике данных осложнений гестации.
Литература
- Липатов И.С., Тезиков Ю.В., Рябова С.А., Фролова Н.А., Табельская Т.В. Оценка церебральной гемодинамики плода при плацентарной недостаточности с учетом его суточного биоритмостаза // Российский вестник акушера-гинеколога. - 2015. - Т.15, №4. - С. 42-48.
- Тезиков Ю.В., Липатов И.С., Мельников В.А., Плохова В.А. Патоморфологические особенности состояния яичников при беременности // Российский вестник акушера-гинеколога. - 2010. - Т. 10, №4. - С. 50-57.
- Тезиков Ю.В., Мельников В.А., Липатов И.С. Новые подходы к ведению беременных женщин с плацентарной недостаточностью // Вестник Волгоградского государственного медицинского университета. - 2010. - №2. - С. 64-67.
- Мельников В.А., Купаев И.А., Липатов И.С. Противососудистые антитела у женщин с физиологической и осложненной гестозом беременностью // Акушерство и гинекология. - 1992. - №3-7. - С. 19.
- Липатов И.С., Тезиков Ю.В., Приходько А.В., Кутузова О.А. Оценка лактогенеза и прогнозирование ранней гипогалактии кристаллографическим методом // Российский вестник акушера-гинеколога. - 2016. - Т.16, №1. - С. 57-64.
- Тезиков Ю.В., Липатов И.С. Результаты применения карбогенотерапии для профилактики плацентарной недостаточности //Российский вестник акушера-гинеколога. - 2011. - Т. 11, №5. - С. 71-77.
- Липатов И.С., Тезиков Ю.В., Санталова Г.В., Овчинникова М.А. Профилактика рецидивов герпетической инфекции у беременных и внутриутробного инфицирования плода вирусом простого герпеса // Российский вестник акушера-гинеколога. - 2014. - Т.14, №4. - С. 63-68.
- Стрижаков А.Н., Тезиков Ю.В., Липатов И.С., Агаркова И.А., Иванова И.В. Клиническое значение индуцированного трофобластом апоптоза иммунокомпетентных клеток при осложненном течении беременности // Вопросы гинекологии, акушерства и перинатологии. - 2011. - Т. 10, №6. - С. 26-31.
- Тезиков Ю.В., Липатов И.С., Санталова Г.В., Валеева Г.Р., Дремлюга Н.М., Козлова И.В. Прикладные аспекты иммунологической толерантности в системе «мать-плод» // Уральский медицинский журнал. - 2009. –Т. 64, №10. - С. 121.
- Тезиков Ю.В., Липатов И.С. Предикторные индексы тяжелых форм хронической плацентарной недостаточности // Медицинский альманах. - 2011. - №6. - С. 60-63.
- Тезиков Ю.В., Липатов И.С., Есартия М.А., Салов В.В. Становление лактации у женщин с плацентарной недостаточностью и новые подходы к лечению гипогалактии // Уральский медицинский журнал. - 2010. - №3 (68). - С. 42-48.
- Липатов И.С., Мельников В.А., Тезиков Ю.В. Оценка степени тяжести плацентарной недостаточности у беременных // Российский вестник акушера-гинеколога. - 2008. - Т.8, №5. - С. 38-43.
- Кравченко Ю.Л., Липатов И.С., Данилова Н.Н., Топорова И.Б., Тезиков Ю.В., Крылова О.Л. Аспекты профилактики социальных и экологических факторов риска перинатальной смертности в условиях городской клинической больницы крупного промышленного города // Человек и Вселенная. -2006. - Т.56, №3. - С. 119.
- Липатов И.С., Тезиков Ю.В., Есартия М.А. Прогнозирование и коррекция нарушений лактационной функции с использованием видимого инфракрасного поляризованного света на этапе лактогенеза // Российский вестник акушера-гинеколога. - 2008. - Т.8, №2. - С. 30-36.
- Стрижаков А.Н., Тезиков Ю.В., Липатов И.С., Шарыпова М.А., Анпилогова И.В., Азизов К.У., Костянова Е.В. Стандартизация диагностики и клиническая классификация хронической плацентарной недостаточности // Вопросы гинекологии, акушерства и перинатологии. - 2014. - Т. 13, № 3. - С. 5-12.
- Тезиков Ю.В., Липатов И.С. Прогнозирование и диагностика тяжелых форм плацентарной недостаточности // Акушерство и гинекология. - 2012. - №1. – С. 35-42.
- Стрижаков А.Н., Липатов И.С., Тезиков Ю.В. Комплексная оценка степени тяжести хронической плацентарной недостаточности //Акушерство и гинекология. - 2012. - № 3. – С. 20-25.
- Стрижаков А.Н., Тезиков Ю.В., Липатов И.С., Агаркова И.А., Шарыпова М.А. Патогенетическое обоснование диагностики и догестационной профилактики эмбриоплацентарной дисфункции // Вопросы гинекологии, акушерства и перинатологии. - 2012. - Т. 11, № 1. - С. 5-10.
- Потапова И.А., Пурыгин П.П., Липатов И.С., Белоусова З.П., Якимова Н.А., Тезиков Ю.В., Селезнева Е.С. Синтез и биологическая активность алифатических и ароматических сульфокислот // Химико-фармацевтический журнал. - 2001. - Т.35, №11. - С. 5-7.
- Тезиков Ю.В., Липатов И.С., Агаркова И.А. Факторы риска декомпенсации плацентарной недостаточности // Казанский медицинский журнал. - 2011. - Т. 92, №3. - С.372-375.
- Липатов И.С, Тезиков Ю.В. Прогнозирование плацентарной недостаточности на основе маркеров эндотелиальной дисфункции, децидуализации, апоптоза и клеточной пролиферации // Саратовский научно-медицинский журнал. - 2011. –Т.7, №1. - С. 52-59.
- Липатов И.С., Тезиков Ю.В., Санталова Г.В., Валеева Г.Р., Кондорова Е.А. Прогнозирование внутриутробного инфицирования плода у беременных женщин с хроническим течением герпетической инфекции // Вестник Российского университета дружбы народов. Серия: Медицина. - 2009. - №4. - С. 38-41.
- Тезиков Ю.В., Липатов И.С., Мельников В.А., Салов В.В., Минеева Е.Л., Анпилогова И.В., Меликбекян А.С., Валеева Г.Р. Прогностическая значимость методов диагностики плацентарной недостаточности и состояния плода // Уральский медицинский журнал. - 2009. - №3 (57). - С. 33-40.
- Липатов И.С., Тезиков Ю.В., Протасов А.Д., Мартынова Н.В., Калинкина О.Б., Приходько А.В., Зубковская Е.В., Жернакова Е.В. Пути оптимизации лечения осложненной эктопии шейки матки у нерожавших женщин // Лечение и профилактика. – 2017. - №2 (22). – С. 14-21.
- Тезиков Ю.В., Липатов И.С., Калинкина О.Б. Оформление клинической истории болезни у гинекологической больной: учебное пособие. – Самара: ООО «СамЛюксПринт», 2016. – 64 с.
- Липатов И.С., Тезиков Ю.В. Общая симптоматология и методы обследования в гинекологии. Вопросы этики и деонтологии: учебное пособие. – Самара: ООО «СамЛюксПринт», 2016. – 138 с.
- Липатов И.С., Тезиков Ю.В., Краснова Н.А. Оформление клинической истории родов: учебное пособие. – Самара: ООО «СамЛюксПринт», 2016. – 70 с.
- Рябова С.А., Тезиков Ю.В., Липатов И.С. Результаты клинической апробации комплексной балльной шкалы оценки степени тяжести хронической плацентарной недостаточности // Известия Самарского научного центра Российской академии наук. – 2015. – Т.17, №2-2. – С. 71-75.
- Мартынова Н.В., Липатов И.С., Тезиков Ю.В., Овчинникова М.А., Рябова С.А. Осложнения беременности и родов у женщин с генитальным эндометриозом // Современные проблемы науки и образования. – 2017. - №1. – С. 28.
- Тезиков Ю.В., Липатов И.С., Фролова Н.А., Мартынова Н.В. Лабораторный контроль эффективности профилактики больших акушерских синдромов низкими дозами ацетилсалициловой кислоты // Гематология и трансфузиология. – 2016. – Т. 61, № S1(1). – С. 182-183.
- Липатов И.С., Тезиков Ю.В., Мартынова Н.В., Блюмина И.З., Зубковская Е.В., Севостьянова С.А. Сохранение репродуктивной функции при шеечной беременности путем применения эмболизации маточных артерий // Современные проблемы науки и образования. – 2016. - №6. – С. 8.
- Липатов И.С., Тезиков Ю.В., Мартынова Н.В., Протасов А.Д., Букреева А.А. Содержание ангиогенных факторов, маркеров апоптоза и пролиферации у новорожденных от матерей с синдромом плацентарной стимуляции яичников // // Современные проблемы науки и образования. – 2016. - №5. – С. 49.
- Тезиков Ю.В., Липатов И.С., Мартынова Н.В., Протасов А.Д., Жернакова Е.В. Клинико-патогенетические особенности течения ранних сроков гестации у женщин с генитальным эндометриозом // Современные проблемы науки и образования. – 2017. - №2. – С. 84.
- Тезиков Ю.В., Липатов И.С., Фролова Н.А., Кутузова О.А., Приходько А.В., Рябова С.А. Информативность предикторов больших акушерских синдромов у беременных с эмбриоплацентарной дисфункцией // Аспирантский вестник Поволжья. – 2015. - №5-6. – С. 48-55.
- Приходько А.В., Липатов И.С., Тезиков Ю.В., Мартынова Н.В., Мингалиева Л.К. Оценка эффективности превентивного комплекса у родильниц высокого риска ранней гипогалактии методологическими стандартами доказательной медицины // Аспирантский вестник Поволжья. – 2017. - №1-2. – С. 28-34.
- Рябова С.А., Тезиков Ю.В., Липатов И.С. Клиническая реализация ассоциированной с плацентарной недостаточностью патологии плода у беременных группы высокого риска // Аспирантский вестник Поволжья. – 2016. - №5-6. – С. 79-83.
- Приходько А.В., Тезиков Ю.В., Липатов И.С. Клиническая оценка физиологического и патологического лактогенеза // Аспирантский вестник Поволжья. – 2016. - №5-6. – С. 74-78.

