Стратификация беременных по степени риска с применением предикторных индексов
Ю.В. Тезиков1, И.С. Липатов1, О.Б. Калинкина1, Т.А. Тезикова2, В.Н. Ракитина2, Н.В. Мартынова1, Л.К. Мингалиева1, А.Д. Добродицкая1
1 Самарский государственный медицинский университет
2 Самарская областная клиническая больница им. В.Д. Середавина, РФ
Реферат
Статья посвящена оценке прогностической значимости предикторных индексов, отражающих состояние основных биологических систем, участвующих в формировании эмбрио(фето)плацентарных нарушений и больших акушерских синдромов. В результате проведенного исследования для прогнозирования больших акушерских синдромов (ПН, ПЭ, ПОНРП, ПР), с применением тестов клинической эпидемиологии – чувствительности, специфичности, предсказательной ценности положительного и отрицательного результатов, диагностической точности, выделены информативные предикторные индексы (ПИ1= ФРП/ФНОα x 100; ПИ2= ПАМГ/ФРП x 100; ПИ3= Л CD95+/ПЩФ x 100), отражающие степень нарушений различных компенсаторных и защитно-приспособительных процессов в ФПК и системной дисфункции. Высокая прогностическая значимость предлагаемых предикторных индексов позволяет рекомендовать их для широкого практического применения.
Ключевые слова: большие акушерские синдромы, предикторные индексы, апоптоз, ангиогенез, плацентарный фактор роста, плацентарная щелочная фосфатаза, плацентарный альфа-1 микроглобулин, фактор некроза опухоли
Введение
По данным ВОЗ, преэклампсия (ПЭ), плацентарная недостаточность (ПН) с задержкой роста (ЗРП) и хронической гипоксией плода (ХГП), преждевременные роды (ПР), преждевременная отслойка нормально расположенной плаценты (ПОНРП), акушерские кровотечения являются ведущими причинами материнской и перинатальной заболеваемости и смертности [1-3]. По данным Росстата, в последние годы отмечается отчетливая тенденция к увеличению числа случаев тяжелых форм гестационных осложнений, связанная со снижением общего уровня здоровья беременных в России, активным внедрением вспомогательных репродуктивных технологий для достижения беременности, социальными факторами (планирование беременности женщинами старшей возрастной группы), отсутствием или несвоевременной профилактики, поздней диагностикой, отсутствием эффективных методов терапии [4-6].
Данные продолжительных многоцентровых исследований свидетельствуют о том, что многие патофизиологические изменения развиваются с ранних сроков беременности [7-9]. При всем многообразии в настоящее время нет ни одного идеального маркера синдрома патологической беременности (высокочувствительного и специфического, который играл бы центральную роль в патогенезе; появлялся рано, задолго до клинической манифестации; коррелировал со степенью тяжести; не обнаруживался при физиологической беременности) [10-12].
В последние годы в развитии гестации важная роль отводится оптимальному влиянию факторов роста и запрограммированной клеточной гибели, сбалансированному функциональному состоянию сосудистого эндотелия, стромальных клеток децидуальной оболочки, системы гемостаза и энергообмену в плаценте [13, 14]. Благодаря расширению диагностических возможностей для выявления синдрома патологической беременности, а также в связи с получением новых данных о механизмах регуляции функций плаценты появилась возможность внести существенные дополнения в вопросы патогенетического обоснования прогнозирования и тактики ведения беременных высокого риска [15-17].
Учитывая общность большинства патогенетических механизмов формирования основных «классических» осложнений беременности, объединенных вследствие этого в большие акушерские синдромы (ПЭ, ПОНРП, ПН, ЗРП, ХГП, ПР), различная клиническая реализация которых связана с индивидуальным иммуногенетическим и метаболическим статусом, а также влиянием различных экзогенных повреждающих факторов (инфекция, физические и химические агенты, профессиональные, экстрагенитальные заболевания и др.), в настоящее время поиск предикторов (ПИ) идет не по пути выделения отдельных маркеров того или иного патогенетического звена (PAAPP-A, PP-13, HbF, ПАМГ, эндоглин, ФРП, СЭФР, растворимый тирозинкиназный рецептор СЭФР, УЗДГ маточных артерий в 12-14 нед), а разработки предикторных индексов, объединяющих интегральные характеристики основных биологических систем [1821]. При этом следует отметить, что исследователи часто ограничиваются выделением прогностических критериев без должной оценки их прогностической значимости с применением стандартов доказательной медицины.
Цель исследования - оценка прогностической значимости предикторных индексов, отражающих состояние основных биологических систем, участвующих в формировании структурно-функциональных нарушений эмбрио(фето)плацентарного комплекса и больших акушерских синдромов, для разработки оптимальных практических рекомендаций.
Методы исследования
С применением прогностической шкалы факторов риска структурно-функциональных нарушений эмбрио(фето)плацентарной системы [12, 15], была сформирована группа для проспективного наблюдения, состоящая из 140 беременных женщин, которым в 6-12, 18-24, 28-34 нед гестации проведено определение в крови содержания маркера клеточной пролиферации – фактора роста плаценты (ФРП – разновидность сосудисто-эндотелиального фактора роста); децидуализации стромальных клеток – плацентарного альфа-1-микроглобулина (ПАМГ – плацентарный белок, характеризующий состояние материнской части плаценты, регулятор биоактивности инсулиноподобных факторов роста); маркеров апоптоза – лимфоцитов (Л) с фенотипом CD95+ (FasR (CD95) – мембранный рецептор инициации апоптоза системы FasR– FasL) и фактора некроза опухоли альфа (ФНОα – «лиганд смерти» и провоспалительный цитокин семейства фактора некроза опухолей); маркера клеточного энергообеспечения – плацентарной щелочной фосфатазы (ПЩФ – фермент регуляции энергетического обмена по принципу «фосфорилирование-дефосфорилирование»). Контрольную группу составили 30 здоровых беременных женщин с физиологическим течением гестации.
Идентификацию Л CD95+ осуществляли стандартным методом иммунофлюоресцентного анализа с использованием моноклональных антител к поверхностным антигенам лимфоцитов человека, меченных FITS Fab-фрагментами антимышиных иммуноглобулинов. Уровни ПАМГ, ФНОα и ФРП в сыворотке крови определяли методом иммуноферментного анализа с применением наборов реагентов ООО «Протеиновый контур» (Санкт-Петербург); ПЩФ – на биохимическом анализаторе «Ultra» с использованием реагентов фирмы «Kohe» (Финляндия).
Для оценки ФПК применялись ультразвуковая система GE Voluson S6 (GE Healthcare, США), фетальный монитор «Corometrics-259» (Индия). Степень тяжести ПН оценивали по классификации А.Н. Стрижакова (2000), при этом выделяли компенсированную ПН (КПН), субкомпенсированную ПН (СПН), декомпенсированную ПН (ДПН).
Морфологическое исследование плацент проводилось с учетом критериев А.П. Милованова (2005). Ретроспективно уровни исследованных в крови маркеров и основанные на них ПИ сопоставлялись со сроками манифестации и степенью тяжести больших акушерских синдромов.
Математическая обработка полученных данных проводилась на персональном компьютере AMD Athlon II в среде Windows XP с использованием программы Microsoft Office Excel 2003, статистического пакета Statistica 7.0 фирмы STATSOFT. Весь полученный числовой материал подвергался статистической обработке с заданной надежностью 95% или уровнем значимости (p<0,05). Оценка значимости различий средних арифметических значений (M±δ, где δ – среднеквадратичное отклонение) проводилась с помощью критерия Стъюдента, возможность использования которого определялась критерием Фишера-Снедекора. С применением тестов клинической эпидемиологии проведена оценка прогностической значимости предлагаемых ПИ1, ПИ2, ПИ3. Были рассчитаны чувствительность, специфичность, предсказательная ценность положительного и отрицательного результатов, диагностическая точность. Чув- ствительность (Sn) – вероятность позитивного теста у лиц с наличием заболевания: Sn= TP/Д+ × 100, где TP – число истинноположительных ответов, Д+ - число истинноположительных и ложноотрицательных ответов. Специфичность (Pp) – вероятность отрицательного результата у лиц с отсутствием заболевания:
Pp=TN/Д– × 100, где TN – число истинноотрицательных ответов, Д– – число ложноположительных и истинноотрицательных ответов. Точность (Ex) – пропорция правильных результатов среди всех обследованных лиц: Ex= (TP+TN)/N×100, где N – число всех обследованных лиц. Прогностичность результатов оценивалась исходя из преваленса частоты признака в исследуемой группе пациентов: PV + =TP/T+ ×100;
PV– =TN/T– × 100. Критерий PV+ напрямую показывает насколько велика вероятность болезни при положительных результатах обследования, а критерий PV– - насколько велика вероятность отсутствия болезни при отрицательных результатах.
Результаты исследования и их обсуждение
Исходное состояние 140 женщин группы высокого риска по структурно-функциональным нарушениям эмбрио(фето)плацентарной системы на периконцепционном этапе характеризовалась высоким уровнем отягощенного акушерского анамнеза, перенесенных гинекологических, экстрагенитальных и инфекционных заболеваний, осложненного течения прошлой беременности, неблагоприятных социальных факторов и условий труда. Данное заключение подтверждается тем, что на 1 беременную женщину, угрожаемую по декомпенсации ПН, приходится 4,95 действующих факторов риска. Оценка клинического течения и исходов беременности у женщин группы высокого риска (таблица 1) показала, что ПН реализовалась в 100%, в том числе тяжелые формы (с развитием ЗРП и ХГП) составили 85,7% (120 наблюдений);
ПЭ различной степени тяжести развилась у 51,4% (72) беременных, тяжелая (ранняя – до 34 нед гестации) ПЭ – у 20% (28); в данной группе частота ПОНРП составила 5,7% (8), преждевременных родов – 14,3% (20), включая ранние преждевременные роды – 8,6% (12).
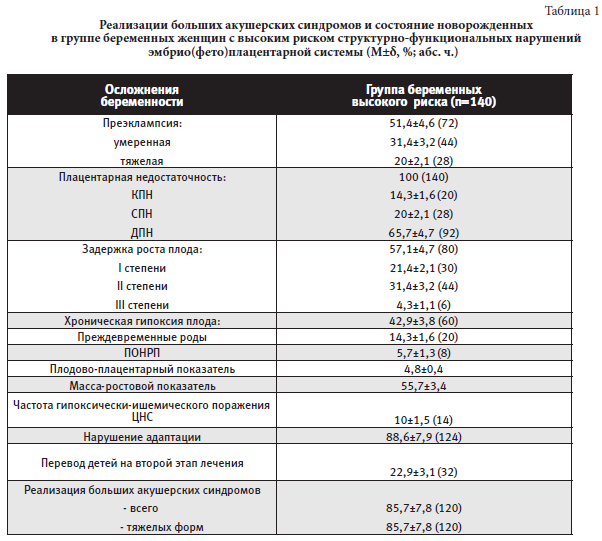
Частота гипоксически-ишемического поражения ЦНС у новорожденных от матерей группы высокого риска составила 10% (14); нарушение адаптации у новорожденных имело место в 88,6% (124); перевод на второй этап лечения потребовался в 22,9% (32 ребенка). В целом, реализация больших акушерских синдромов (ПЭ, ПН с ЗРП и/или ХГП, ПОНРП, преждевременные роды) 85,7% (120 наблюдений).
Динамика состояния беременных женщин и основных биологических систем, участвующих в формировании осложнений гестации, объективизирована путем мониторинга с применением лабораторных тестов в указанные выше сроки беременности (таблица 2).
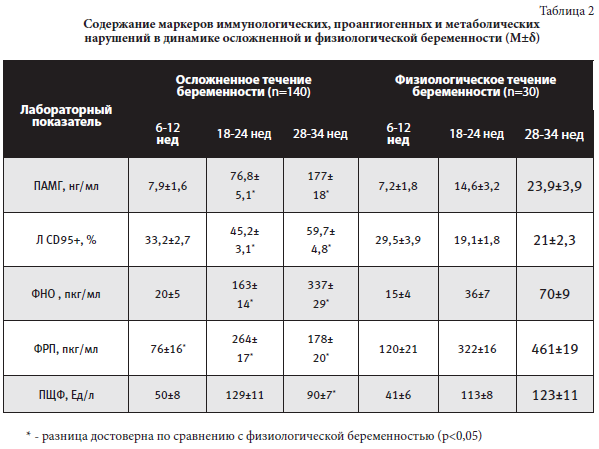
Проанализировав полученные результаты обследования, нужно отметить, что маркеры запрограммированной клеточной гибели, ангиогенеза, эндотелиальной дисфункции, децидуализации и плацентарного энергообмена показали единый тренд в течении гестации как у женщин с ПН, так и у женщин при сочетании ПН с другими осложнениями беременности (ПЭ, ПР, ПОНРП). Системная оценка состояния гомеостаза при патологическом течении беременности, с учетом выделенных маркеров, позволила разработать три ПИ – ПИ1, ПИ2, ПИ3.
Для оценки ангио- и васкулогенеза и связанного с ними воспалительного ответа предложен коэффициент соотношения ФРП/ФНОα x 100 (ПИ1). Интегральный индекс, характеризующий состояние материнской и плодовой частей плаценты, представлен коэффициентом соотношения ПАМГ/ФРП x 100 (ПИ2). Марекром степени повреждения трофобластического эпителия, индуцирующего готовность иммунокомпетентных клеток к запрограммированной клеточной гибели, и степени компенсаторных процессов в трофобласте может служить численное значение соотношения ЛCD95+/ПЩФ x 100 (ПИ3).
Согласно полученным результатам проведенного исследования, для физиологического течения беременности во втором триместре гестации характерно среднее значение ПИ1 (ФРП/ФНОα x 100) равное 1060±41,5, в третьем триместре гестации – 380±16,4 (таблица 3).
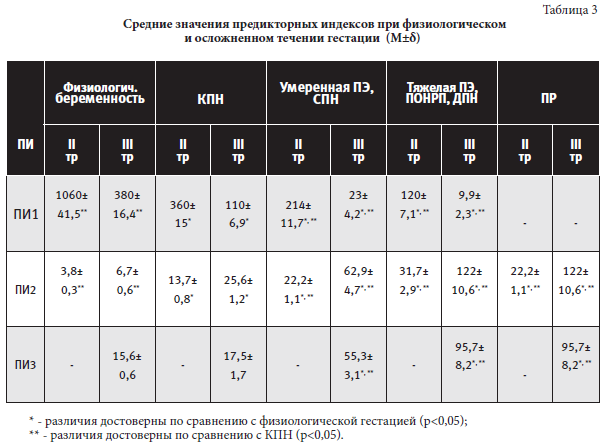
При этом разброс ПИ1 при физиологической беременности составил 1750-930 и 660-290 – соответственно второму и третьему триместрам беременности. Учитывая специфичность параметров (ФРП, ФНОα), определяющих значение ПИ1, для диагностики ПЭ (синдрома системного воспалительного ответа, эндотелиальной дисфункции и нарушения ангиогенеза), ПН (особенно её тяжелых форм), ПОНРП значение ПИ1 для второго триместра беременности ниже 930 и для третьего триместра беременности ниже 290 расценивается как характерное начало формирования данных осложнений. В зависимости от степени тяжести значения ПИ1 во втором триместре беременности распределились следующим образом:
для КПН прогностическое значение имеет 930>ПИ1≥310; для умеренной ПЭ, СПН - 310>ПИ1≥203; для тяжелой ПЭ, ПОНРП, ДПН - ПИ1≤202. В третьем триместре беременности прогностическое значение ПИ1 имеют: для КПН - 290>ПИ1≥90; для умеренной ПЭ, СПН - 90>ПИ1≥21; для тяжелой ПЭ, ПОНРП, ДПН - ПИ1≤20.
Снижение ПИ1, характеризующего состояние сосудисто-эндотелиального звена патогенеза больших акушерских синдромов, по сравнению с физиологической беременностью происходит во втором и третьем триместрах гестации в 2,9 раза и 3,5 раза при КПН, в 4,95 раз и 16,5 раз при умеренной ПЭ и СПН, в 8,8 раз и 38,4 раза при тяжелой ПЭ, ДПН, ПОНРП – соответственно. Расчет произведен исходя из средних значений ПИ1 для каждого срока беременности (таблица 3).
Среднее значение ПИ2 (ПАМГ/ФРП x100) во втором триместре физиологической беременности составило 3,8±0,3, а в третьем триместре гестации – 6,7±0,6. Разброс ПИ2 соответственно второму и третьему триместрам неосложненной гестации составил 2,3-4,3 и 5,8-7,0. Значение ПИ2 для второго триместра беременности выше 4,3 и для третьего триместра беременности выше 7,0 расценивается как характерное начало формирования больших акушерских синдромов, независимо от степени выраженности изменений в плодовой и/или материнской частях плаценты. В зависимости от степени тяжести гестационных осложнений прогностические значения ПИ2 во втором и третьем триместрах беременности соответственно распределились следующим образом: для КПН – 4,3<ПИ2≤14,1 и 7,0<ПИ2≤27,0; для умеренной ПЭ, СПН – 14,1<ПИ2≤22,5 и 27,0<ПИ2≤70,0; для тяжелой ПЭ, ДПН, ПОНРП - ПИ2>22,5 и ПИ2>70,0. Что касается ПР, то динамика изменений ПИ2 была следующей: за 4-6 недель до манифестации клиники угрожающих ПР количественное значение показателя составляло 14,1<ПИ2≤22,5, при реализации начавшихся ПР - 27,0<ПИ2≤70,0. Повышение при больших акушерских синдромах ПИ2, характеризующего состояние как плодовой, так и материнской частей плаценты, по сравнению с физиологической беременностью происходит во втором и третьем триместрах беременности в 3,6 раз и 3,8 раза при КПН, в 5,8 раз и 9,4 раз при умеренной ПЭ, СПН, ПР, в 8,3 раз и 18,2 раз при тяжелой ПЭ, ПОНРП, ДПН – соответственно срокам гестации (таблица 3).
ПИ3 как отношение уровня Л CD95+ к содержанию ПЩФ в крови беременных рассчитан только для третьего триместра беременности, учитывая диагностически значимые изменения ПЩФ как индикатора степени выраженности компенсаторных процессов в плаценте: фаза гиперферментемии→фаза снижения уровня фермента клеточного энергообеспечения→фаза истощения. Поэтому показатель ПИ3 рассчитан как прогностический маркер акушерской патологии, реализующийся в третьем триместре беременности:
тяжелых форм ПН (СПН и ДПН), ПЭ, ПОНРП, поздних преждевременных родов.
Согласно полученным результатам при физиологическом течении беременности среднее значение ПИ3 составило 15,6±0,6 (14,2<ПИ3≤16,3). Для КПН среднее значение ПИ3 составило 17,5±1,7 (13,3<ПИ3≤19,6). Незначимое отличие средних значений ПИ3 при КПН от значений, характерных для физиологической гестации (p=0,09), можно объяснить компенсаторной гиперферментемией при умеренном повышении уровня Л CD95+.
Для умеренной ПЭ, СПН, угрожающих преждевременных родов среднее значение ПИ3 составило 55,3±3,1 (19,6<ПИ3≤58,8), что превышает средние значения, характерные для КПН и физиологической гестации, в 3,2 раза и в 3,5 раза соответственно (таблица 3).
Для тяжелой ПЭ, ПОНРП, ДПН, начавшихся ПР среднее значение ПИ3 составило 95,7±8,2, что в 5,5 раз превышает среднее значение при КПН (таблица 3). Значение ПИ3 более 58,8 расценивается как прогностически значимый маркер тяжелой ПЭ, ДПН и ассоциированных с ними осложнений.
Повышение при ПЭ, ПОНРП, ПН, ПР показателя ПИ3 характеризует повреждение синцитиотрофобласта, которое ведет к изменению (перестройке) антигенной структуры трофобластического эпителия (HLA и других АГ-систем) и соответственно способствует активации одного из защитных механизмов плаценты к повреждению – индукции готовности иммунокомпетентных клеток к запрограммированной клеточной гибели, что, в свою очередь, ведет к элиминации иммунопатологических клонов лимфоцитов и тем самым способствует снижению иммунопатологических процессов в фетоплацентарном комплексе [13].
Следовательно, при применении ПИ для прогнозирования тяжелых осложнений гестации (ПЭ, ПН, ПОНРП, ПР) со второго триместра беременности необходимо учитывать следующие их значения 310>ПИ1≥203 (ПЭ, ПН, ПОНРП) и 14,1<ПИ2≤22,5 (включая ПР) - у беременных группы высокого риска по структурно-функциональным нарушениям в эмбрио(фето)плацентарной системе. При прогнозировании данных осложнений в третьем триместре беременности следует учитывать следующие значения ПИ: 90>ПИ1≥21 (исключая ПР); 27<ПИ2 ≤70 (включая ПР); 19,6<ПИ3≤58,8 (включая ПР). Клиническая реализация осложнений имела место в среднем через 4-6 недель после фиксации параметра ПИ, соответствующего критерию «прогностический».
Ретроспективный анализ количественных характеристик ПИ1, ПИ2, ПИ3 в зависимости от сроков клинической манифестации больших акушерских синдромов и степени их тяжести позволил, с применением диагностических стандартов доказательной медицины, рассчитать прогностическую значимость ПИ и выделить наиболее информативные для отдельных гестационных осложнений.
Средние значения показателей чувствительности, специфичности, предсказательной ценности положительного и отрицательного результатов, диагностической точности метода прогнозирования серьёзных осложнений гестации (ПЭ, СПН и ДПН, ПОНРП, ПР) с помощью разработанных ПИ составили соответственно для ПИ1: 91,6%, 89,9%, 88,7%, 86,9%, 87,6%; для ПИ2: 92,7%, 90,8%, 91,3%, 96,4%, 94,3%; для ПИ3: 89,4%, 87,9%, 86,5%, 87,3%, 88,1%, что свидетельствует о высокой прогностической значимости разработанных критериев.
Таким образом, проведенное исследование позволило систематизировать результаты динамической оценки ведущих патогенетических механизмов развития больших акушерских синдромов [8]. Научное обоснование применения ПИ, отражающих состояние основных биологических систем, участвующих в формировании синдрома патологической беременности, позволяет дифференцированно прогнозировать со второго триместра беременности клинически гетерогенные осложнения гестации, что дает возможность своевременно начать превентивное лечение. Рассчитанные с помощью диагностических тестов клинической эпидемиологии чувствительность, специфичность, предсказательная ценность положительного и отрицательного результатов, диагностическая точность изученных критериев прогнозирования показывают их высокую прогностическую значимость, что, несомненно, позволяет рекомендовать ПИ1, ПИ2, ПИ3 для включения в диагностический комплекс обследования беременных группы высокого риска по декомпенсации ФПК и ассоциированных с ней осложнений гестации.
Выводы
- Анализ данных по содержанию маркеров эндотелиально-геостазиологической дисфункции, апоптоза, воспалительного ответа, энергообмена в плаценте, децидуализации, клеточной пролиферации в крови у женщин группы высокого риска по структурно-функциональным нарушениям эмбрио(фето)плацентарной системе показал однонаправленность изменений как при развитии ПН, так и при реализациии ПЭ, ПОНРП, преждевременных родов, что свидетельствует в пользу патогенетической связи нарушения формирования эмбрио(фето)плацентарного комплекса с указанными осложнениями.
- Сроки реализации и степень тяжести больших акушерских синдромов обусловлены началом и степенью дезадаптации эндотелиально-гемостазиологической системы, активацией иммунопатологических реакций в плаценте, индуцированной трофобластом запрограммированной клеточной гибели лимфоцитов, изменениями регуляции клеточной трансформации, децидуализации и энергообмена в плаценте, появлением и выраженностью системного воспалительного ответа: при характерных изменениях в ранней плаценте в виде эмбриоплацентарной дисфункции в последующем реализуется ранняя ПЭ, ранние ПР, ПОНРП; при изменениях на более поздних этапах функционирования ФПК формируется поздняя ПЭ, менее тяжелые формы ЗРП и/или ХГП, поздние ПР.
- В группе высокого риска по декомпенсации эмбрио(фето)плацентарной системы большие акушерские синдромы реализуются: ПЭ в 51,4%, в том числе тяжелые формы (ранняя ПЭ) в 20%, ПН с ЗРП и/ или ХГП в 85,7%, ПОНРП в 5,7%, ПР в 14,3%, в целом синдром патологической беременности реализуется в 85,7% наблюдений. В 100% наблюдений реализация тяжелой акушерской патологии имеет место на фоне ПН различной степени тяжести, что с клинических позиций свидетельствует в пользу патогенетической связи нарушения формирования ФПК и развития других осложнений беременности.
- Предлагаемые для прогнозирования больших акушерских синдромов ПИ, интегрирующие в себе иммунологические, проангиогенные и метаболические маркеры, позволяют своевременно за 4-6 недель и дифференцированно выделять беременных, угрожаемых материнской и перинатальной заболеваемости и смертности, реализовывать предиктивный, персонифицированный, превентивный подход по ведению данного контингента беременных женщин.
- Высокая прогностическая значимость ПИ, характеризующих состояние основных биологических систем, участвующих в формировании тяжелых осложнений гестации, обусловлена возможностью объективизации ведущих патогенетических механизмов формирования синдрома патологической беременности, открывает перспективы своевременной усиленной превентивной терапии с обоснованием контроля её эффективности.
Литература
- Тезиков Ю.В., Липатов И.С., Рябова С.А., Тезикова Т.А., Ефимова Л.В., Ракитина В.Н. Перинатальная хрономедицина: биоритмостаз плода при неосложненной беременности и плацентарной недостаточности // Известия Самарского научного центра Российской академии наук. – 2014. – Т.16, №5-4. – С. 67-70.
- Табельская Т.В., Липатов И.С., Фролова Н.А., Тезиков Ю.В. Состояние сосудисто-тромбоцитарного, цитокинового, гемокоагуляционного гомеостаза у беременных на ранних сроках физиологической гестации // Известия Самарского научного центра Российской академии наук. – 2014. – Т.16, №5-4. – С. 59-62.
- Рябова С.А., Тезиков Ю.В., Липатов И.С. Результаты клинической апробации комплексной балльной шкалы оценки степени тяжести хронической плацентарной недостаточности // Известия Самарского научного центра Российской академии наук. – 2015. Т.17, №2-2. – С. 71-75.
- Тезиков Ю.В., Липатов И.С., Агаркова И.А. Факторы риска декомпенсации плацентарной недостаточности // Казанский медицинский журнал. - 2011. - Т. 92, №3. - С.372-375.
- Липатов И.С., Тезиков Ю.В., Быков А.В., Насихуллина Р.Н., Ергунова Г.А., Потапова И.А., Пурыгин П.П., Зарубин Ю.П. Апоптоз и его роль в формировании фетоплацентарной недостаточности // Вестник Самарского государственного университета. - 2006. №4-4 (44). - С. 220-226.
- Агаркова И.А., Липатов И.С., Тезиков Ю.В. Несостоявшийся аборт: оценка этиопатогенетических особенностей и прогнозирование // Самарский медицинский журнал. – 2011. - №5-6. – С. 30-37.
- Курманбаев Т.Е., Яковлев Н.В., Хасанов А.А., Мустафин И.Г., Набиуллина Р.М. Современные методы оценки состояния системы гемостаза в акушерстве // Аспирантский вестник Поволжья. – 2016. - №5-6. – С. 68-73.
- Липатов И.С., Купаев И.А., Тезиков Ю.В., Максимова О.В. Результаты обследования беременных женщин с разными формами клинического проявления генитального эндометриоза // Материалы IV съезда акушеров-гинекологов России. – М., 2008. – С. 147.
- Липатов И.С., Тезиков Ю.В., Тютюнник В.Л., Кан Н.Е., Протасов А.Д., Мартынова Н.В., Жернакова Е.В., Букреева А.А. Профилактика потерь беременности ранних сроков // Акушерство и гинекология. – 2017. - №1. – С. 24-32.
- Мартынова Н.В., Липатов И.С., Тезиков Ю.В., Овчинникова М.А., Рябова С.А. Осложнения беременности и родов у женщин с генитальным эндометриозом // Современные проблемы науки и образования. – 2017. - №1. – С. 28.
- Пурыгин П.П., Липатов И.С., Потапова И.А., Якимова Н.А., Тезиков Ю.В., Зарубин Ю.П. Синтез, иммуномодулирующее и цитопротективное действие новых производных азолидов сульфокислот // Химико-фармацевтический журнал. – 1999. – Т. 33, №11. – С. 7-9.
- Стрижаков А.Н., Тезиков Ю.В., Липатов И.С., Никаноров В.Н., Ефимова И.Л., Шарыпова М.А. Стандартизованный подход к диагностике хронической плацентарной недостаточности // Материалы XIII Всероссийского научного форума «Мать и дитя». – М., 2012. – С. 178-179.
- Purygin P.P., Potapova I.A., Belousova Z.P., Selezneva E.S., Vasin A.E., Lipatov I.S. Synthesis and antibacterial activity of 2-naphthalenesulfonic acid azolides // Pharmaceutical Chemistry Journal. – 2002. – Т.36, №1. – С. 1-7.
- Приходько А.В. Сравнительная оценка методов диагностики ранней гипогалактии с применением тестов клинической эпидемиологии // Аспирантский вестник Поволжья. – 2015. - №5-6. – С. 41-47.
- Тезиков Ю.В., Липатов И.С., Фролова Н.А., Кутузова О.А., Приходько А.В. Методология профилактики больших акушерских синдромов // Вопросы гинекологии, акушерства и перинатологии. – 2016. – Т.15, №2. – С. 20-30.
- Липатов И.С., Тезиков Ю.В., Приходько А.В., Кутузова О.А. Оценка лактогенеза и прогнозирование ранней гипогалактии кристаллографическим методом // Российский вестник акушера-гинеколога. – 2016. – Т. 16, №1. – С. 57-64.
- Мартынова Н.В., Липатов И.С., Тезиков Ю.В., Овчинникова М.А., Рябова С.А. Осложнения беременности и родов у женщин с генитальным эндометриозом // Современные проблемы науки и образования. – 2017. - №1. – С. 28.
- Рябова С.А., Тезиков Ю.В., Липатов И.С., Жернакова Е.В., Табельская Т.В. Возможности прогнозирования патологии плода при плацентарной недостаточности с первого триместра беременности // Современные проблемы науки и образования. – 2016. №5. – С. 44.
- Тезиков Ю.В., Липатов И.С., Приходько А.В. Влияние комплексной профилактики нарушения становления лактации на цитокиновый профиль и уровень пролактина у родильниц с дисфункцией плаценты во время беременности // Современные проблемы науки и образования. – 2016. - №5. – С. 46.
- Липатов И.С., Тезиков Ю.В., Мартынова Н.В., Протасов А.Д., Букреева А.А. Содержание ангиогенных факторов, маркеров апоптоза и пролиферации у новорожденных от матерей с синдромом плацентарной стимуляции яичников // Современные проблемы науки и образования. – 2016. - №5. – С. 49.
- Belousova Z.P., Potapova I.A., Bykov A.V., Maksimova O.V., Lipatov I.S., Tezikov Y.V., Karnaukhova E.S. Sintesis of 2,4,6-triisopropylbenzen esulfonic acid n-azolides and their regulatory effect on cell proliferation, energy expenditure, and apoptosis processes // Pharmaceutical Chemistry Jornal. – 2009. – Т. 43, №6. – С. 297-300.
Тольяттинский медицинский консилиум №3-4 2017

