Regional Anesthesia and Pain Medicine
Volume 25 • Number 2 • March - April 2000
Original Articles
Микроскопический анализ кончиков трех типов спинальных игл
после экспериментальной субарахноидальной пункции
Risto Puolakka M.D.
Leif C. Andersson M.D., Ph.D.
Per H. Rosenberg M.D., Ph.D.
Цель исследования
В целях снижения частоты постпункционной головной боли рекомендуется увеличить применение тонких спинальных игл с нережущим типом кончика [1]. Однако эти тонкие спинальные иглы могут представлять как практические, так и производственные трудности. Показано, что режущий кончик тонкой иглы Quincke (а также иглы с 2 зонами скоса) может легко деформироваться при попадании на костную ткань при попытке пункции, в то время как нережущие кончики конических игл (модификации Sprotte и Whitacre) вполне стойкие [2]. Кроме того, меньше характерных производственных дефектов, как оказалось, имеется у конических игл против игл со скошенным концом [3]. Спинальная игла может внести инородный материал в субарахноидальное пространство с возможным риском септической или химической контаминации [4]. Современное исследование выявило возможность заноса тканевого содержимого тонкими спинальными иглами с различным типом кончика [5]. Кроме того, частички тканей и дезинфицирующих растворов могут легко присоединяться к поврежденным режущим кончикам спинальных игл при сравнении с модификацией игл Sprotte [6]. Цель экспериментального исследования – определить, существует ли какое-либо различие в деформации кончика иглы и прилипания тканевого содержимого после пункции для этих трех типов спинальных игл.
Методы
После одобрения Национального медико-юридического совета ( National Board of Medico legal Affairs ) 96 спинальных игл (32 иглы каждого типа) были использованы для выполнения субарахноидальных пункций на трупах 4 человек, с момента наступления смерти которых прошло менее 48 часов (24 пункции на каждом). На момент смерти возраст больных составил 80, 49, 39 и 54 года, их вес был равен 76, 72, 91 и 80 кг соответственно.
 Рис. 1. Три типа спинальных игл, применявшихся в исследовании |
С приминением метода электронной сканирующей микрографии были исследованы три различных типа спинальных игл калибра 27G (рис. 1): слева - игла модификации Quincke (режущая) (Spinocan; B. Braun Melsungen AG, Melsungen, Germany); в центре- коническая игла (модификация Sprotte) (Pencan ; B . Braun Melsungen ) с закругленным кончиком и овалом, открывающимся с гладкого края; справа - оническая игла (модификация Whitacre) (Becton Dickinson , Madrid , Spain ) с коническим кончиком и прямоугольным окошком на остром крае. Все иглы вводились с проводником, и раздельные 20G 30 мм длины интродьюсеры (Yale; Becton Dickinson) использовались при каждой пункции. Все пункции были сделаны одним анестезиологом. |
Органы брюшной полости были удалены, и тела позвонков тщательно распилены для открытия спинномозгового канала без повреждения оболочек и корешков спинальных нервов. Передняя твердая мозговая оболочка с pia arachnoidea была разрезана и вскрыта секционными ножницами, труп был расположен в латеральной позиции. Кожа поясничной области спины была подготовлена по способу, который применяется при спинальной блокаде у больного с использованием обычного дезинфицирующего раствора (Klorhexol 0,5%; Leiras , Turku , Finland), представляющего собой смесь хлоргексидина, денатурированного этанола, изопропиола спирта и фенолсульфофталеина. Флюоресцирующий препарат (Fluorescite 10%; Alcon Laboratories , Fort Worth , TX) был добавлен к только что приготовленному раствору Klorhexol до концентрации флюоресцина 0,1%.
После обработки кожи 24 спинальные иглы (8 игл каждого типа) были введены с применением интродьюсера через межпозвоночное пространство L2-L3, L3-L4 и L4-L5 в субарахноидальное пространство. На каждом трупе были исследованы все три типа игл, и равное количество типов игл было использовано для выполнения пункций в ранее упомянутые промежутки. Все субарахноидальные пункции были сделаны с применением отдельных интродьюсеров по средней линии или около нее, для каждой иглы использован отдельный путь. Кожа была подготовлена однократно до пункций, которые выполнялись на каждом трупе с интервалом 30-40 минут.
Под контролем зрения со стороны брюшной полости все кончики игл были тщательно срезаны после успешной пункции твердой мозговой оболочки. 48 срезанных кончиков игл (16 игл каждого типа) были собраны и помещены на чистые предметные стекла, которые были защищены от света и исследованы под флюоресцентным микроскопом ( Zeiss Axiophot ; Carl Zeiss , Germany ) в пределах 90 минут. Другие 48 кончиков игл (16 игл каждого типа) были собраны в тест-пробирки (4 кончика одного типа игл в каждой пробирке), содержащие стерильный буферный физиологический раствор с 4% альбумином (1:10). Пробирки «встряхивали» примерно 30 секунд с помощью Rotamixer ( M . Zipperer GmGh , Stauchen , Germany ), кончики были удалены и пробирки центрифугированы со скоростью 800 оборотов в минуту в течение 8 минут. Затем содержимое с поверхности тщательно удалили и добавили 300 мл свежего солевого альбуминового раствора. Осадок в пробирке собрали микропипеткой, и 150 мкл использовали для приготовления цитоцентрифугированных (800 оборотов в минуту в течение 8 минут) мазков (2 из каждого типа пробирки) на предметном стекле. После окраски по методу Гимзы они были исследованы под световым микроскопом. Наличие тканевых фрагментов и различных типов клеток в мазках было проанализировано опытным патологоанатомом, не знающим о распределении групп.
Под флюоресцентным микроскопом Zeiss Axiophot было исследовано возможное повреждение кончика и количество флюоресцина (отражающего инородный материал), прикрепившегося к различным типам игл. Количество флюоресцирующего препарата, прикрепившегося к игле, было классифицировано на 3 категории: 0 - незаметный флюоресцин; 1 - мало данных о наличии флюоресцина; 2 - значительное количество флюоресцина, включая тканевые частички.
Кончики и окрашенные мазки с наиболее явными признаками были сфотографированы при двойном освещении в микроскопе Zeiss Axiophot с использованием объектива с десятикратным увеличением. Сканирующие электронные микрограммы (СЭМ) (сканирующий электронный микроскоп JEOL JSM -840; Japanese Electron Optical Ltd , Tokyo , Japan ) были сделаны с кончиков игл с повреждением. Кроме того, 3 неиспользованные иглы каждого типа взяты непосредственно из упаковки и исследованы методом СЭМ.
Таблицы c-квадрат применялись для анализа соотношений между 3 группами (с поправкой Bonferroni). Нормальный тест c-квадрата 2 ![]() 2 с поправкой Yates был использован для сравнения количественных соотношений в двух группах; r < 0,05 считалось значимым. 95% доверительный интервал (ДИ) для различий количественных соотношений также представлен.
2 с поправкой Yates был использован для сравнения количественных соотношений в двух группах; r < 0,05 считалось значимым. 95% доверительный интервал (ДИ) для различий количественных соотношений также представлен.
Результаты
Только 2 кончика игл имели повреждения при пункциях; 1 кончик иглы Quincke и 1 -Whitacre (рис. 2) имели притупление.

Рис. 2. Поврежденный кончик иглы Whitacre с прилипшим флюоресцином
В двух этих случаях произошло попадание на костную ткань дважды во время пункции. Все другие кончики игл не имели повреждений, сохраняя их нормальную форму после люмбальной пункции (табл.).
Таблица. Число кончиков игл с повреждением и наложение флюоресцина после субарахноидальной пункции
Тип иглы |
Тип повреждения |
Наложение флюоресцина* |
||
0 |
1 |
2 |
||
Квинке (n = 16) |
1 |
7 |
7 |
2 |
Спротте (n = 16) |
0 |
10 |
5 |
1 |
Уайтакера (n = 16) |
1 |
10 |
4 |
2 |
Итого (n = 48) |
2 |
27 |
16 |
5 |
Примечание. С факторной таблицей не было статистически значимых различий в прикреплении ткани между группами игл (chi2 = 1,942, df = 4, p = 0,747). * - 0 - нет флюоресцина; 1 - незначительное количество флюоресцина; 2 - значительное количество флюоресцина (включая тканевые частички).
Частота попадания на костную ткань при модификации игл Quincke, Sprotte и Whitacre составила 15/32, 16/32 и 20/32 соответственно.
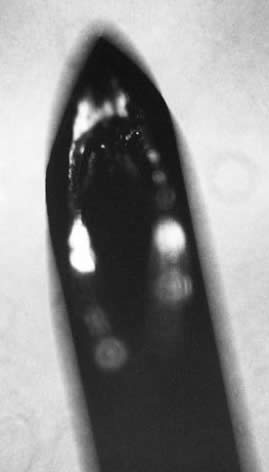
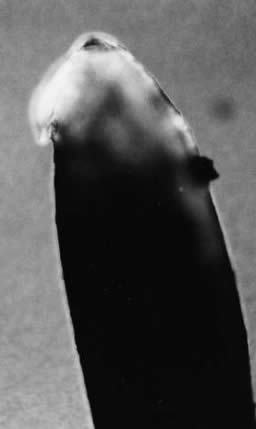
Препарат флюоресцина, также отражающий видимые тканевые частички, чаще отмечен на иглах модификации Quincke (9/16 = 56%) по сравнению с модификацией игл Sprotte (6/16 = 37%) и Whitacre (6/16 = 37%) (табл.). При сравнении частоты прилипания флюоресцина между группой игл Quincke и группами конических игл не найдено статистически значимых различий ( chi2 = 0,5, df = 1, p = 0,49, 95% ДИ от 15 до 53%). Иглы различного дизайна, несущие наибольшее количество флюоресцина, меченного материала, представлены на рис. 2-4.
 |
 |
|
| Рис. 3. Игла Quincke с прилипшим флюоресцином | Рис. 4. Игла Sprotte с прилипшим флюоресцином |
На иглах модификации Quincke эти тканевые прикрепления чаще показаны на крае срезанного отверстия кончика. На конических иглах флюоресцирующий материал обычно прикреплялся к коническому кончику, но он также наблюдался на проксимальной и дистальной части отверстия, особенно при модификации иглы Whitacre. Не было различий в отношении величины присоединившихся частиц между группами.
При исследовании центрифугированных мазков меньше клеточных скоплений и эритроцитов наблюдалось только в группе игл Sprotte. В группе Whitacre выявленные скопления эпителиоидных клеток были больше и крупнее, несколько меньше отмечено частиц хрящевой ткани (рис. 5, 6).
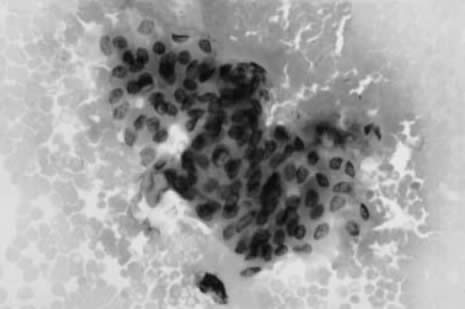
Рис. 5. Большие скопления эпителиоидных клеток в мазке с иглы Whitacre

Рис. 6. Незначительное количество частиц хрящевой ткани, обнаруженных в мазке с иглы Whitacre
Наиболее явные признаки отмечены в группе игл Quincke; было выявлено множество больших скоплений эпителиоидных и менингеальных клеток вместе с равномерно расположенными эритроцитами, включая вполне крупные мышечные волокна (рис. 7).

Рис. 7. Мышечные волокна, обнаруженные в мазке с иглы Quincke
Вообще, количество клеточного материала следовало по порядку Quincke > Whitacre > Sprotte.
При исследовании данных сканирующей электронной микроскопии мы изучали острый край отверстия спинальных игл модификации Whitacre. Контур отверстия этих игл оказался неровным, в то время как контур отверстия открытой модификации иглы Sprotte был вполне гладким и закругленным (рис. 8, 9).

Рис. 8. Поверхность иглы Whitacre
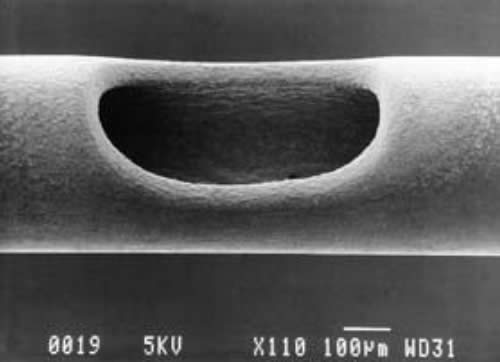
Рис. 9. Поверхность иглы Sprotte
Острая и неровная структура отверстия модификации спинальных игл Whitacre была также отмечена для всех неиспользованных игл этого типа, которые были исследованы при СЭМ.
Обсуждение
Инородный материал был обследован на кончиках 44% всех спинальных игл методом, используемым в этом экспериментальном исследовании. При других микроскопических исследованиях с большим числом спинальных игл тканевое содержимое было выявлено в 75% случаев [4]. При сравнении типов кончиков различных игл в этом аспекте режущие иглы Quincke как оказалось, прикрепляют тканевые частицы гораздо чаще, чем нережущие иглы Whitacre (80% против 41%) [5], предполагая, что острый режущий кончик и отверстие иглы способствуют заполнению просвета иглы тканями. В нашем исследовании тканевые прикрепления также чаще отмечены для модификации игл Quincke, но различие не было значимым при сравнении с коническими иглами. Однако 95% доверительный интервал был вполне существенным, предполагая, что при большем исследовании он может показать различие.
Спинальные иглы могут переносить инородный материал (частички тканей) в субарахноидальное пространство. Существует несколько сообщений о ятрогенных внутриспинальных, люмбальных эпидермоидных опухолях [7, 8]. Хотя это происходит редко, но это последнее и тяжелое осложнение спинальной пункции имеет место, указывая, что тканевое содержимое имеет клиническую значимость. С другой стороны, можно предположить, что тканевые частички и дезинфицирующие растворы с кожи могли быть возможной причиной развития диффузных неврологических симптомов (например, головной боли, радирующих болей в спине) после спинальной анестезии. Кроме того, можно ожидать, что асептический менингит, арахноидит и даже бактериальный менингит могут возникать в результате контаминации кончика иглы. Однако вопрос о том, являются ли клинически значимыми такие токсические или воспалительные реакции, происходящие из-за тканевого содержимого, для заболеваемости после спинальной анестезии, все еще остается под сомнением.
Кончики тонких игл модификации Quincke показали повреждения примерно в 15% случаев при выполнении субарахноидальной пункции [2]. В этом клиническом исследовании оказалась вполне четкой связь между появлением повреждения кончика и попаданием на костную ткань, но не выявлено различий в последствиях после анестезии в зависимости от наличия или отсутствия повреждения кончика. Это согласуется с результатами предыдущих исследований, подтверждающих, что отверстия, сделанные в твердой мозговой оболочке иглой со скошенным кончиком, не были чрезмерно неровными [9]. Микроскопический анализ Parker и White [3] показал, что около 10% тонких игл модификации Whitacre были деформированы после спинальной блокады. Было отмечено меньше производственных дефектов у неиспользованных конических игл при сравнении с иглами с режущим скошенным кончиком. Иглы модификации Sprotte оказались очень устойчивыми к таким повреждениям [2].
Конические иглы типа Sprotte [10], как уже показано, имеют слабый участок - отверстие с латеральным или аксиальным давлением [11]. Таким образом, отверстие уже было видоизменено: оно передвинуто ближе к кончику, и общая его длина уменьшена для большей устойчивости [12]. Однако конусовидный кончик этой иглы более притуплен по сравнению с коническим (истинно конусовидным) типом Whitacre. Из-за этого изменения все спинальные типы игл в настоящем исследовании названы «модификациями».
Данные цитоцентрифугированных мазков имели сходство с данными предшествующих наблюдений [6], включая меньшие клеточные скопления при модификации игл Sprotte и гораздо большие обильные скопления и тканевые структуры при модификации игл Quincke. Различие между двумя коническими иглами могло быть вызвано типом открывающегося отверстия. Острые и неровные края отверстия при модификации игл Whitacre (рис. 8) могли действовать как рубанок или бритва при прохождении через ткани.
Мы сделали вывод, что тканевое содержимое является обычным явлением при поясничной пункции, даже если имеется стилет и используется интродьюсер. Оказалось, что нет различий в частоте прилипания тканевого содержимого между 3 различными типами спинальных игл. Однако наиболее значимое прилипание было выявлено при использовании режущих игл типа Quincke.
Список литературы
1. Halpern S, Preston R. Postdural puncture headache and spinal игла design. Anesthesiology 1994;81:1376-1383.
2. Puolakka R, Jokinen M, Pitkanen MT, Rosenberg PH. Comparison of postanesthetic sequelae after clinical use of 27-gauge cutting and noncutting спинальные иглы. Reg Anesth 1997;22:521-526.
3. Parker RK, White PF. A microscopic analysis of cut-bevel versus pencil-point спинальные иглы. Anesth Analg 1997;85:1101-1104.
4. Brandus V. The spinal игла as a carrier of foreign material. Can J Anaesth 1968;15:197-201.
5. Campbell DC, Douglas MJ, Taylor G. // Reg Anesth 1996;21:582-585.
6. Rosenberg PH, Pitkanen MT, Hakala P, Andersson LC. Microscopic analysis of the tips of thin спинальные иглы after субарахноидальная пункция. Reg Anesth 1996;21:35-40.
7. Manno NJ, Uihlein A, Kernohan JW. Intraspinal epidermoids. J Neurosurg 1962;19:754-765. 8. Reina MA, Lopez-Garcia A, Dittmann M, de Andres JA, Blazquez MG. Iatrogenic spinal tumors. A late complication of spinal puncture. Rev Esp Anestesiol Reanim 1996;43:142-146.
9. Jokinen M, Pitkanen MT, Lehtonen E, Rosenberg PH. Deformed spinal игла tips and associated dural perforations examined by scanning electron microscopy. Acta Anaesthesiol Scand 1996;40:687-690.
10. Спротте G, Schedel R, Pajunk H, Pajunk H. Eine atraumatische universalkanule fur einzeitige regionalanaesthesien. Regional Anaesthesie 1987;10:104-108.
11. Lipov EG, Sosis MB, McCarthy RJ, Ivankovich AD. Does the design of the Спротте игла reduce the force needed to deform the tip? J Clin Anesth 1994;6:411-413.
12. Currier DS, Bevacqua BK. Спротте spinal игла: A new design. Reg Anesth 1996;21:172-173 (letter).

