Обзор
Современные достижения в области местных анестетиков, используемых при спинномозговой анестезии
K.R. Milligan
Резюме
Несмотря на то, что местная анестезия упоминается в древних манускриптах, прошло лишь сто лет с того момента, как Бир впервые сообщил об интратекальном применении местных анестетиков. После чего произошел быстрый рост в мастерстве и науке спинномозговой анестезии. Сейчас получены изомерно чистые препараты с подходящим клиническим профилем, такие как ропивакаин и левобупивакаин. Спинномозговая анестезия используется в разных отраслях медицины, включая ортопедию, абдоминальную хирургию, гинекологические операции, кесарево сечение и обезболивание родов. Гипербарические растворы местных анестетиков, как оказалось, дают более стойкие результаты, чем чистые растворы, а добавление других препаратов, таких как опиоиды и клонидин, могут улучшать аналгезию. Помимо традиционной спинномозговой анестезии, местные анестетики в настоящее время уже дали положительные результаты при продленной спинномозговой анестезии и комбинированной эпидурально-спинномозговой анестезии. Эта статья проводит обзор клинического опыта применения левобупивакаина и ропивакаина. При сравнении с левобупивакаином, ропивакаин обычно вызывает менее интенсивный моторный блок меньшей продолжительности, который имеет преимущества для более ранней мобилизации и выписки из стационара и может отчасти быть полезным в акушерстве и в амбулаторной хирургии.
Прошло более ста лет с того момента, как Бир и фон Эсмарх впервые сообщили об их опыте применения кокаина в качестве интратекального анестетика [1]. Несмотря на то, что Corning уже проводил спинномозговую анестезию этим препаратом [2], Бир был первым, кто попытался использовать его на практике, клинический опыт включал шесть больных, подвергшихся ортопедической операции.
Однако Бир решил ограничить свои опыты, так как «слишком много жалоб» возникало в связи с этим методом анестезии, включая боль в ногах и спине, рвоту и длительную головную боль. Он сделал вывод, что проблемы, которые он увидел, были хуже чем проблемы, наблюдаемые при общей анестезии. После эксперимента на себе и своем ассистенте, Бир, в конечном счете, сделал вывод, что необходим лучший местный анестетик до того, как спинномозговая анестезия может быть рекомендована. Несмотря на эти замечания, его работа привлекла всеобщий интерес. В течение десятилетия технические улучшения означали, что метод анестезии развивается, и что немедленно принимается современным анестезиологом, большинство из отличий были простыми улучшениями более ранних нововведений [3].
Показания для спинномозговой анестезии
Спинномозговая анестезия уже используется для обезболивания большинства операций, включая ортопедические операции [4-7], абдоминальные, гинекологические операции [8] и кесарево сечение [9-11]. Показания для спинномозговой анестезии включают обезболивание родов [12-14] и купирование боли в онкологической практике [15, 16]. В настоящее время спинномозговая анестезия привлекла внимание как метод обезболивания в амбулаторной хирургии [5, 17].
Препараты для спинномозговой анестезии
Эффективность, сила и безопасность анестетика, баричность и адъюванты остаются спорными вопросами спинномозговой анестезии. Идеальный спинномозговой анестетик для амбулаторной (day-case) хирургии должен обеспечить быстрое, адекватное обезболивание операции вместе с ранним вставанием после операции и способностью мочиться, позволяя раннюю выписку из стационара [17].
Разнообразие местных анестетиков, имеющихся в настоящее время для интратекального применения, в некоторой степени ограничено и из них наиболее часто используется бупивакаин, имеющийся как в гипербарической, так и в изобарической форме. От лигнокаина (лидокаин), ранее широко применяемого для спинномозговой анестезии, особенно в континентальной Европе, теперь отказались из-за боязни корешкового раздражения. Бупивакаин, хотя и удовлетворительный спинномозговой анестетик, имеет относительно длительное действие, что делает его неподходящим для малых процедур. При отказе от лидокаина, внимание, следовательно, сфокусировалось на ропивакаине и левобупивакаине, на двух относительно новых аминоамидах, предлагающих некоторые потенциальные преимущества перед бупивакаином, оба они сейчас успешно используются в качестве анестетиков для спинномозговой анестезии (таблица 1).
Таблица 1. Физико-химические свойства местных анестетиков.
| Название | Молекулярная масса | pK a | Коэффициент распределения (25°С) | Связывание с белками сыворотки (%) |
| Бупивакаин HCl | 324,9 | 8,2 | 346 | 95 |
| Ропивакаин HCl | 310,9 | 8,2 | 115 | 95 |
| Лидокаин HCl | 270,8 | 8,2 | 43 | 70 |
Клиническая значимость изомерической чистоты
Два новых амидных местных анестетика, ропивакаин и левобупивакаин, являются менее токсичными для центральной нервной и сердечно-сосудистой системы, чем бупивакаин, стандартный длительно-действующий местный анестетик [18].
Очевидно, что это отчасти является следствием того факта, что стереоизомеры смеси вызывают различные эффекты. Стереоизомеры являются смесями с такой же химической структурой, но с различным трёхмерным расположением их атомов (рисунок 1). Наиболее простой пример этого - это когда две формы молекул оказываются зеркальным отражением друг друга, они известны как энантиомеры. Невозможно наложить одну форму на другую; например, правая рука это зеркальное отражение левой и не может быть наложено на нее, ситуация известная как хиральность; большинство органических молекул являются хиральными.
Рисунок 1. Химические структуры бупивакаина, ропивакаина и левобупивакаина.
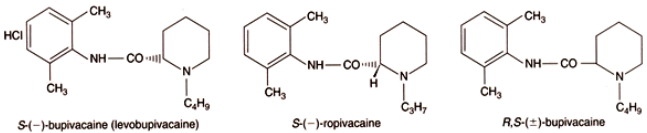
Чтобы провести различие между энантиомерами существует ряд классификаций, наиболее часто используемая система +/- или R(правая)/S(левая). Сначала пучок поляризованного света проходит через раствор молекул. Каждая форма молекул будет поворачивать свет особым количеством и в особом направлении, то есть он будет поворачиваться либо по часовой стрелке (+), либо против часовой стрелки (-). Если раствор содержит равное количество двух энантиомеров, то результирующий эффект будет нулем и свет не будет отклоняться. R/S метод классификации основан на абсолютной конфигурации группы или атомов вокруг хирального центра. Если порядок растущего размера направлен влево это S форма или если направлен вправо это R форма молекулы [19, 20].
Левобупивакаин является S(-) энантиомером бупивакаина. Клиническая значимость этого факта заключается в том, что в трёхмерной биологической системе различные формы молекул будут вызывать различные эффекты, и также будут иметься различия в их распределении и метаболизме. Становится понятным, что для местных анестетиков S(-) формы являются значительно менее токсичными, чем R(+) формы.
Баричность
Баричность местного анестетика - это плотность раствора по отношению к плотности спинно-мозговой жидкости. При баричности <0,9990 анестетик определяется как гипобаричный, при 0,9990-1,0015 - как изобаричный и при >1,0015 - как гипербаричный. Гипербаричный и гипобаричный растворы распространяются под действием силы тяжести и это, вместе с другими факторами, включая положение больного в момент введения анестетика, место введения, доза препарата и объем препарата могут затрагивать максимальный уровень чувствительного блока [22]. Клинические последствия баричности местных анестетиков будут обсуждены ниже в этом обзоре.
Безопасность
Доказательство относительной безопасности спинальных местных анестетиков обеспечивается крупным обзором осложнений. Интерес к возможности развития нейротоксичности главным образом безоснован [17]. Ряд терминов используется в литературе для описания транзиторных неврологических симптомов, включая «транзиторное корешковое раздражение», «транзиторную боль в пояснице» и «транзиторную неврологическую токсичность». Эти транзиторные неврологические симптомы, описанные после спинномозговой анестезии, наиболее часто отмечаются при применении лидокаина. Как известно авторам, нет сообщений о транзиторных неврологических симптомах в связи со спинномозговой анестезией с применением ропивакаина или левобупивакаина.
Первое успешное сообщение о спинномозговой анестезии Бира включало описание постдуральной пункционной головной боли, что было предписано потере спинно-мозговой жидкости [23]. Сообщений о частоте постдуральной пункционной головной боли после применения ропивакаина или левобупивакаина при спинномозговой анестезии недостаточно, но исследования сегодня показывают, что препарат не имеет отношения к этому факту и что более важен сам метод, применение конических игл малого диаметра (gauge) снижает ее частоту [17].
Синдром «конского хвоста» описывает симптомы нейротоксичности, которые сообщены после длительной спинномозговой анестезии, особенно при применении 5% лидокаина [24] и могут быть результатом аккумуляции гипербарического спинального анестетика в области нервов конского хвоста, приводя к локальному повреждению нервов [25]. Сегодня нет сообщений об этих симптомах в связи со спинальным применением ропивакаина или левобупивакаина.
Клинический опыт применения левобупивакаина
Левобупивакаин, амидный местный анестетик длительного действия, является изолированным S-энантиомером рацемического бупивакаина и сейчас есть в промышленном масштабе. На основе миллиграмм-на-миллиграмм он является менее токсичным, чем бупивакаин из-за сниженного потенциального эффекта на натриевые канальцы [18].
Большинство исследований, сравнивающих бупивакаин и левобупивакаин, сделали вывод, что оба препарата имеют схожее клиническое действие. Однако эти исследования сконцентрированы на эпидуральной анестезии/аналгезии и периферической нервной блокаде, и не обязательно прогнозируют эффективность левобупивакаина при спинномозговой анестезии. Например, левобупивакаин имеет некоторые характерные вазоконстрикторные свойства и это может приводить к более длительному действию, что было показано Kopacz с коллегами в исследовании, использующем эпидуральное введение 0,75% левобупивакаина [26].
Исследования интратекального применения левобупивакаина включают применение чистых растворов [27, 28], сравнение чистого и гипербарического левобупивакаина с бупивакаином [29] и эффекта при добавлении суфентанила и адреналина [30].
Burke с коллегами вводили 3 мл 0,5% чистого (без глюкозы) левобупивакаина интратекально 20 больным, подвергшимся операции на ногах [27]. Результаты были разнородными, таким образом, что хотя удовлетворительная анестезия была достигнута у большинства больных, распространение блока было крайне вариабельным и в двух случаях оказалось недостаточным для проведения операции. Время развития блока было относительно медленным, сенсорный блок занимал в среднем 25 минут для достижения максимального цефального распространения, а моторный блок занимал 15 минут. Продолжительность сенсорного блока составила 388 минут (295-478 минут) и моторного блока - 266 минут (170-415 минут). Авторы объяснили вариацию эффектов применением чистого раствора, незначительно гипобаричного при температуре тела. Было отмечено незначительное снижение частоты сердечных сокращений (ЧСС) и значительное снижение артериального давления (АД), что можно было ожидать у больных на фоне спинномозговой анестезии.
Более современное исследование Glaser с коллегами также рассматривало спинальное применение левобупивакаина, но для сравнения они включили группу бупивакаина [28]. Они вводили 3,5 мл 0,5% левобупивакаина или 0,5% рацемического бупивакаина 80 больным, подвергающимся тотальному эндопротезированию тазобедренного сустава. В сущности, они не смогли показать никаких клинических различий между двумя группами и сделали вывод, что препараты были равносильными по времени начала анестезии, продолжительности и степени моторного и сенсорного блока. Здесь были подобные изменения гемодинамических параметров в обеих группах. Они считали, однако, что распространение анестезии было предсказуемым и нашли, что время развития было меньше на 10 и 11 минут для сенсорного и моторного блока, соответственно.
Подобные результаты были получены Alley с коллегами, которые выполнили исследования в группе волонтеров, сравнив интратекальное введение 4, 8 и 12 мг гипербарического левобупивакаина с такими же дозами бупивакаина у 18 пациентов [29]. Каждому пациенту проводились две спинальные анестезии, одну левобупивакаином и вторую, позднее, той же дозой бупивакаина. Препараты, как оказалось, были похожими, не различаясь по началу, продолжительности и распространению блока или по частоте побочных эффектов. Авторы считали, что левобупивакаин был альтернативой бупивакаина и, как оказалось, не имел никаких преимуществ.
Такие же результаты были получены, когда суфентанил и адреналин добавляли к левобупивакаину. Vercauteren с коллегами сравнивали введение 2 мл 0,125% левобупивакаина с 2 мл 0,125% бупивакаина для обезболивания родов [30]. В оба раствора были добавлены 1,5 мкг суфентанила плюс 2,5 мкг адреналина. Обезболивание развилось между 4 и 5 минутами и длилось 94-95 минут. Здесь не было клинических различий между группами по любым измеренным параметрам, не считая моторного блока. Это было менее выраженным в группе левобупивакиана, но это не было заметным и не сообщалось в других исследованиях. Не ясно, какова возможная роль левобупивакиана при спинномозговой анестезии – оказалось, что, в сущности, он идентичен бупивакаину, таким образом, если бупивакаин должен быть удален с полок, нет причины, почему левобупивакаин не мог быть использован в качестве заменителя. В самом деле, не считая цены, здесь не оказалось никаких особых причин, почему бупивакаин следует продолжать использовать в клинической практике.
Клинический опыт применения ропивакаина
Ропивакаин, другой относительно новый аминоамидный местный анестетик, был первым местным анестетиком, синтезированным как чистый энантиомер. Незначительно менее эффективный, чем бупивакаин, хотя в некоторой степени это зависит от используемой модели, но так или иначе его молекулярный вес принимается в расчет; то есть 1 мг ропивакаина будет содержать больше молекул, чем 1 мг бупивакаина. Раннее исследование, сравнивающее ропивакаин с бупивакаином для эпидуральной блокады, нашло, что препараты были равносильными, сравнивало 0,25% растворы обоих. Они показали тенденцию к меньшему моторному блоку при применении ропивакаина, что было приписано более характерному блоку [31].
Polley с коллегами провели исследование эффективности и показали, что ропивакаин сильнее в 0,6 раза, чем бупивакаин при эпидуральном введении [32].
Ропивакаин впервые был применен интратекально в первой половине 1990-х годов. Это были существенные безопасные исследования, продемонстрировавшие, что ропивакаин является надежным и эффективным спинальным препаратом [33]. Так как его свойства, как оказалось, значительно отличаются от свойств бупивакаина, возможно потенциально более интересного препарата, чем левобупивакаин, по продолжительности спинномозговой анестезии.
Чистый (изобарический) ропивакаин
Как и при эпидуральном применении, интратекальный ропивакаин оказался менее сильным, чем бупивакаин. Работа McDonald с коллегами предполагает, что при спинномозговой анестезии ропивакаин примерно в 0,5 раза сильнее, чем бупивакаин [34]. Исследование потенциальной возможности препаратов было также проведено Malinovsky с соавторами, которые использовали 15 мг чистого ропивакаина для эндоскопической урологической операции, сравнивая его с 10 мг бупивакаина [35]. Здесь не было отмечено различий между группами по времени развития моторного блока и сердечно-сосудистых эффектов, но в среднем распространение блока было выше при применении бупивакаина – Т4 против Т6. Не было найдено различий по времени начала и окончания действия анестезии. У восьми из 50 больных, получивших ропивакаин, потребовалось внутривенное введение алфентанила для усиления анестезии. Таким образом, авторы сделали вывод, что ропивакаин не был эффективнее бупивакаина даже в этих дозах.
В некоторой степени отличные результаты были получены McNamee с коллегами при оценке эффективности чистых растворов ропивакаина при спинномозговой анестезии у больных, подвергающихся большим ортопедическим операциям [36]. 104 пациента, поступившие для тотального эндопротезирования тазобедренного сустава, были отобраны методом случайной выборки для интратекального введения раствора ропивакаина без глюкозы 2,5 мл 7,5 мг/мл или 2,5 мл 10 мг/мл. Моторный и сенсорный блок развился быстро в обеих группах. Среднее время для достижения блока до дерматомного уровня Т10 составило 2 минуты и среднее распространение блока было Т4 в обеих группах. Средняя длительность сенсорного блока (до Т10) была 3 часа (0,5-4,2 часа) для группы с применением 18,5 мг и 3,4 часа (1,1-5,9 часа) для группы с применением 25 мг. У одного больного имело место неадекватное обезболивание, что потребовало проведения общей анестезии. У этого больного, что было показано позднее, адекватный блок развился после операции. Авторы сделали вывод, что в использованной дозе ропивакаин обеспечивает эффективную и хорошо-переносимую анестезию при больших операциях.
В более современном двойном слепом исследовании McNamee с коллегами сравнили интратекальное введение изобарического ропивакаина и бупивакаина у 66 больных, подвергшихся тотальному эндопротезированию тазобедренного сустава [6]. Больные были произвольно отобраны для получения 17,5 мг ропивакаина или бупивакаина, и была исследована интенсивность и длительность моторного и сенсорного блоков. Начало анестезии было быстрым (в среднем 2 минуты для обеих групп) и у всех больных развился блок до Т10 и выше. Продолжительность этого блока (>Т10) была 3 часа в группе ропивакаина при сравнении с 3,5 часов для бупивакаина. Моторный блок был менее выраженным в группе ропивакаина, средняя продолжительность блока (шкала Bromage > 1) составила 3,7 часа для ропивакаина и 5 часов для бупивакаина. Через 4 часа 44% больных, получивших ропивакаин, имели оценку по шкале Bromage > 1 при сравнении с 88% пациентами, получивших бупивакаин (рисунок 2). О развитии гипотонии сообщалось у 34% больных, получивших ропивакаин, и у 38% больных, получивших бупивакаин. Послеоперационное потребление морфина через систему обезболивания, контролируемую больным, составило 54 и 44 мг в группе ропивакаина и бупивакаина, соответственно. Здесь не было различий в побочных эффектах между группами. Вывод из этого исследования был следующим: ропивакаин это хороший спинальный анестетик, но он действует меньше и вырабатывает меньший моторный блок, чем бупивакаин.
Ропивакаин сравнили с левобупивакаином в двух исследованиях. В исследовании Delfino с соавторами [37], которые сравнили 15 мг ропивакаина с 15 мг левобупивакаина, не было отмечено значительных различий в основных наблюдаемых показателях; развитие сенсорного блока, время максимального краниального распространения, максимальный уровень сенсорного блока и максимальный уровень моторного блока. Однако время развития не-провоцированной боли в месте операции и время для регрессирования тотального моторного блока было значительно дольше в группе левобупивакаина (рисунок 3). Авторы сделали вывод, что как 15 мг ропивакаина, так и 15 мг левобупивакаина, обеспечивают адекватную аналгезию и моторный блок для операции на ногах, при спинномозговом введении. Одно дальнейшее исследование Breebaart с коллегами [7] сравнило левобупивакаин, ропивакаин и лидокаин в отношении удержания мочи после спинномозговой анестезии при процедурах «одного дня» (см. ниже).
Рисунок 2. Моторный блок после применения 5 мг/мл изобарического ропивакаина (17,5 мг) или 5 мг/мл бупивакаина (17,5 мг). Номера отражают модифицированную шкалу Bromage. Средняя длительность полного моторного блока (модифицированная шкала Bromage 3) значительно короче в группе ропивакаина (p<0,001) [6].
Напечатано с разрешения British Journal of Anesthesia.
![Моторный блок после применения 5 мг/мл изобарического ропивакаина (17,5 мг) или 5 мг/мл бупивакаина (17,5 мг). Номера отражают модифицированную шкалу Bromage. Средняя длительность полного моторного блока (модифицированная шкала Bromage 3) значительно короче в группе ропивакаина (p<0,001) [6].](local_an_02.gif)
Рисунок 3. Продолжительность сенсорного и моторного блока при спинномозговой анестезии с ропивакаином или левобупивакаином при ортопедической операции [38].
![Продолжительность сенсорного и моторного блока при спинномозговой анестезии с ропивакаином или левобупивакаином при ортопедической операции [38].](local_an_03.gif)
Ропивакаин также был исследован в практике акушерской анестезии. Khaw с коллегами произвольно отобрали больных, которым предстояло родоразрешение операцией кесарева сечения, для интратекального введения 10, 15, 20 и 25 мг ропивакаина [9]. Они сообщили, что длительность сенсорного и моторного блока была непосредственно связана с дозой (рисунок 4) и что ропивакаин обеспечивал достаточную анестезию для проведения кесарева сечения. Эти результаты были подтверждены другим исследованием, которое сравнило применение 15 мг ропивакаина плюс 150 мкг морфина с 15 мг бупивакаина плюс 150 мкг морфина у больных, которым проводилось родоразрешение операцией кесарева сечения [11]. У всех больных развилась адекватная анестезия и было незначительное различие между группами, не считая более короткой длительности моторного блока в группе ропивакаина. Здесь не было различий между группами в длительности сенсорного блока или в послеоперационной потребности в аналгезии. Возможно, это было следствием эффекта морфина, скрывающим любые различия между группами. Авторы сделали вывод, что 15 мг ропивакаина плюс морфин обеспечивают достаточную анестезию для операции кесарева сечения [11].
Рисунок 4. Длительность сенсорного блока при применении ропивакаина при спинномозговой анестезии для проведения кесарева сечения [9].
![Длительность сенсорного блока при применении ропивакаина при спинномозговой анестезии для проведения кесарева сечения [9].](local_an_04.gif)
Гипербарические растворы
Khaw с коллегами также исследовали применение растворов гипербарического ропивакаина при кесаревом сечении [39]. После применения 25 мг ропивакаина в чистой форме или в виде гипербарического раствора, они обратили внимание на распространение сенсорного блока, его начало и его продолжительность. В некоторой степени удивительно, они указали на частоту неуспеха, равную 25% (5 из 20) у больных, получавших чистый ропивакаин. Здесь не было отмечено недостатка в группе с применением гипербарического ропивакаина. Среднее время развития блока составило 7,7 минут против 16,4 минут, время восстановления до L1 было 189 и 216 минут для гипербарического и чистого растворов, соответственно. Среднее распространение блока было Т1 для группы с применением гипербарического раствора и Т4 для группы с применением чистого раствора. Их вывод был следующим: гипербарические растворы ропивакаина вызывают более выраженный блок с более быстрым началом и более коротким действием.
Эти результаты были широко схожи с результатами Whiteside и соавторов, которые исследовали больных общехирургического профиля, получивших 15 мг ропивакаина на 10 мг/мл глюкозе или на 50 мг/мл глюкозе [40]. Время, требуемое для достижения блока до уровня Т10 было значительно меньше при применении раствора 50 мг/мл, чем при 10 мг/мл (в среднем 5 минут, с колебанием от 2 до 20 минут против в среднем 10 минут, с колебанием от 2 до 25 минут). Максимальный уровень распространения блока был похож в группах (в среднем Т6, от Т3 до Т10), как и время регрессирования до S2 (в среднем 210 минут, с колебанием от 150 до 330 минут). Практически у всех больных развился полный моторный блок, и адекватный блок для проведения операции был достигнут у всех больных.
В такой же группе впоследствии сравнили гипербарические растворы (3 мл 0,5% раствора) ропивакаина или бупивакаина у 40 больных, подвергшихся спинномозговой анестезии [41]. Адекватный блок для операции был достигнут во всех случаях, но длительность блока была различна. Длительность чувствительного блока на уровне Т10 была 118 минут для группы бупивакаина и только 57 минут для группы ропивакаина. Полное регрессирование моторного блока заняло 180 минут для группы ропивакаина и 255 минут для группы бупивакаина; 14 больным из 20, получивших бупивакаин, потребовалось лечение гипотонии при сравнении с 3 из 20, получивших ропивакаин. Они сделали вывод, что гипербарический бупивакаин обеспечивает достаточную анестезию, но с меньшей продолжительностью действия, чем такая же доза бупивакаина, больные вставали и начинали мочиться раньше, когда им вводили ропивакаин. Таким образом, ропивакаин оказался более полезным для хирургических вмешательств «одного дня».
Chung с коллегами сравнили 18 мг (5 мг/мл) гипербарического ропивакаина с 12 мг (5 мг/мл) гипербарического бупивакаина в акушерской практике [10]. Пиковый уровень обезболивания был похож в обеих группах (Т3) и в обеих группах был достигнут полный моторный блок ног. При сравнении с бупивакаином, ропивакаин развивал сенсорный блок значительно медленнее, с меньшей продолжительностью сенсорного блока и меньшей продолжительностью моторного блока. Интраоперационное качество анестезии было превосходным в обеих группах и не было отмечено различия в побочных эффектах.
Эти результаты были подтверждены Lopez-Soriano с соавторами [42]. Авторы сравнили гипербарические растворы 0,5% ропивакаина и 0,5% бупивакаина (12,5 мг каждого) у больных, получающих спинномозговую анестезию при операции на нижнем отделе брюшной полости. Длительность блока в группе ропивакаина была гораздо меньше, здесь было значительно меньше эпизодов гипотонии в этой группе. Сенсорный блок длился 127±24,3 минуты в противоположность 175±25,5 минуты в группе бупивакаина. Их вывод заключался в следующем: гипербарический ропивакаин был эффективным препаратом для спинномозговой анестезии и с меньшей продолжительностью действия и меньшим моторным блоком, он показал преимущества перед бупивакаином, когда желательно более быстрое восстановление.
Спинномозговая анестезия в амбулаторной практике
Отмечено, что несмотря на широкое распространение хирургии «одного дня», спинномозговая анестезия используется нечасто у этих больных. Исследование, проведенное в Канаде сообщило, что этот метод был использован у < 3% амбулаторных больных [43]. Современное исследование сравнило амбулаторную спинномозговую анестезию (10 мг гипербарического бупивакаина) с внутривенной анестезией с использованием пропофола и ремифентанила [44]. Авторы нашли, что время подготовки для обоих методов было одинаковым (11 и 7 минут, соответственно) и что частота интраоперационной гипотонии и брадикардии была такой же в двух группах. Время пребывания в стационаре было значительно дольше в группе спинномозговой анестезии 296 минут (195-720 минут) при сравнении со 156 минутами (101-345 минут) в группе, где проводилась общая анестезия. Больные оценили метод как удовлетворительный при общей анестезии в 100% при сравнении с 75% при спинномозговой анестезии. Это предполагает, что спинномозговая анестезия была менее эффективной, но результаты отличались от двух канадских исследований, которые сделали вывод, что операционная эффективность не снижается при применении регионарного метода [45, 46].
Частично проблема может быть решена в поиске подходящих препаратах для спинномозговой анестезии в амбулаторной практике. Анестезиологу требуется местный анестетик, который при интратекальном назначении, будет давать приемлемую хирургическую анестезию соответствующей длительности с последующей быстрой регрессией сенсорного и моторного блока с минимальными остаточными явлениями. Лидокаин, как показано, является полезным местным анестетиком в этой ситуации, но как было показано выше, есть проблема, связанная с возможным корешковым раздражением после его назначения [47]. Современный мета-анализ Eberhart и соавторов нашел, что частота корешкового раздражения составила 16,9% после интратекального введения лидокаина, 19,1% после применения мепивакаина и лишь 1,1% после бупивакаина и 1,7% после прилокаина [48]. Они считали, что недостаточно информации для комментария по поводу ропивакаина, тетракаина или прокаина. Начиная с этого анализа, японская группа исследователей, изучающая механизм повреждения нервов, сообщила, что у кроликов лидокаин и тетракаин вызывали равное повреждение и были токсичнее чем бупивакаин, ропивакаин [49].
Бупивакаин обычно рассматривается как препарат, лишенный этой проблемы, но имеет слишком долгое действие, чтобы иметь практическое значение в амбулаторной практике. Однако есть некоторый интерес к использованию низких доз бупивакаина для амбулаторной анестезии. Это происходит потому, что общая доза введенного местного анестетика является принципиальным фактором, определяющим длительность сенсорного блока [50]. Альтернативной стратегией является использование гипербарического бупивакаина, который исследуется как возможная альтернатива чистому бупивакаину. Исследования волонтеров Liu с соавторами предположили, что 7,5 мг этого препарата должно обеспечивать примерно 60 минут анестезии [51].
Эти результаты были подтверждены клиническим исследованием Ben-David с соавторами, где было показано, что 7,5 мг гипербарического бупивакаина, введенного интратекально, было практическим анестетиком для больных, подвергающихся артроскопии коленного сустава «одного-дня» со временем пребывания в стационаре 202±14 минут [52]. Снижение дозы до 5 мг укорачивает время пребывания в стационаре, но, к сожалению, приводит к появлению жалоб на боль у 4 из 15 больных, делая его неприемлемым для большинства анестезий.
В противоположность, исследование, проведенное финскими авторами, использующими подобную модель, предположило, что низкая доза (4 мг на 0,8 мл) гипербарического бупивакаина вызывает удовлетворительное обезболивание с быстрым восстановлением и выпиской [53].
Есть несколько исследований, которые сравнили свойства интратекальной анестезии у больных в амбулаторной практике. Buckenmaier с соавторами произвольно отобрали больных подвергающихся амбулаторно операции в аноректальной области, для получения 25 мг гипербарического лидокаина с 20 мкг фентанила или 4 мг гипербарического ропивакаина с 20 мкг фентанила. Они не смогли показать никаких значимых различий между двумя группами и сделали вывод, что ропивакаин был такой же эффективный как лидокаин [54].
Эти результаты не были повторены в исследовании, которое рассматривало время до самостоятельного мочеиспускания и выписки из стационара после интратекального применения изобарического левобупивакаина в дозе 10 мг, 15 мг ропивакаина или 60 мг лигнокаина. Лидокаин был связан с более быстрым восстановлением и коротким временем пребывания в стационаре, чем в группах двух других препаратов, среднее различие было 40 минут, но три пациента сообщили о симптомах, характерных для транзиторных неврологических нарушений. Авторы не считали, что различие между препаратами будет более значимым, так как общее время пребывания в стационаре составило 4-5 часов. Это не было в общем удивительным при рассмотрении относительно больших доз препаратов, используемых для амбулаторных процедур [7].
Адъюванты при спинномозговой анестезии
В целях улучшения надежности этих препаратов различные адъюванты уже добавлялись к ним. Адреналин был широко исследован, но хотя он и повышал надежность введения, он пролонгировал продолжительность и удлинял время пребывания больного в стационаре [55].
Опиоиды, такие как фентанил и суфентанил, также добавлялись к местным анестетикам с бoльшим успехом, так как они пролонгировали длительность сенсорного блока, но с небольшим эффектом на продолжительность моторного блока или функцию мочевого пузыря. Опиоиды прерывают передачу боли в дорсальных рогах, в то время как местный анестетик блокирует проведение по двигательным и чувствительным нервам. Здесь, как оказалось, есть некоторое доказательство синергичного действия [56] возможно за счет сочетанного эффекта кальциевых, натриевых и калиевых канальцев.
Ben-David с соавторами сообщили, что 10 мкг фентанила, добавленные к спинномозговой анестезии низкой дозой бупивакаина, повышают частоту успеха с 76% до 100% и не пролонгируют время пребывания больного в стационаре [57].
В более современном исследовании Siddik-Sayyid с соавторами сообщили, что 12,5 мкг фентанила, добавленного к 12 мг гипербарического бупивакаина, значительно улучшали качество спинномозговой анестезии при кесаревом сечении, с дополнительными успехами более длительного послеоперационного обезболивания и меньшей тошноты, когда такая же доза фентанила вводилась внутривенно [58].
Здесь оказался незначительный успех при добавлении > 40 мкг фентанила или 12,5 мкг суфентанила и эти дозы, чего можно было ожидать, удлиняли обезболивание бупивакаином на 30 и 60 минут, соответственно. Уже сообщалось, что добавление адреналина к интратекальному введению фентанила не увеличивает длительность полученного обезболивания [59].
Послеоперационная респираторная депрессия после применения опиоидов, как оказалось, не была особенной проблемой, а о зуде, хотя обычно он описывался как умеренный, сообщалось у 70% больных.
Альтернатива, которая вызывает некоторый интерес, это неостигмин. При интратекальном применении в дозе 25-100 мкг одновременно с бупивакаином, он значительно снижает потребность в послеоперационных анальгетиках. К сожалению, его польза ограничена высокой частотой тошноты и рвоты, которая сопровождает его применение [60].
Другая возможность заключается в применении возбуждающих аминокислот. Это является важным как для сенсорной, так и для моторной функции в пределах спинного мозга. После интратекального введения, они сообщили о получении блокады чувствительных и двигательных нервных волокон на моделях у животных без изменения АД, эффект который был более выражен, чем эффект полученный при введении бупивакаина [61].
Учитывая различие между ропивакаином и бупивакаином, ропивакаин предлагает лучший профиль для применения в практике анестезии «одного дня». Gautier с соавторами исследовали 150 больных, разделенных на 5 групп, подвергшихся артроскопии коленного сустава [62]. Эти больные получили 8 мг бупивакаина или 8, 10, 12 или 14 мг ропивакаина. Как можно было ожидать, группы ропивакаина 8 и 10 мг давали в среднем более короткую длительность сенсорного блока, чем при применении бупивакаина (151 против 181 минуты). К сожалению, это сопровождалось снижением качества интраоперационной аналгезии. В сущности, здесь не было различий между группами с применением 12 мг бупивакаина и ропивакаина. Таким образом, вывод из этого исследования заключался в следующем: в равной дозе нет преимуществ при использовании ропивакаина. Интересно, что в этом исследовании было недостаточно доказательств послеоперационной боли в спине. Это получило интерес после исследования небольшой группы волонтеров McDonald с коллегами, которые сообщили о высокой частоте боли в спине (28%) после интратекального введения ропивакаина [34].
В дальнейшем эту проблему исследовал Malinovsky с соавторами, которые изучали кроликов с введенным интратекальным поясничным катетером [63]. Различные дозы ропивакаина (0,2-2,0%) вводились через катетер, как в виде однократной дозы, так и в виде повторных инъекций за период 2 недели. Для сравнения, были включены 2 группы, получающие интратекально солевой раствор и 5,0% лидокаин. Гистологическое исследование в течение 7 дней после последнего применения препарата не выявило признаков нейротоксичности у кроликов, которые получали ропивакаин, но у кроликов, которые получали лидокаин, были выявлены как клинические, так и гистопатологические изменения.
Таким образом, внимание было направлено на возможную комбинацию ропивакаина с другими препаратами для получения более короткого действия, но с улучшением аналгезии. В исследовании обезболивания родов Levin с коллегами смешивали 10 мкг суфентанила с 2,5 мг бупивакаина или с 2 или 4 мг ропивакаина [4]. Обезболивание длилось от 78 до 98 минут без различий между группами по любым показателям, таким как моторный блок или побочные эффекты. Подобные результаты были получены Hughes с соавторами, которые добавляли 25 мкг фентанила к 2,5 мг ропивакаина или 2,5 мг бупивакаина и вводили растворы пациенткам, требующим обезболивания в родах [12]. Единственным определяемым отличием была гораздо более низкая частота моторного блока в группе ропивакаина (1 у 20 против 8 у 20 для группы бупивакаина) (рисунок 5). Таким образом, они сделали вывод, что ропивакаин предлагает значительный успех, чем бупивакаин в этой ситуации. Soniс коллегами сообщили о применении низкой дозы спинального ропивакаина (3 мг) с или без добавления суфентанила (10 мкг) для обезболивания родов у 36 рожениц в доношенный срок [13]. Все пациентки получили удовлетворительную аналгезию через 5 минут после проведения блокады, хотя оценка по шкале снижения боли была выше в группе ропивакаин плюс суфентанил. Длительность аналгезии была значительно больше в группе ропивакаин плюс суфентанил при сравнении с группой ропивакаина (в среднем 95 против 41 минуты). И вновь, у пациенток не было выявлено симптомов моторного блока. Здесь не было найдено различий в оценке по шкале Апгар или весу новорожденных при рождении между двумя группами. Все пациентки были удовлетворены обезболиванием в родах и не имели неврологических осложнений, включая головную боль. Авторы сделали вывод, что низкая доза спинального ропивакаина обеспечивает эффективное обезболивание родов, хотя при сочетании с суфентанилом как качество, так и продолжительность анестезии повышались. Таким образом, спинальный ропивакаин в этой дозе давал минимальный, или не давал моторного блока, который должен повышать вставание после родов.
Рисунок 5. Степень моторного блока при применении ропивакаина плюс фентанил при сравнении с бупивакаином плюс фентанил для обезболивания родов. Оценка по шкале Bromage: 0 - сохранение силы, 1 – не может поднять прямую ногу, 2 – не может согнуть ногу в колене, 3 – не может двигать ногами. Изменено (Hughes с соавторами) [12].
![Степень моторного блока при применении ропивакаина плюс фентанил при сравнении с бупивакаином плюс фентанил для обезболивания родов. Оценка по шкале Bromage: 0 - сохранение силы, 1 – не может поднять прямую ногу, 2 – не может согнуть ногу в колене, 3 – не может двигать ногами. Изменено (Hughes с соавторами) [12].](local_an_05.gif)
Больший успех был показан при применении клонидина. И вновь, используя больных, подвергающихся артроскопии, De Kock с соавторами назначали 8 мг ропивакаина с 0, 15, 45 и 75 мкг клонидина [5]. В группе с применением только ропивакаина развился сенсорный блок, длившийся в среднем 132 минуты и более низкое качество анестезии, чем в другой группе. Это согласовывалось с такой же группой в более раннем исследовании [62]. Больные, которые получили 75 мкг клонидина, имели сенсорную анестезию, которая была значительно дольше (195 минут) и связана с системными эффектами, такими как седация и снижение АД. Ропивакаин плюс 15 мкг клонидина не показали никакого удлинения моторного или сенсорного блока, никаких системных побочных эффектов и были связаны с высоким качеством интраоперационной аналгезии. Добавление небольших доз клонидина к ропивакаину, таким образом, оказывается полезным методом для улучшения качества анестезии ропивакаином, хотя сохраняет короткую продолжительность действия.
Эти результаты согласуются с результатами, которые можно ожидать в такой же равной дозе, при которой ропивакаин обеспечивает меньшую длительность анестезии чем, бупивакаин, но является эффективнее и хорошо переносится с возможным преимуществом более короткого по длительности моторного блока [63, 64].
Продленная спинномозговая анестезия
Продленная спинномозговая анестезия является методом для получения и поддержания спинномозговой анестезии с использованием малых доз местных анестетиков, которые вводятся в субарахноидальное пространство через длительно-стоящий катетер.
История и развитие этого метода вместе с его осложнениями и клиническим применением представлено в статье Denny и Selander [65]. Небольшие, периодически вводимые дозы анестетика, использованные для продленной спинномозговой анестезии, снижают риск сердечно-сосудистых и дыхательных нарушений. Они являются степенями качества, которые особенно полезны для операций на нижнем отделе брюшной полости и на ногах у пожилых больных и у больных высокого риска.
Применение продленной спинномозговой анестезии для послеоперационного обезболивания описано в ряде исследований с использованием бупивакаина, морфина и диаморфина, хотя результаты исследования бупивакаина противоречивы по длительности моторного блока и гипотонии [65]. Для обеспечения длительной аналгезии у онкологических больных, продленная спинномозговая анестезия уже показала свою эффективность в течение нескольких месяцев, когда использовали разведенные смеси бупивакаина и морфина, или бупивакаина и бупренорфина [66, 67].
Комбинированная спинально-эпидуральная анестезия
Комбинированная спинально-эпидуральная анестезия уже стала более популярной с преимуществами, включая быстрое начало, глубокий нейроаксиальный блок, возможность титрования блока и меньшее использование препарата [17]. Есть несколько потенциальных недостатков, включая повышенную частоту неуспеха спинномозговой анестезии. Однако технология была улучшена при появлении спинально-эпидуральных игл. Эпидуральная игла с «черным глазом» (black-eye) есть в наличие, что снижает риск попадания эпидуральной иглы через отверстие в твердой мозговой оболочке, что может вызывать более низкую частоту неудач, обеспечивая лучшее «ощущение» при пункции твердой мозговой оболочки [17].
Комбинированная спинально-эпидуральная анестезия популярна в акушерстве. Спинальные опиоиды, такие как фентанил или суфентанил, обеспечивают быстрое обезболивание без моторного блока, позволяя перемещаться и снижая частоту инструментального вмешательства при консервативном ведении родов [68]. Комбинированная спинально-эпидуральная анестезия обеспечивает быстро титруемый блок с хорошей мышечной релаксацией при кесаревом сечении [38]. Как спасение, аналгезия является возможной через эпидуральный катетер, низкие дозы спинальных анестетиков могут быть использованы, позволяя быстрое восстановление [69]. Более высокая частота неудач спинномозговой анестезии сообщалась при комбинированном методе при сравнении со спинномозговым методом одним. Это обсуждалось Liu и McDonald и могло быть связано с размером игл и положением больного [17].
Вывод
Начиная с древности, с первого сообщения об интратекальной анестезии Биром сто лет назад до настоящего времени, местные анестетики проделали длинный путь. Сейчас получены изомерно чистые препараты с подходящим клиническим профилем, такие как ропивакаин и левобупивакаин. Левобупивакаин смог обеспечить подходящую альтернативу бупивакаину, хотя ропивакаин может стать хорошей альтернативой для обезболивания малых хирургических процедур, например, в акушерстве и в амбулаторной хирургии, где быстрое двигательное восстановление является преимуществом. Добавление малых доз клонидина к ропивакаину оказалось полезным для улучшения качества анестезии, хотя сохранилось его короткое действие.
Использованная литература
- Bier AKG , von Esmarch JFA . Versuche uber Cocainisring des Ruchenmarkes . Deutsche Ztschr F Chir 1899; 51: 361-369.
- Corning JL. Spinal anesthesia and local medication of the cord. New York Med J 1885 ; 42: 483-485.
- Barker AE. A report on clinical experiences with spinal analgesia in 100 cases and some reflections on the procedure. BMJ 1907; 1: 665-674.
- Dahl JB, Schultz P, Anker-Moller E, Christensen EF, Staunstrup HG, Carlsson P. Spinal anaesthesia in young patients using a 29-gauge needle: technical considerations and an evalution of postoperative complaints compared with general anesthesia. Br J Anaesth 1990; 64: 178-182.
- De Kock M, Gautier P, Fanard L, Hody JL, Lavand'homme P. Intrathecal ropivacaine and clonidine for ambulatory knee arthroscopy: a dose-response study. Anesthesiology 2001; 94: 574-578.
- McNamee DA, McClelland AM, Scott S, Milligan KR, Westman L, Gustafsson U. Spinal anaesthesia: comparison of plain ropivacaine 5 mg ml -1 with bupivacaine 5 mg ml -1 for major orthopaedic surgery. Br J Anaesth 2002; 89: 702-706.
- Breebaart MB, Vercauteren MP, Hoffman VL, Adriaensen HA. Urinary bladder scanning after day-case arthroscopy under spinal anaesthesia: comparison between lidocaine, ropivacaine, and levobupivacaine. Br J Anaesth 2003; 90: 309-313.
- Kessler P, Eichler A, Wilke HJ, Strouhal U, Bremerich D. Intrathecal ropivacaine vs. bupivacaine in lower abdominal gynaecological procedures. Eur J Anaesthesiol 2001; 18 (Suppl 21): 86, A304.
- Knaw KS, Kee WD, Wong EL, Liu JY, Chung R. Spinal ropivacaine for cesarean section: a dose-finding study. Anesthesiology 2001; 95: 1346-1350.
- Chung CJ, Choi SR, Yeo KH, Park HS, Lee SI, Chin YJ. Hyperbaric spinal ropivacaine for cesarean delivery: a comparison to hyperbaric bupivacaine. Anesth Analg 2001; 93: 157-161.
- Ogun CO, Kirgiz EN, Duman A, Okesli S, Akyurek C. Comparison of intrathecal isobaric bupivacaine-morphine and ropivacaine-morphine for Caesarean delivery. Br J Anaesth 2003; 90: 659-664.
- Hughes D, Hill D, Fee JP. Intrathecal ropivacaine or bupivacaine with fentanyl for labour. Br J Anaesth 2001; 87: 733-737.
- Soni AK, Miller CG, Pratt SD, Hess PE, Oriol NE, Sarna MC. Low dose intrathecal ropivacaine with or without sufentanil provides effective analgesia and does not impair motor strength during labour: a pilot study. Can J Anaesth 2001; 48: 677-680.
- Levin A, Datta S, Camann WR. Intrathecal ropivacaine for labor analgesia: a comparison with bupivacaine. Anesth Analg 1998; 87: 624-627.
- Kshatri AM, McGarrity SJ, Hahn MB. Patient-controlled analgesia using ropivacaine via an intrathecal catheter. Region Anesth Pain Med 1998; 23: 320-322.
- Mercadante S, Calderone L, Barresi G. Intrathecal ropivacaine in cancer pain: letter. Region Anesth Pain Med 1998; 23: 621.
- Liu SS, McDonald SB. Current issues in spinal anesthesia. Anesthesiology 2001; 94: 888-906.
- Morrison SG, Dominguez JJ, Frascarolo P, Reiz S. A comparison of the electrocardiographic cardiotoxic effects of racemic bupivacaine, levobupivacaine and ropivacaine in anesthetized swine. Anesth Analg 2000; 90: 1308-1314.
- Hill SA. Correct nomenclature for stereo isomers. Anaesthesia 2002; 57: 200.
- Burke D, Henderson DJ. Chirality: a blueprint for the future. Br J Anaesth 2002; 88: 563-576.
- Greene NM. Distribution of local anaesthetic solutions within the subarachnoid space. Anesth Analg 1985; 64: 715-730.
- Stienstra R, Veering B. Intrathecal drug spread: is it controllable? Region Anesth Pain Med 1998; 23: 347-351.
- Wulf HF. The centennial of spinal anaesthesia. Anesthesiology 1998; 89: 500-506.
- Rigler ML, Drasner K, Krejcie TC, et al. Cauda equine syndrome after continuous spinal anesthesia. Anesth Analg 1991; 72: 275-281.
- Denny NM. Continuous spinal anaesthesia and cauda equine syndrome: letter. Anaesthesia 1995; 50: 471.
- Kopacz DJ, Allen HW, Thompson GE. A comparison of epidural levobupivacaine 0.75% with racemic bupivacaine for abdominal surgery. Anesth Analg 2000; 90: 642-648.
- Burke D, Kennedy S, Bannister J. Spinal anesthesia with 0.5% S(-)-bupivacaine for elective lower limb surgery. Region Anesth Pain Med 1999; 24: 519-523.
- Glaser C, Marhofer P, Zimpfer G, et al. Levobupivacaine versus racemic bupivacaine for spinal anesthesia. Anesth Analg 2002; 94: 194-198.
- Alley EA, Kopacz DJ, McDonald SB, Liu SS. Hyperbaric spinal levobupivacaine: a comparison to racemic bupivacaine in volunteers. Anesth Analg 2002; 94: 188-193.
- Vercauteren MP, Hans G, De Decker K, Adriaensen HA. Levobupivacaine combined with sufentanil and epinephrine for intrathecal labor analgesia: a comparison with racemic bupivacaine. Anesth Analg 2001; 93: 996-1000.
- Brockway MS, Bannister J, McClure JH, McKeown D, Wildsmith JA. Comparison of extradural ropivacaine and bupivacaine. Br J Anaesth 1991; 66: 31-37.
- Polley LS, Columb MO, Naughten NN, Wagner DS, van den Ven CJ. Relative analgesic potencies of ropivacaine and bupivacaine for epidural analgesia in labour: implications for therapeutic indexes. Anesthesiology 1999; 90: 944-950.
- Van Kleef J, Veering BT, Burn AG. Spinal anesthesia with ropivacaine: a double-blind study on the efficacy and safety of 0.5% and 0.75% solutions in patients undergoing minor lower limb surgery. Anesth Analg 1994; 78: 1125-1130.
- McDonald SB, Liu SS, Kopacz DJ, Stephenson CA. Hyperbaric spinal ropivacaine: a comparison to bupivacaine in volunteers. Anesthesiology 1999; 90: 971-977.
- Malinovsky JM, Charles F, Kick O, et al. Intrathecal anesthesia: ropivacaine versus bupivacaine. Anesth Analg 2000; 91: 1457-1460.
- McNamee DA, Parks L, McClelland AM, et al. Intrathecal ropivacaine for total arthroplasty: a double-blind comparative study with isobaric 7.5 mg ml -1 and 10 mg ml -1 solutions. Br J Anaesth 2001; 87: 743-747.
- Delfino J, Bezerrad V. Spinal anesthesia with 0.5% isobaric ropivacaine or levobupivacaine for lower limb surgery. Revista Brasileira de Anestesiologia 2001; 51(2): 91-97.
- Eisenach JC. Combined spinal-epidural analgesia in obstetrics. Anesthesiology 1999; 91: 299-302.
- Khaw KS, Ngan Kee WD, Wong M, Ng G, Lee A. Spinal ropivacaine for cesarean delivery: a comparison of hyperbaric and plain solutions. Anesth Analg 2002; 94: 680-685.
- Whiteside JB, Burke D, Wildsmith JAW. Spinal anaesthesia with ropivacaine 5 mg ml -1 in glucose 10 mg ml -1 or 50 mg ml -1 . Br J Anaesth 2001; 86: 241-244.
- Whiteside JB, Burke D, Wildsmith JA. Comparison of ropivacaine 0.5% in 5% glucose with bupivacaine 0.5% in 8% glucose for spinal anaesthesia for elective surgery. Br J Anaesth 2003; 90: 304-308.
- Lopez-Soriano F, Lajarin B, Rivas F, Verdu JM, Lopez-Robles J. Hyperbaric subarachnoid ropivacaine in ambulatory surgery: a comparative study with hyperbaric bupivacaine. Rev Esp Anesthesiol Reanim 2002; 49: 71-75.
- Duncan PG, Cohen MM, Tweed WA, et al. Canadian four-centre study of anaesthetic outcomes: III. Are anaesthetic complications predictable in day surgical practice? Can J Anaesth 1992; 39: 440-448.
- Danelli G, Berti M, Casati A, et al. Spinal block or total intravenous anaesthesia with propofol and reminfentanil for gynaecological outpatient procedures. Eur J Anaesthesiol 2002; 19: 594-599.
- Tessler MJ, Kardash K, Kleiman SK, Rossignol M. A retrospective comparison of spinal and general anesthesia for vaginal hysterectomy: a time analysis. Anesth Analg 1995; 81: 694-696.
- Lennox PH, Chilvers C, Vaghadia H. Selective spinal anesthesia versus desflurane anesthesia in short duration outpatient gynecological laparoscopy; a pharmacoeconomic comparison. Anesth Analg 2002; 94: 565-568.
- Pollock JE, Neal JM, Stephenson CA, Wiley CE. Prospective study of the incidence of transient radicular irritation in patients undergoing spinal anesthesia. Anesthesiology 1996; 84: 1361-1367.
- Eberhart LH, Morin AM, Kranke P, Geldner G, Wulf H. Transient neurologic symptoms after spinal anesthesia. A quantitative systemic overview (meta-analysis) of randomized controlled studies. Anaesthesist 2002; 51: 539-546.
- Yamashita A, Matsumoto M, Matsumoto S, Itoh M, Kawai K, Sakabe T. A comparison of the neurotoxic effects on the spinal cord of tetracaine, lidocaine, bupivacaine and ropivacaine administered intrathecally in rabbits. Anesth Analg 2003; 97: 512-519.
- Sheskey MC, Rocco AG, Bizarri-Schmid M, Francis DM, Edstrom H, Covino BG. A dose-response study of bupivacaine for spinal anesthesia. Anesth Analg 1983; 62: 931-935.
- Liu SS, Ware PD, Allen HW, Neal JM, Pollock JE. Dose-response characteristics of spinal bupivacaine in volunteers. Clinical implications for ambulatory anesthesia. Anesthesiology 1996; 85: 729-736.
- Ben-David B, Levin H, Solomon E, Admoni H, Vaida S. Spinal bupivacaine in ambulatory surgery: the effect of saline dilution. Anesth Analg 1996; 83: 716-720.
- Valanne JV, Korhonen AM, Jokela RM, Ravanska P, Korttila KK. Selective spinal analgesia: a comparison of hyperbaric bupivacaine 4 mg versus 6 mg for outpatient knee arthroscopy. Anesth Analg 2001; 93: 1377-1379.
- Buckenmaier III CC, Nielsen KC, Pietrobon R, et al. Small-dose intrathecal lidocaine versus ropivacaine for anorectal surgery in an ambulatory setting. Anesth Analg 2002; 95: 1253-1257.
- Chambers WA, Littlewood DG, Logan MR, Scott DB. Effect of added epinephrine on spinal anesthesia with lidocaine. Anesth Analg 1981; 60: 417-420.
- Maves TJ, Gebhart GF. Antinociceptive synergy between intrathecal morfine and lidocaine during visceral and somatic nociception in the rat. Anesthesiology 1992; 76: 91-99.
- Ben-David B, Solomon E, Levin H, Admoni H, Goldik Z. Intrathecal fentanyl with small-dose dilute bupivacaine: better anesthesia without prolonging recovery. Anesth Analg 1997; 85: 560-565.
- Siddik-Sayyid SM, Aouad MT, Jalbout MI, Zalaket MI, Berzina CE, Baraka AS. Intrathecal versus intravenous fentanyl for supplementation of subarachnoid block during cesarean delivery. Anesth Analg 2002; 95: 209-213.
- Goodman SR, Kim-Lo SH, Ciliberto CF, Ridley DM, Smiley RM. Epinephrine is not a useful addition to intrathecal fentanyl or fentanyl-bupivacaine for labor analgesia. Region Anesth Pain Med 2002; 27: 374-379.
- Lauretti GR, Mattos Al, Reis MP, Prado WA. Intrathecal neostigmine for postoperative analgesia after orthopedic surgery. J Clin Anesth 1997; 9: 473-477.
- Von Bergen NH, Subieta A, Brennan TJ. Effect of intrathecal non-NMDA EAA receptor antagonist LY 293558 in rats: a new class of drugs for spinal anesthesia. Anesthesiology 2002; 97: 177-182.
- Gautier PE, De Kock M, Van Steenberge A, et al. Intrathecal ropivacaine for ambulatory surgery. Anesthesiology 1999; 91: 1239-1245.
- Malinovsky JM, Charles F, Baudrimont M, et al. Intrathecal ropivacaine in rabbits: pharmacodynamic and neurotoxicologic study. Anesthesiology 2002; 97: 429-435.
- Carvalho AC, Machado JA, Nociti JR. Spinal anesthesia with 0.5% hyperbaric ropivacaine and 0.5% hyperbaric bupivacaine: a comparative study. Revista Brasileira de Anestesiologia 2002; 52: 659-665.
- Denny NM, Selander DE. Continuous spinal anesthesia. Br J Anaesth 1998; 81: 590-597.
- Karlsson PA, Nordborg C, Sjoberg M, et al. Neuropathological findings after long-term intrathecal infusion of buprenophine and bupivacaine for pain treatment in cancer patients. Eur J Pain 1994; 15: 69-76.
- Sjoberg M, Karlsson PA, Nordborg C, et al. Neuropathologic findings after long-term intrathecal infusion of morphine and bupivacaine for pain treatment in cancer patients. Anesthesiology 1992; 76: 173-186.
- Nageotte MP, Larson D, Rumney PJ, Sidhu M, Hollenbach K. Epidural analgesia compared with combined spinal-epidural analgesia during labor in nulliparous women. New Engl J Med 1997; 337: 1715-1719.
- Davies SJ, Paech MJ, Welch H, Evans SF, Pavy TJ. Maternal experience during epidural or combined spinal-epidural anesthesia for cesarean section: a prospective randomized trial. Anesth Analg 1997; 85: 607-613.

