Новый местный анестетик ропивакаин (наропин) в практике
врача-анестезиолога многопрофильной больницы Копцов Сергей Владимирович(E-mail: ruslan@petrostal.ru) Александровская больница (г. С.-Петербург)
Стремление к использованию меньшего количества препаратов, обладающих максимально-необходимыми свойствами – это тот идеал к которому стремится в своей практической деятельности каждый анестезиолог. Основные требования, предъявляемые к лекарственным средствам является их терапевтическая широта, надёжность, предсказуемость и безопасность. Стремление найти “золотую” середину относится и, в равной степени, к местным анестетикам, интерес к которым за последние 10 лет вырос необыкновенно. Подобное явление вызвано возрождением регионарных методов анальгезии
, их более значимое внедрение в хирургическую практику, овладеванием этими методами большинством анестезиологов.Спрос порождает предложение и вот, в группе амидных местных анестетиков появляются новые поколения этих представителей, последним из которых является ропивакаин (наропин – AstraZeneca). Но вернёмся к истокам. Что такое местноанестезирующие средства? Наиболее полно определение этих препаратов даёт В.М.Виноградов (1985): “Вещества, избирательно блокирующие возбудимость чувствительных окончаний и проведение импульсов в нервных стволах в месте непосредственного применения, а в больших концентрациях – общий сенсорный блок в месте введения.” В 1879 – русский учёный В.К.Анреп, а в1884 – англичанин Koller открыли и описали местноанестезирующее действие Erythroxylon coca; что послужило толчком к последующему синтезу большого количества средств, относящихся к локальным анестетикам.
Исходя из химического строения можно выделить две основные группы:
1.Сложные эфиры ароматических кислот, где эфирное звено расположено между ароматическим концом молекулы и промежуточной цепью.
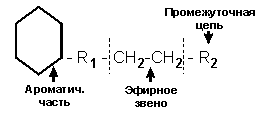
К ним относятся: новокаин, дикаин, тетракаин и т.д.
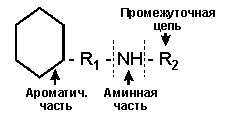
2.Амиды, аминное звено которых, расположено между ароматическим концом и промежуточной цепью. К ним относятся лидокаин, ксилокаин, бупивакаин, ропивакаин и др.
 Основное различие между
соединениями, содержащими эфир или амид,
заключается в разных путях метаболизма и их
аллергизирующем потенциале, а также их
химической стойкости. Эфиры разрушаются
псевдохолинэстеразой до парааминобензойной
кислоты, способной вызывать аллергические
реакции, а амиды – ферментами печени, без
образования кислоты. Эфиры недостаточно стойкие
в растворе по сравнению с амидами.
Основное различие между
соединениями, содержащими эфир или амид,
заключается в разных путях метаболизма и их
аллергизирующем потенциале, а также их
химической стойкости. Эфиры разрушаются
псевдохолинэстеразой до парааминобензойной
кислоты, способной вызывать аллергические
реакции, а амиды – ферментами печени, без
образования кислоты. Эфиры недостаточно стойкие
в растворе по сравнению с амидами.
Химическое строение во многом определяет
обезболивающие свойства препарата. Так если
увеличивать молекулярную массу, удлинять
промежуточную цепь, включать дополнительный
атом углерода в ароматическую или аминную часть,
то можно усилить собственные анестезирующие
возможности препарата (Takman, 1975). Ароматическая
часть средства определяет степень его
липофильности, а аминная – гидрофильность. Чем
больше степень липофильности и лучше связывание
с белками, тем длительней действие препарата.
Сроки наступления обезболивания находятся в
прямой зависимости от количества незаряжённой
формы препарата (Ritchie et al., 1965).Так 35% лидокаина
находится в неионезированной форме, а
бупивакаина – только 15%, следовательно, скорость
развития эффекта у лидокаина в 2-а раза выше
(Bridenbaugh, 1975).
Для характеристики местных анестетиков используются три понятия:
- относительная токсичность,
- относительная сила действия,
- анестетический индекс ( Пащук А.Ю., 1987).
Относительная токсичность – это отношение минимальной летальной дозы (МЛД) новокаина к МЛД нового препарата.
Относительная сила действия – это отношение минимальной действующей дозы (МДД) новокаина к МДД нового препарата.
Отношение силы действия препарата к относительной токсичности называется анестетическим индексом препарата
.Исходя из этих основных критериев
, можно охарактеризовать местные анестетики, наиболее часто используемые в анестезиологической практике.Лидокаин.
- Сила действия – 4.
- Токсичность – 1,4.
- Анестетический индекс – 3.
- Скрытый период – 5-8 минут.
- Длительность – 3,5 часов.
Тримекаин.
- Сила действия – 2-3
- Токсичность – 1,4.
- Анестетический индекс – 2.
- Скрытый период – 7-9 минут.
- Длительность – 2,5 часов.
Бупивакаин.
- Сила действия – 16
- Токсичность – 8.
- Анестетический индекс – 2.
- Скрытый период – 7-9 минут.
- Длительность – 8-12 часов.
Ропивакаин.
- Сила действия – 20
- Токсичность – 7.
- Анестетический индекс – 3.
- Скрытый период – 7-9 минут.
- Длительность – 8-12 часов.
Материал и методы.
В Александровской многопрофильной больнице Санкт-Петербурга были проведены комплексные клинические исследования нового местного анестетика – ропивакаина (наропина) у 62 пациентов хирургического профиля в течении 3 месяцев 2001 года. Средний возраст составил 56,6± 6,4 лет, процентное соотношение мужчин и женщин было 56% и 44%.
В группу вошло 37 больных
травматологического профиля, 13 пациентов -
гинекологического, 6 - общехирургического, 6 -
урологического.
В группу травматологических операций вошли:
- 17 металлоостеосинтезов костей нижних конечностей (бедро, голень, надколенник, лодыжки, стопа).
- 9 металлоостеосинтезов костей верхней конечности (плечевая кость, кости предплечья, ключица).
- 6 одновременных остеосинтезов костей верхних и нижних конечностей.
- 5 эндопротезирований тазобедренного сустава ( в том числе – 2-тотальных).
К гинекологическим операциям отнесены:
- 8 экстирпаций матки с придатками.
- 3 пластики стенок влагалища.
- 2 внематочные беременности.
К общехирургическим операциям отнесены:
- 3 резекций 2/3 желудка.
- 1 удаление варикозно расширенных вен нижних конечностей.
- 1 герниотомия ( паховая).
- 1 аппендектомия.
К урологическим операциям отнесены:
- 3 трансвезикальных аденомектомий.
- 3 трансуретральных аденомектомий.
14 операций были произведены в экстренном порядке.
Больные были распределены в 4 группы, в зависимости от метода проведения анестезиологического пособия:
В первую группу вошли пациенты, которым проводилась эпидуральная блокада, как компонент общей анестезии по эндотрахеальной методике.
Во вторую – пациенты, у которых эпидуральная анальгезия представляла собой анестезиологическое пособие.
В третью – больные, которым проводилась проводниковая блокада, как компонент анестезии.
В четвёртую – пациенты, у которых проводниковая анальгезия шла как самостоятельная методика.
Все группы делились на подгруппы в
зависимости от экстренности оперативного
вмешательства.
Для проведения анестезии во время операции
применялся 7,5% и 10% наропин, с целью
послеоперационного обезболивания – 2%, 7,5% и 10%
наропин. Во всех случаях к анестетику добавлялся
адреналин ( в соотношении 1 капля на 10 мл
раствора).
В контрольную группу вошло 60 пациентов
хирургического профиля, которым применялся в
качестве элемента анестезиологического пособия
местный анестетик бупивакаин (маркаин).
Изученные группы пациентов (контрольная и
основная) имели схожий характер по возрасту и
полу. Достоверных (р<0,05) различий по этим
признакам в сопоставляемых группах выявлено не
было. Они не найдены также по сопутствующей
патологии и профилю хирургических больных.
Контрольная группа также имела четыре подгруппы,
аналогично основной.
Для проведения анальгезии во время операции
и с целью послеоперационного обезболивания
применялся 0,5% маркаин с адреналином.
Для характеристики пациентов использовались
следующие показатели:
- Физическое состояние пациента (классификация разработана Американской ассоциацией анестезиологов (ASA).
- Состояние сердечно-сосудистой системы. Определялись систолическое и диастолическое АД, пульс, ЭКГ.
Неинвазивный мониторинг витальных функций
во время операции осуществлялся при помощи
кардиомонитора южнокорейской фирмы “BIOSYS” по следующим параметрам:
электрокардиография, измерение систолического и
диастолического артериального давления,
плетизмограмма, насыщение крови кислородом.
Универсальный монитор немецкой фирмы “Hewlett
Packard”, измеряющий следующие параметры:
электрокардиография, измерение систолического и
диастолического артериального давления,
плетизмограмма, насыщение крови кислородом,
частота и паттерн дыхания, перфузия тканей,
температура тела.
Для оценки анальгезии использовалась
словесная двенадцатибальная рейтинговая шкала,
где 0 – означает отсутствие болей, а 12 –
непереносимую боль.
Регионарное обезболивание осуществлялось
путём высокой блокады основных нервных стволов:
для голени – седалищного и бедренного нервов,
для бедра – к вышеперечисленным добавляется
блокада запирательного и латерально-кожного
нервов по методике “три в одном” (Winnie A.P.et al., 1973).
Для проведении блокады поясничного сплетения по
методике “3-в-1” необходимо во время введения
раствора к бедренному нерву придавливать
область бедра ниже места инъекции. Этот приём
обеспечивает распространение раствора местного
анестетика преимущественно проксимально по
бедренному каналу, что необходимо для блокады
запирательного и латерально-кожного нервов.
Для проведения блокады плечевого сплетения
используется надключичный доступ по Куленкампфу
(Kulenkampff D.,Persky A.,1928), либо аксилярный (Пащук А.П., 1987).
Для идентификации нерва используется
техника электростимуляции. С этой целью
применяется кардиостимулятор “КОРДЭЛЕКТРО”,
производства г. Каунас Литовской Республики,
представляющий собой генератор прямоугольных
стимулирующих импульсов.
Эпидуральная блокада осуществлялась на
разных уровнях, в зависимости от места
проведения операции. Всем больным проводилась
катетеризация перидурального пространства, для
последующего введения анестетика.
Для проведения общей анестезии по
эндотрахеальной методике использовалась
многокомпонентная, сбалансированная анестезия с
использованием миорелаксантов, где регионарное
обезболивание являлось одним из компонентов
методики.
Все пациенты контрольной и основной групп
были отнесены к 2 – 4 классу по ASA.
Продолжительность действия
Длительность анальгезии определяли по словесной рейтинговой шкале самооценки в послеоперационный период. Применение наркотических анальгетиков (фентанила) и a
2 – адреномиметиков (клофелина) достоверно (р<0,05) не влияли на действие анестетиков. В таблице 1, 2 представлены данные по продолжительности действия анестетиков в контрольной и основной группах.Таблица 1.
Продолжительность анальгезии у пациентов контрольной группы (маркаин) (М± m, n = 100).Группа |
Продолжительность анальгезии ( часы ). |
| 1 Группа | 8,3± 1,2 |
| 2 Группа | 7,5± 0,5 |
| 3 Группа | 12,2± 1,4 |
| 4 Группа | 11,3± 1,1 |
Длительность действия анальгезии у пациентов, где регионарное обезболивание выступало в качестве компонента анестезиологического пособия было достоверно (p<0,05) больше, чем при монокомпонентной методике, очевидно, вследствие применения дополнительного количества наркотических анальгетиков и атарактиков.
Таблица 2.
Продолжительность анальгезии у пациентов основной группы (наропин) (М± m, n = 110).Группа |
Продолжительность анальгезии ( часы ). |
| 1 Группа | 12,3± 0,5* |
| 2 Группа | 10,5± 1,4* |
| 3 Группа | 26,5± 1,5* |
| 4 Группа | 22,3± 1,5* |
*- различия с контрольной группой достоверно
(p<0,05).Отмечено достоверное (p<0,05) различие продолжительности анальгетической активности между основной и контрольной группами
. Наибольшее различие наблюдается в 3 и 4 подгруппах, где проводилось проводниковое обезболивание. Так же как и в контрольной группе отмечается увеличение длительности действия анальгезии в случаях использовании регионарного обезболивания как компонента анестезиологического пособия.Длительность анальгезии достоверно (p<0,05) увеличивалась при использовании более концентрированных растворов местного анестетика. При использовании 7,5% наропина с адреналином для проведения проводниковой анальгезии длительность действия составила 16 – 18 часов, эффективность 4 - 5 баллов (по словесной 12-бальной рейтинговой шкале самооценки), при применении 10% наропина с адреналином - длительность блокады – 19 – 34 часа, эффективность – 1 – 2 балла (наши данные); при проведении эпидурального обезболивания, используя 7,5% наропина с адреналином – длительность – 8 – 10 часов, при применении 10% ропивакаина – 9 – 12 часов. Болевые ощущения у большинства пациентов нарастали постепенно и доходили до максимальной силы не превышающей 6 баллов, что соответствовало определению боли как “умеренная”. Для пролонгирования анальгезии в перидуральное пространство через катетер вводился местный анестетик фракционно и капельно. Наиболее часто (75%) использовалось болюсное введение препарата ввиду простоты методики и возможности обучения самого больного. Недостатком этого метода явилось появления уже при второй – третьей инъекции тахифилаксии. При капельном введении в течении первых двух суток со скоростью 20мг/час анальгезия была адекватной и соответствовала 2 –3 баллам (по шкале самооценки). При проведении однократной проводниковой блокады болевые ощущения у 76% пациентов отсутствовали вообще, что, очевидно, было связано с тем, альтерация и отёк при травматологических операциях снижались в течении 24 – 32 часов после вмешательства.
Наступление действия.
Время наступления сенсорной и моторной блокады является неотъемлемой характеристикой любого местного анестетика. Этот показатель зависит от величины рКа. Эта величина равна показателю рН при условии, что ионизированная и неионизированная формы местного анестетика присутствуют в равных количествах. Диффузия анестетика через оболочку нерва и мембрану опеределяется незаряженной формой препарата. И у маркаина, и у наропина рКа
равна 8,1, что соответствует 15 % неионизированной формы, среднее время наступления сенсорной блокады составило: для эпидуральной анестезии – 14,5± 3,4 минут; для проводниковой блокады – 24,3± 7,3 минут. Достоверного (p<0,05) различия во времени наступления сенсорной блокады между контрольной и основной групп не найдено.Время наступления анальгезии при проведении проводниковой блокады во многом определяется точностью попадания в периневральное пространство местного анестетика. Для точной идентификации нервной структуры нами был использован метод электростимуляции. Электростимуляция проводилась с силой тока 0,5 – 2,5 мА и длительностью 0,5-1,5 мС. Если мышечные сокращения появлялись при 0,5 мА и 0,5 мС вероятность непосредственного контакта иглы с нервом составляет практически 100%. В этих случаях время наступления сенсорной блокады уменьшалось в 2-ва раза.
Время наступления моторной блокады и её продолжительность у пациентов контрольной группы соответственно составило:
- для эпидуральной анестезии: 25,5± 7,3 мин.; 6,4± 1,3 час;
- для проводниковой блокады: 45,5± 8,3 мин.; 8,4± 1,2 час.
У пациентов основной группы моторная блокада напрямую зависела от концентрации местного анестетика. Так, применяя 2% наропин, моторного блока получено не было. 7,5% наропин, применяемый эпидурально, вызывал миорелаксацию через 23,3± 4,5 мин., а длительность – 6,3± 1,2 часов; проводниковое использование способствовало моторному блоку через 45,2± 6,4 мин. при длительности
– 7,5± 1,5 часов. 10% наропин при эпидуральном применении 18,3± 7,3 мин. и 8,3± 1,1 час.; при проводниковой блокаде – 32,2± 5,3 мин. и 12,2± 2,3 часов.Подобный феномен нашёл практическое применение при определённых операциях, так тотальное эндопротезирование тазобедренного сустава с применением костного цемента как для вертлужной впадины, так и для “ножки”, длительность которой составило 3.5 часа при использовании 10% наропина с адреналином, прошло с выраженной миорелаксацией, способствующей любым движениям в суставе.
Экстирпации матки с придатками при быстрорастущих миомах, со сроком узлов более 15 недель проводились с применением как 7,5%,так и 10% наропином. Релаксация при использовании 7,5% наропина в 6 (85%) случаях была не достаточной, приходилось дополнительно вводить мышечные релаксанты (ардуан) и, следовательно, переходить на эндотрахеальную методику. Применение 10% наропина вызывало выраженную миоплегию и не требовало дополнительного использования мышечных релаксантов.
При резекции желудка все манипуляции произволились на верхних этажах брюшной полости, даже применяя 10% наропина, релаксация была не полной, кроме того, используя местный анестетик на высоких уровнях спинного мозга – возникала большая вероятность гемодинамических и дыхательных нарушений, поэтому наропин нами был использован только как компонент анестезии.
Уровень анестезии.
Распространение анестетика при его
эпидурального использовании во многом
определяется его концентрацией и баричностью.
Применение 0,5% маркаина приводило к
достоверной (p<0,05) анальгезии от места введения
на 3 –5 дерматов выше и 4 – 6 – ниже. Применение 2%
наропина в дозе 2 мг/кг приводило к достоверному
(p<0,05) распространению анальгезии от места
введения на 4 –7 дерматов выше и 4 – 6 – ниже.
Применение 7,5% наропина в той же дозировке
достоверно (p<0,05) вызывало анальгезию па 2 – 4
дерматома выше и 5 – 7 – ниже. Применение 10%
наропина в той же дозировке приводило к
достоверному (p<0,05) распространению анальгезии
на 1 – 2 дерматома выше и 6 – 8 – ниже.
На скорость распространения анестетика
влияло положение тела при эпидуральной пункции,
если пациент находился на боку –
распространение препарата осуществлялось во все
стороны более равномерно, чем при сидячем
положении, когда время наступления эффекта (при
операциях в нижней половине тела) уменьшалось на
45%.
Дозировка.
Дозировка местного анестетика влияет на
эффекты, получаемые при блокаде. При увеличении
концентрации наропина происходит более быстрая,
длительная и глубокая блокада. Одновременно
возрастает и степень моторной блокады. Наши
данные показывают, что именно дозировка
препарата, а не объём играет ведущую роль в
определении анестезиологического действия.
Объём препарата может влиять на зону
распространения обезболивания.
Единственное применение малых концентраций
и большего объёма (по нашим данным) возможно при
проведении блокады поясничного сплетения по
методике “3 в 1”, так как большой объём
“выталкивается” проксимально через паховый
канал в направлении поясничного сплетения.
Полный поясничный блок наступает после введения
не менее 30 мл 2% наропина.
Тахифилаксия.
Длительное использование местных
анестетиков часто сопровождается снижением
чувствительности к препаратам, ослаблением и
прекращением их действия. Совокупность этих
эффектов описывается понятием тахифилаксии (Renck
et al., 1976). Этот феномен не предсказуем как в
отношении времени его появления после начала
обезболивания, так и скорости его регресса у
каждого отдельно взятого пациента.
Возникновение и темпы нарастания тахифилаксии
не связаны с полом, массой и площадью поверхности
тела пациента, с локализацией и длительностью
операции (Mogensen et al., 1988). Объяснение данному
феномену до сих пор не найдено.
Всем пациентам контрольной и основной групп,
где применялось эпидуральное обезболивание
проводилось послеоперационное введение местных
анестетиков, для продлённой анальгезии.
В контрольной группе у 65%, а в основной - у 78%
пациентов развивалась тахифилаксия к местному
анестетику после однократного введения. При
использовании концентрированных растворов
наропина во время операции повторные введения
менее концентрированных растворов препарата или
других местных анестетиков амидной группы
приводили к резкому снижению анальгезии вплоть
до полной её отсутствии. Динамика длительности
анальгезии при последующем введении маркаина и
наропина представлена в таблице 3.
Таблица 3. Динамика продолжительности обезболивания у пациентов контрольной и исследуемой групп (М± m)
Препарат |
Длительность анальгезии (часы). |
||
1-е |
2-е |
3-е |
|
| 0,5% маркаин | 3,4± 0,4 | 2,3± 0,4 | 1,5± 0,2 |
| 2% наропин | 2,3± 0,4 | 1,1± 0,2 | 1,0± 0,1 |
| 7,5% наропин | 4,5± 0,3 | 2,3± 0,3 | 1,2± 0,2 |
| 10% наропин | 5,3± 1,1 | 3,1± 0,4 | 1,4± 0,5 |
Данные таблицы показывают, что к 3-ему введению длительность анальгезии становится примерно одинаковой во всех случаях. Концентрация анестетика определяет длительность анальгезии только после первого введения препарата, затем наступает снижение чувствительности до определённого порогового значения. Применение адреналина достоверно (p<0,05) не влияло на степень тахифилаксии. Использование наркотических анальгетиков достоверно (p<0,05) уменьшало процент случаев нечувствительности к анестетикам.
Токсичность.
Общие токсические реакции проявляются чаще
всего со стороны ЦНС, сердечно-сосудистой
системы и дыхания, а также функции тазовых
органов.
При использовании 0,5% маркаина в 20% случаев
отмечались гемодинамические нарушения в виде
гипотонии на 35 – 40% от исходного значения.
Особенно характерны подобные изменения для
больных, которым проводились экстренные
операции, пожилым пациентам, а также при
использовании a2 –
адреномиметиков (клофелина). Применение 2%
наропина достоверно (p<0,05) не влияло на
гемодинамику, использование 7,5% и 10% наропина
вызывало незначительное снижение (в основном,
систолического АД) гемодинамики на 20% по
сравнению с исходным. Экстренность оперативного
вмешательства достоверно (p<0,05) не влияло на
сердечно-сосудистую систему. Как и в контрольной
группе значительное изменение гемодинамики
происходило при использовании клофелина.
У одной пациентки при использовании 10%
наропина во время проведения экстирпации матки с
придатками (больная соответствовала 2 группе)
отмечалось нарушение ритма в виде предсердной
бигеминии в течении 35 минут на начальных этапах
операции, которое гемодинамически никак не
проявлялось и купировалось самостоятельно.
Проведении эпидуральной анальгезии как в
контрольной, так и основной группах на уровне
ниже Th12 не сопровождалось дыхательными
нарушениями. Более высокое применение
эпидуральной блокады проходило на фоне
использования ИВЛ, поэтому выявить достоверные
нарушения дыхания не представлялось возможным.
Сатурация кислорода как в основной, так и в
контрольной группах находилась в пределах
физиологической нормы. Нарушений со стороны ЦНС
в обоих группах не обнаружено. Дизурических и
иных нарушений функций тазовых органов не
обнаружено. Аллергических и иных проявлений
гиперчувствительности в обоих группах не
выявлено.
Рекомендованные области дальнейших клинических исследований.
- Определить возможность использования смесей наропина с лидокаином для уменьшения времени скрытого периода с сохранением длительности и адекватности анальгезии.
- Уточнить избирательность действия наропина в различных концентрациях и возможность регулирования и контролирования этих эффектов.
- Выяснить влияние ортостатических проб на место и длительность анальгезии при использовании различных концентраций наропина.
- Определить факторы, влияющие на снижение чувствительности к наропину и способы преодоления тахифилаксии.
- Опробовать использование наропина для субдурального применения.
Выводы
В ходе проведения клинического исследования местного анестетика наропина сформулированы выводы и практические рекомендации:
- Местный анестетик амидной группы последнего поколения - ропивакаин (наропин) наибольшим образом соответствует понятию об “идеальном” препарате, ввиду терапевтической широты действия, длительности, эффективности, малой токсичности, безопасности.
- Наиболее эффективно его использование для проведения травматологических операций на конечностях, когда однократно применённый при проводниковой блокаде, он способен обеспечить длительную адекватную анальгезию на срок более 18 часов.
- Эпидуральное использование наропина при проведении травматологических операций на область ниже колена, когда качественность обезболивания могла обеспечить только субдуральная (интратекальная) блокада, позволило осуществить подобные оперативные вмешательства.
- Использование наропина в комплексе анестезиологического пособия по эндотрахеальной методике позволили уменьшить общий расход лекарственных средств.
- Применяя наропин в урологической и гинекологической практике, возможно осуществить монокомпонентную методику эпидуральной блокады.
- Сочетание наропина с наркотическими анальгетиками способствует уменьшению частоты возникновения тахифилаксии и более эффективному обезболиванию.
- Наиболее эффективное использование анальгетических свойств наропина в послеоперационный период это применение капельного метода введения препарата в эпидуральное пространство со скоростью 20 мг/час.
- Наропин рекомендован для использования как при плановых, так и при экстренных операциях, особенно при сочетанных травмах, даже без использования техники катетеризации периневрального пространства.
Литература
- Виноградов.В.М. Фармакология (общая, частная и основы клинической). – 1985. – Л. – ВмедА . – 516с.
- Пащук А.Ю.

