"Тольяттинский медицинский консилиум" 2012г. № 5-6
Взаимосвязь концентрации селена в плазме крови и уровня оксидативного стресса
и системного воспалительного ответа у больных
с тяжелой черепно-мозговой травмой в остром периоде
Х.С. Нуцалова1, У.Г. Меджидова1, М.Д. Астаева2, И.А. Саввина3
1 Республиканская клиническая больница, г. Махачкала, Республика Дагестан
2 ФГБОУ ВПО «Дагестанский государственный университет, г. Махачкала, Республика Дагестан
3 ФГУ «Российский научно-исследовательский нейрохирургический институт
им. проф. А.Л. Поленова Минздравсоцразвития РФ»,
Санкт-Петербург, РФ
Relationship between selenium blood concentration and oxidative stress and systemic inflamмation level in patients with brain injury during acute trauma period
Nucalova H.S.1, Medzhidova U.G.1, Astaeva M.D.2, Savvina I.A.3
1 Republican Clinical Hospital, Mahachkala town, Republic of Dagestan, Russian Federation
2 State Dagestan University, Mahachkala town, Republic of Dagestan, Russian Federation
3 State Russian Polenov’s Neurosurgical Sientific Research Institute, Ministry of Public Health and Social Development, St. Petersburg,
Russian Federation
Резюме
В статье отражены вопросы взаимосвязи плазменного уровня селена и выраженности оксидативного стресса и системного воспалительного ответа у больных с тяжелой изолированной и сочетанной
черепно-мозговой травмой на основании определения окислительной модификации белка спонтанной и
металл-катализируемой ( Fe++ - зависимой), уровня малонового диальдегида, острофазовых протеинов,
лейкоцитоза, лейкоцитарного индекса интоксикации.
Определены фоновые значения уровня селена у жителей Махачкалинского района Дагестана, свидетельствующие об отсутствии эндемичного дефицита селена.
Ключевые слова: концентрация селена в плазме крови, тяжелая черепно-мозговая травма, оксидативный стресс, системный воспалительный ответ, антиоксидантная система, окислительная
модификация белка спонтанная и металл-катализируемая (Fe++ -зависимая), перекисное окисление липидов, малоновый диальдегид, острофазовые белки, лейкоцитоз, лейкоцитарный индекс интоксикации
Summary
The article provides relationship between serum selenium level and oxidative stress and systemic inflammation
level in patients with traumatic brain injury on the base of oxidative protein modification spontaneous and Fe++ -
catalyzing, lipid peroxidation, malondialdehyde, acute phase protein level. Normal selenium serum levels in the
health citizen blood samples of Mahachkala obtained the absence of the endemic selenium deficit.
Keywords: selenium serum concentration, traumatic brain injury, oxidative stress, antioxidative system,
oxidative protein modification spontaneous and Fe++ - catalyzing, lipid peroxidation, malondialdehyde.
Введение
Изучение особенностей динамики антиоксидантных систем и процессов липопероксидации позволило
уточнить базовые патофизиологические механизмы, лежащие в основе развития критических состояний [2,
5, 8]. Новым направлением стало исследование окислительной модификации белков (ОМБ) при различных
патологических состояниях [7]. В качестве основных индукторов ОМБ, в первую очередь, рассматриваются активные формы кислорода (АФК), увеличение свободного железа, продукты перекисного окисления
липидов (ПОЛ) при снижении антиоксидантной защиты. Наиболее важным следствием ОМБ является инактивация ферментов. Например, альдегиды вызывают инактивацию мембранных транспортеров,
таких, как Na+K+ATP-азы, транспортеров глюкозы в головном мозге, что приводит к нейродегенерации
и апоптозу [1, 3, 5, 11, 12 ]. В последнее время появились новые данные, демонстрирующие способность
некоторых альдегидов активировать белки и влиять таким образом на процессы воспаления, индукцию
апоптоза [13]. Радикалы липидов, образующиеся в результате перекисного окисления, также могут вызывать фрагментацию белковых молекул. В настоящее время предложены следующие механизмы ОМБ:
первый механизм - конъюгация липидных пероксидов с аминокислотными остатками гистидина, цистеина
и лизина в белках. Второй механизм- окисление при участии активных форм кислорода с образованием
карбонильных производных [14, 15] или «карбониловый стресс».
Уровень оксидативного стресса при тяжелой черепно-мозговой травме (ЧМТ) определяет выраженность процессов некробиоза и гибели нейронов [ 6]. В процессах, направленных на ингибирование цепных реакций свободно-радикального окисления, ключевую роль играет фермент глутатион-пероксидаза.
Структурным компонентом глутатион-пероксидазы является селен [9]. Селенопротеин P является основным
внеклеточным источником селена, составляя до 6–7 мкг селена/дл плазмы. Селенопротеин P является хорошим маркером нутрициологической обеспеченности селеном. Селенопротеин P — единственный белок,
содержащий более одного атома селена (при высокой обеспеченности селеном может содержать до 10 атомов). Предполагается, что селенопротеин P выполняет функцию транспорта селена к различным тканям,
главным образом к головному мозгу. В экспериментальной работе R.F. Burk и соавт. [10] было показано, что
введение селенита натрия приводит к значительному увеличению содержания селенопротеина P в мозге
(по сравнению с другими тканями), причем в условиях дефицита селена захват мозгом селенопротеина P
повышается в 5 раз; при этом низкомолекулярные соединения селена мозгом не утилизируются. Кроме
того, селенопротеин P также выполняет и антиоксидантные функции.
Целью исследования явилось изучение уровня оксидативного стресса ( определение выраженности
процессов ПОЛ, ОМБ), выраженности системного воспалительного ответа и антиоксидантной защиты
( концентрации селена в плазме крови) у больных с тяжелой ЧМТ в остром периоде травмы, возможной
взаимосвязи этих процессов и влияние на течение основного заболевания на нейрореанимационном этапе
лечения.
Материалы и методы. Объектом исследования явились 49 больных с тяжелой ЧМТ, методом случайной выборки распределенных на 2 группы:
1 группа (24 больных) - основная, в которой определялась концентрация селена в плазме крови в 1, 3,
7, 12 сутки лечения в реанимационном отделении с плановым введением с 1 суток препарата, содержащего
селен, в дозе 1000 мг/сутки в течение 12 дней лечения в ОРИТ.
2 группа (25 больных) - группа сравнения, в которой определение концентрации селена в плазме крови осуществлялось также в 1, 3, 7, 12 сутки лечения без заместительной фармакологической коррекции.
3 группа (28 здоровых добровольцев) – контрольная, в которой однократно определялся уровень селена в плазме крови. Все больные и добровольцы являлись жителями Махачкалинского района Дагестана.
Для оценки эффективности интенсивной терапии и определения тяжести состояния пациентов в
динамике была заведена формализованная карта обследования 49 больных, включающая регистрацию
показателей: клинического анализа крови, ЛИИ по Кальф-Калифу; биохимического анализа крови (общий
белок;альбумин; С-реактивный белок, фибриноген,билирубин, креатинин, КФК,лактат, глюкоза, АСТ, АЛТ);
коагулограммы; определение уровня селена в плазме крови больных 1 и 2 групп на 1, 3, 7, 12 сутки; определение показателей ПОЛ (малонового диальдегида в сыворотке крови); окислительную модифицикацию
белка спонтанную и металл-катализируемую (Fe++-зависимую); результаты общего анализа мочи; данные клинико-неврологического обследования (оценка неврологического статуса по шкале комы Глазго); методы нейровизуализации (КТ головного
мозга); диагностику нозокомиальной пневмонии, длительность ИВЛ.
У 26 больных с тяжелой ЧМТ, находившихся на лечении в отделении реанимации, определялись
продукты ОМБ по методу Е.Е. Дубининой и соавт. [4], предусматривающему регистрацию 2,4-динитрофенилгидразонов основного и нейтрального характера в плазме (сыворотке) крови. Определялись динитрофенилгидразоны, образующиеся при спонтанной и металл-катализируемой ОМБ. Также оценивался
уровень оксидативного стресса методом определения малонового диальдегида в плазме (сыворотке) крови,
концентрация селена в плазме крови, уровень лейкоцитоза, лейкоцитарный индекс интоксикации (ЛИИ),
уровни острофазовых протеинов: С-реактивного белка и фибриногена. Вышеуказанные показатели определялись в 1, 3, 7, 12 сутки лечения больного в отделении реанимации. Больные были разделены на 2 под
группы: 13 пациентам проводилась стандартная интенсивная терапия, включающая селен-содержащий
препарат, вводимый внутривенно в течение 12 дней острого периода в дозе 1000 мг/сутки (1 подгруппа),
13 пациентам селен в виде натрия селенита (препарат «селеназа») не вводился (2 подгруппа).
Результаты исследования и их обсуждение.
Фоновые значения уровня селена у жителей Махачкалинского района Дагестана cвидетельствовали об
отсутствии эндемичного дефицита селена. Все здоровые добровольцы (средний возраст 47±2,6 лет) имели
показатели содержания селена в сыворотке крови в пределах нормальных значений: среднее 0,161±0,019
мкг/г ( эквивалентно 161± 19 мкг/л) при норме 0,1-0,2 мкг/ г ( 100-200 мкг/л соответственно). Динамика
показателей плазменного уровня селена у больных исследуемых групп представлена на рис.1.
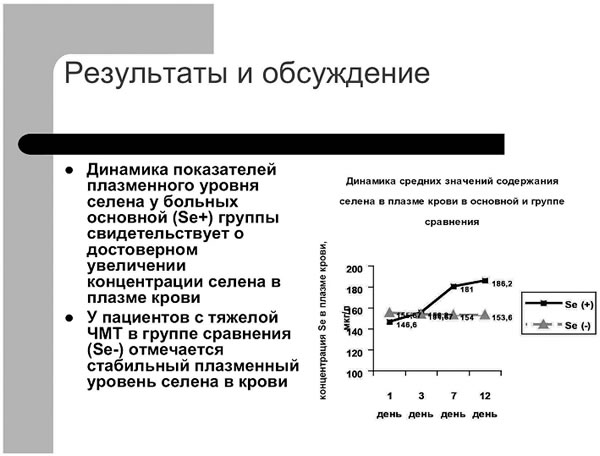 |
Рис.1.
Динамика показателей плазменного уровня селена у больных исследуемых групп. |
Динамика острофазовых протеинов фибриногена и С-реактивного белка в сравниваемых группах
больных представлена на рис.2.
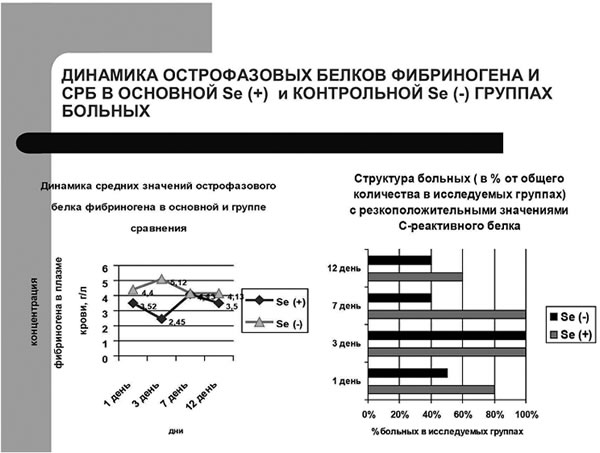 |
Рис.2.
Динамика острофазовых протеинов фибриногена и С-реактивного белка в сравниваемых группах больных. |
Динамика средних значений лейкоцитоза, лейкоцитарного индекса интоксикации в исследуемых
группах больных графически изображена на рис.3.
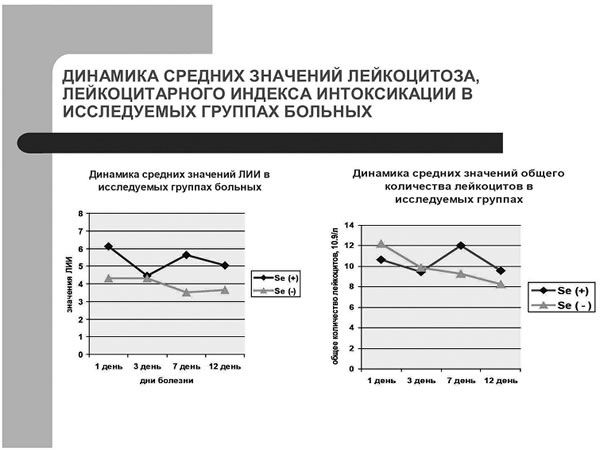 |
Рис.3.
Динамика средних значений лейкоцитоза, лейкоцитарного индекса интоксикации в исследуемых группах больных. |
Показатели уровня селена плазмы крови, лейкоцитоза, ЛИИ, фибриногена плазмы, С-реактивного
белка в исследуемых подгруппах больных представлены в таблице 1 на рис.4.
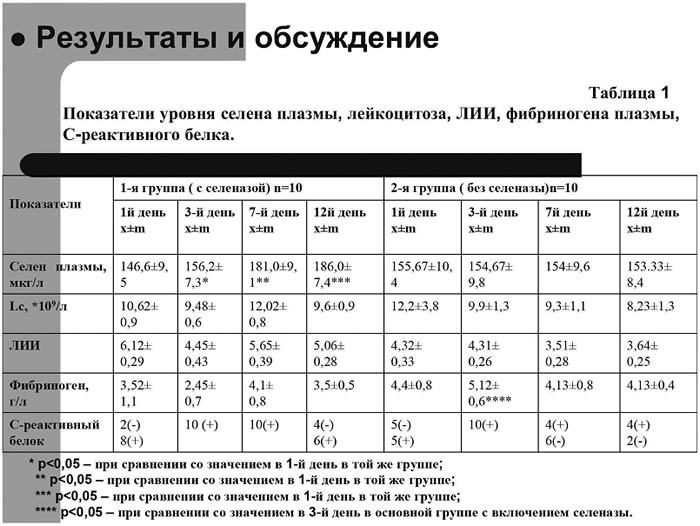 |
Рис.4.
Показатели уровня селена плазмы крови, лейкоцитоза, ЛИИ, фибриногена плазмы,
С-реактивного белка в исследуемых группах больных. |
Динамика показателей, отражающих уровень оксидативного стресса в обеих подгруппах больных,
представлена в таблице 2 на рис. 7.
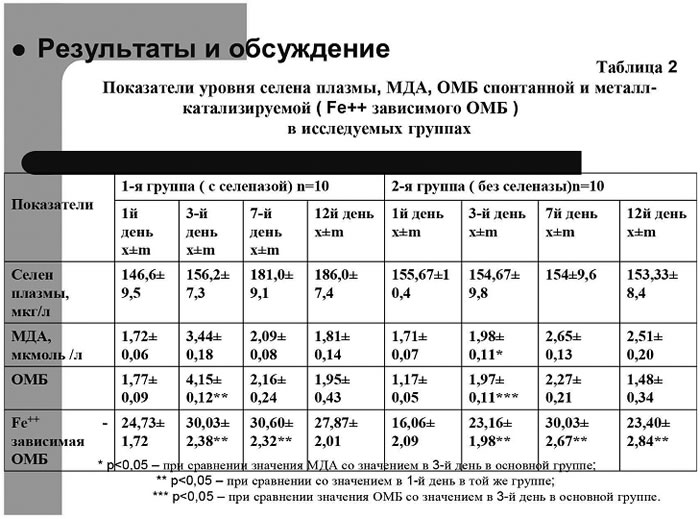 |
Рис.7.
Динамика показателей уровня селена плазмы, малонового диальдегида, окислительной модификации белка спонтанной
и металл-катализируемой (Fe++ - зависимой) |
Графическое отражение динамики средних значений продуктов перекисного окисления липидов (малонового диальдегида) в исследуемых группах больных показано на рис.5.
 |
Рис.5.
Динамика средних значений продуктов перекисного окисления липидов в исследуемых группах больных. |
Динамика средних значений окислительной модификации белка спонтанной и металл-катализируемой
(Fe++ - зависимой) в исследуемых группах больных нашла отражение на рис.6.
 |
Рис.6.
Динамика средних значений окислительной модификации белка спонтанной и металлкатализируемой (Fe++ - зависимой)
в исследуемых группах больных |
Выводы
Системный воспалительный ответ в виде повышения уровня острофазовых белков: С-реактивного
белка, фибриногена, имел место у всех больных с тяжелой ЧМТ с первых суток травмы, независимо от
введения препарата,содержащего селен. Максимальный подъем лабораторных показателей отмечался в
период с 3-х по 7-е сутки.
Лабораторные признаки системного воспалительного ответа, выбранные нами для сравнения в двух
группах, имели достоверную разницу по плазменному уровню фибриногена к 3-м суткам острого периода:
в группе больных с тяжелой ЧМТ, получавших заместительную терапию селеназой, уровень фибриногена
был ниже, чем у больных без заместительной терапии селеназой ( p< 0,05).
Выраженность процессов ПОЛ и спонтанной и Fe++зависимой окислительной модификации белков
преобладала у больных в подгруппе с введением селеназы. Вероятно, это связано с исходно более тяжелым состоянием пациентов в данной подгруппе, обусловленным более тяжелой травмой головного мозга,
что нашло отражение в оценке тяжести состояния больных при поступлении в стационар: по шкале комы
Глазго < 8 баллов.
На фоне заместительной терапии селеназой у больных с тяжелой ЧМТ отмечался рост плазменного
уровня селена, несмотря на выраженность процессов спонтанной и Fe++ - зависимой окислительной модификации белков.
Для корреспонденции
- Нуцалова Хасайбат Салимбековна, заслуженный врач РФ, заведующая отделением нейрореанимации Республиканской клинической больницы г. Махачкала 367026 Россия, Республика Дагестан, г.Махачкала, ул. Ляхова, 47 Республиканская клиническая
больница, отделение нейрореанимации. Раб.тел.: 8 (8722) 67-90-07
Моб. тел.: +79280522766; e-mail: nucalova@bk.ru
- Меджидова Ума Гасан-Гусейновна, заведующая отделением лабораторной диагностики Республиканской клинической больницы г. Махачкала
Россия, Республика Дагестан, г.Махачкала, ул. Ляхова, 47 Республиканская клиническая больница, отделение лабораторной диагностики, раб.тел. 8 (8722) 67-90-07
- Астаева Мария Дмитриевна, кандидат биологических наук, научный сотрудник кафедры биологии ФГБОУ ВПО «Дагестанский государственный университет»
367000 Россия, Республика Дагестан, г. Махачкала, ул.Гаджиева 43-А
ФГБОУ ВПО «Дагестанский государственный университет» раб.тел. 8(8722) 68-23-26
- Саввина Ирина Александровна, доктор медицинских наук, ведущий научный сотрудник отделения анестезиологии и реанимации ФГБУ «Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова Минздравсоцразвития РФ», профессор кафедры
анестезиологии и реаниматологии им.В.Л.Ваневского ФГОУ ВПО «СЗГМУ им. И.И.Мечникова
Минздравсоцразвития РФ», член-корр. РАЕН
191014 Санкт-Петербург ул. Маяковского 12, ФГБУ «РНХИ им.проф. А.Л.Поленова Минздрав
соцразвития РФ» Раб.тел.: 8(812)273-86-59; e-mail: irinasavvina@mail.ru
Литература
- Болдырев А.А. Окислительный стресс и мозг./ А.А. Болдырев // Биология. – 2001. – Т. 7. – № 4. – С. 21 – 28.
- Бурлакова Е.Б. Перекисное окисление липидов мембран и природные антиоксиданты. / Е.Б. Бурлакова, Н.Г. Храпова // Успехи химии. – 1985. – Т.54. – № 9. – С.1540–1558.
- Волкодавов О.В. Взаимосвязь нервного и гуморального каналов регуляции активности антиоксидантной системы в остром периоде черепно–мозговой травмы. / О.В. Волкодавов, С.А. Зинченко // Архив клинической и экспериментальной медицины. // http://www.acem.dsmu.edu.ua/show_text.php?text_id=177
- Дубинина Е.Е., Леонова Н.В., Зыбина Н.Н., Коновалов П.В., Морозова М.Г., Солитернова И.Б., Ковругина С.В. Окислительная деструкция белков, особенности окислительной модификации белков с использованием модельных систем и в плазме крови пожилых людей с деменциями // Фундаментальные и прикладные аспекты современной биохимии: Труды конф. – СПб.: Изд-во
СПбГМУ, 1998. – Т. 2. – С. 425-429.
- Зозуля Ю.А. Свободнорадикальное окисление и антиоксидантная защита при патологии головного мозга. / Ю.А. Зозуля, В.А. Барабой, Д.А. Сутковой // М.: “Знание–М”. – 2000. – 344 с.
- Крыжановский Г.Н. Общая патофизиология нервной системы: руководство. / Г.Н. Крыжановский – М.: Медицина, 1997. – 352 с.
- Муравлева Л.Е., Молотов-Лучанский В.Б., Клюев Д.А., Бакенова Р.А., Култанов Б.Ж., Танкибаева Н.А., Койков В.В., Омарова Г.А. Окислительная модификация белков: проблемы и перспективы исследования// Фундаментальные исследования.-2010.-№1-С.74-78.
- Перекисное окисление липидов в крови и спинномозговой жидкости у больных с черепно–мозговой травмой. / Ф.В. Олешкевич, А.С. Федулов, Л.Н. Марченко, В.А. Климкович. // Вопр. нейрохирургии. – 1983. – № 5. – С.35 – 40.
- Селен в организме человека. / В.А. Тутельян, В.А. Княжев, С.А. Хотимченко, Н.А. Голубкина, Н.Е. Кушлинский, Я.А. Соколов. – М., Издательство РАМН, 2002. - 219 с.
- Burk, R. F. and Hill, K. E. Selenoprotein P: an extracellular protein with unique physical characteristics and a role in selenium homeostasis./Annu Rev Nutr.- 2005.-Vol.25.- P.215-235.
- Carbone D.L., Doorn J.A., Kiebler Z., Ickes B.R., Petersen D.R.// J Pharmacol. Exp. Ther.-2005,315:8-15.
- Carbone D.L., Doorn J.A., Kiebler Z., Ickes B.R., Petersen D.R.// Chemmmm. Res. Toxicolllll.-2005, 18:1324-1331.
- England K., Cotter C.T.// Redox Report.-2005,10:237-245.
- Levine R.L., Garlana D., Oliver C.N., Amici A., Climent I., Lenz A.-G., Ahn R.-W., Shaltiel S., Stadman E. Determination of carbonyl content in oxidatively modified proteins // Methods in Enzymol. – 1990. – V. 186. – P. 464-478.
- Levin R.L.// Free RadicBiol Med.-2002,32:790-796.
|







