"Тольяттинский медицинский консилиум" 2018г. № 1-2
Интраоперационная аппаратная реинфузия
эритроцитов в акушерстве
(клиническая лекция)
Н.А. Барковская1, В.Я. Вартанов2,3, И.Г. Труханова3, И.В. Лаптева2, Л.В. Кругова2
1 ФГБОУ ВО «НижГМА» Минздрава России, г. Нижний Новгород, РФ
2 ГБУЗ СО «Тольяттинская городская клиническая больница № 5», РФ
3 Кафедра анестезиологии, реаниматологии и скорой медицинской помощи ИПО СамГМУ, РФ
Intraoperative blood salvage in obstetrics
(clinical lecture)
N.А. Barkovskaya, V.Ya. Vartanov, I.G. Trukhanova, I.V. Lapteva, L.V. Krugova
Резюме
В данной клинической лекции авторами освещаются вопросы практического применения интраоперационной аппаратной реинфузии эритроцитов в акушерской практике. Подробно описаны практические аспекты использования метода, освещены показания и противопоказания. Приведены как литературные, так и собственные данные, лекция иллюстрирована клиническими наблюдениями и рисунками.
Ключевые слова: интраоперационная аппаратная реинфузия эритроцитов, аутодонорство и
аутогемотрансфузия
К числу современных кровесберегающих технологий относится интраоперационная реинфузия эритромассы, получаемой при высокотехнологичной обработке аутокрови (ИАРЭ). В англоязычной литературе операция известной под аббревиатурой IBS (intraoperative blood salvage). Долгая история реинфузии позволила выделить в историческом аспекте некоторые вехи.
Идея сбора крови во время операции возникла примерно 150 лет назад. Акушеров смежные специалисты, особенно хирурги, часто упрекают в излишней консервативности, но основоположником интраоперационной реинфузии крови принято считать английского ученого, акушера и физиолога J. Blundell [1]. Толчком к этому послужило массивное маточное кровотечение, беспомощным свидетелем которого он оказался. Мы позволим себе привести здесь эмоционально окрашенное воспоминание об этом событии самого автора. «Рассуждая позже на эту мрачную тему, я отметил обстоятельства, которые придавали ей особый интерес. Я не мог противостоять нахлынувшим размышлениям о том, что эта больная, вероятно, могла быть спасена переливанием крови, и, несмотря на то, что здесь была небольшая благоприятная возможность для операции в обычном режиме, сосуды могли быть пополнены кровью посредством шприца с легкостью и быстротой».
В 1818 г. James Blundell (рис.1), проводя серию экспериментов по реинфузии крови на собаках, принципиально доказал возможность возврата аутокрови, вскоре он рекомендовал данный метод для применения у больных [1, 2].

Объем прогнозируемой кровопотери >20% ОЦК
Рис.1. James Blundell (1790-1878). Монография J. Blundell с описанием опытов по реинфузии крови у собак, 1818 г.
Английский акушер William Highmore в 1874 году опубликовал в «Ланцете» свой опыт реинфузии крови при угрожающей жизни кровопотере у родильниц [3]. Он предложил собирать и дефибринировать кровь, излившуюся после родов, согревать её до температуры тела и переливать пациентке с помощью шприца Хиггинсона (рис. 2).

Рис.2. Шприц Хиггинсона
В 1886 г. John Duncan (Edinburg) первым перелил около 100 мл излившейся крови во время ампутации нижней конечности [4]. Антикоагулянтом служил применяющийся и в наши дни цитрат натрия.
В 1925 г. наш соотечественник А.Н. Филатов провел реинфузию крови при нарушенной внематочной беременности. Ученым был доказан факт дефибринирования крови, излившейся в серозные полости, и возможность возврата ее возврата пациенту в первые часы после кровопотери. Однако уже в 1928 г. А.Н. Филатов отметил 29 случаев осложнений из 547 проведенных реинфузий, включавших озноб, рвоту, желтуху и несколько летальных исходов [1].
Простейший метод интраоперационной реинфузии крови состоял в сборе стерильным ковшом излившейся в полость организма (брюшную, грудную, перикарда) крови, в которую добавлялся гепарин или цитрат натрия. Затем раневую кровь процеживали сквозь несколько слоев (обычно 8) смоченной в физиологическом растворе марли и возвращали больному. Достоинством этого метода можно считать его быстроту и доступность, главным недостатком тот факт, что марля задерживает лишь самые крупные сгустки крови и частицы тканей.
Следует отметить, что переливаемая таким образом кровь всегда содержит невидимые глазу мелкие фрагменты повреждённых тканей, микроагрегаты форменных элементов крови, строму лизированных эритроцитов, лейкоцитов, тромбоцитов. Фильтры обычных систем для переливания крови тоже слишком крупнопористы и не способны существенно исправить положение.
Типичными осложнениями такой реинфузии являются микроэмболии, последствия которых не прогнозируемы и каждый раз зависят от массы случайных причин. Ранее рекомендовалось переливать такую кровь через лейкоцитарные или другие микрофильтры с порами размером не более 20 - 40 микрон. Эти фильтры резко замедляют темп трансфузии, однако не спасают от поступления в кровоток больного растворимых биологически активных веществ, выделившихся во время операции или травмы из разрушенных тканей и способных вызвать многочисленные осложнения.
После переливания необработанной крови у больного отмечается повышение активности плазмина, плазминогена и антиплазмина. Из-за контакта собранной крови с чужеродными материалами активируется система комплемента с выбросом анафилатоксинов СЗа и С5а, конечных комплексов комплемента, которые при реинфузии индуцируют выработку лизосомальных ферментов, интерлейкинов, простагландинов в макрофагах. Вследствие попадания вышеперечисленных биологически активных веществ в сосудистое русло при реинфузии цельной крови возможно развитие тромбоцитопении, ДВСсиндрома, послеоперационной кровоточивости, РДСВ, почечной недостаточности и даже полиорганной недостаточности. Таким образом, переливание цельной аутокрови может вместо лечебного действия может обернуться тяжелыми и трудно прогнозируемыми осложнениями вплоть до летального исхода.
Согласно Приказу МЗ РФ №183н, на сегодняшний день допустима только аппаратная реинфузия эритроцитов причем с обязательной процедурой их отмывания физиологическим раствором [5].
XIII. Аутодонорство компонентов крови и аутогемотрансфузия
86. При проведении аутодонорства используются следующие методы:
в) интраоперационная аппаратная реинфузия крови, предполагающая сбор во время операции из операционной раны и полостей излившейся крови с выделением из неё эритроцитов с последующим отмыванием, концентрированием и последующим возвратом в русло крови реципиента аутоэритроцитов
87. При проведении аутотрансфузии крови и её компонентов:
е) интраоперационная реинфузия крови, собранной во время операции из операционной раны и полостей излившейся крови, и реинфузия дренажной крови не проводится при её бактериальном загрязнении [5].
Современная эра реинфузии начинается с середины 60-х годов, когда американский военный хирург Gerald Klebanoff использовав установку Richard Dyer и роликовый насос De Bakey, осуществил сбор, антикоагуляцию, фильтрацию и интраоператорную реинфузию [6]. G. Klebanoff работал в сотрудничестве с лабораториями Bentley, поэтому первым промышленно выпущенным в 1971 году аппаратом для реинфузии крови стал Bentley ATS 100.
Упрощённая схема обработки крови (только фильтрация) сопровождалось типичными для того времени осложнениями: лизисом эритроцитов, повышением уровня свободного гемоглобина, расстройством гемокоагуляции, почечной недостаточностью, воздушной эмболией. Первые коммерческие образцы аппаратов выпускались под названием Cell Saver (с тех пор этот термин получил широкое распространение).
В 1975 г. R.O. Gilcher, M.D. Orr [7] выполнили обработку аутокрови на центрифуге, что позволило сепарировать эритроциты от плазмы и нежелательных примесей. Аппараты этого поколения уже позволяли собирать кровь из операционной раны, стабилизировать, фильтровать и отмывать физиологическим раствором.
Проблему осложнений, связанных с попаданием в кровоток частиц разрушенных тканей и выделившихся из них биологически активных веществ удалось решить путем сепарации крови на эритроцитную массу и плазму с последующим отмыванием эритроцитов достаточно большим объемом физиологического раствора.
Таким образом, произошел качественный скачок в техническом оснащении реинфузии крови, что резко повысило безопасность процедуры для пациента.
Преимущества аппаратной реинфузии эритроцитов очевидны:
- Снижение риска гемотрансфузионных реакций и осложнений.
- Исключение опасности заражения пациента гемотрансмиссивными инфекциями.
- Возможность применения у пациентов с редкими группами крови на фоне сокращения числа доноров
- Жизнеспасающей данная технология может оказаться у Свидетелей Иеговы, отказывающихся от гемотрансфузии по этическим соображениям.
- Аутоэритроциты быстро и в полном объеме включаются в процесс восстановления кислородной емкости крови. Важно, что использование 1 дозы аутоэритроцитов эквивалентно трансфузии 2-3 доз донорских эритрокомпонентов [8].
- Снижение количества донорской крови уменьшает значимость проблемы «старения» донорских эритроцитов.
- При тщательном соблюдении технологии ИАРЭ обеспечивается высокое качество аутоэритроцитов.
Переработка эритроцитов «раневой» крови с последующим отмыванием обеспечивает элиминацию слабых форм эритроцитов, сохраняя популяции клеток, обладающих функциональной активностью [9]. При изучении микрореологии эритроцитов после обработки на селл-сейвере выявлено, что деформируемость эритроцитов увеличилась на 13%, что говорит об улучшении их реологических свойств и способности изменять конфигурацию Таким образом обеспечивается их эффективный транспорт в микроциркуляторном русле, при этом не выявлено значимых изменений эритроцитарных индексов, а среднее содержание гемоглобина в эритроците повышается на 2,6% [10]. Сочетание указанных эффектов способствует оптимальной работе системы транспорта кислорода при восполнении кровопотери аутоэритроцитами.
- Использование ИАРЭ значительно расширило возможности обеспечения обширных хирургических вмешательств.
Современные аппараты позволяют достичь такой степени очистки эритроцитной массы, что Cell Saver можно использовать даже при загрязнении крови амниотической жидкостью.
С другой стороны, очищенными оказываются только эритроциты, которые в виде их взвеси в физиологическом растворе пригодны для вполне безопасного возврата в кровеносное русло больного. Это позволяет добиться одной из стратегических целей восполнения кровопотери - восстановления кислородно-транспортной функции крови. Тем не менее, не следует расценивать ИАРЭ как «золотую пилюлю». Плазма крови, вместе с промывочным раствором уходит в утиль и безвозвратно утрачивается, что не позволяет решить другие важнейшие задачи компенсации кровопотери - восстановление коллоидноонкотического давления и коагуляционного потенциала крови [11].
Показания и противопоказания к ИАРЭ в акушерстве сформулированы в Федеральных клинических рекомендациях «Интраоперационная реинфузия аутологичных эритроцитов при абдоминальном родоразрешении» [12].
ПОКАЗАНИЯ:
- Предлежание плаценты, ПОНРП
- Миома матки
- Многоплодная беременность
- Дефекты гемостаза
- Спаечная болезнь
- Варикозное расширение вен матки
- Миома, аномалии развития матки
- Разрыв матки
- Гемангиомы малого таза
- Расширение объема операции
ПРОТИВОПОКАЗАНИЯ (абсолютные)
- Наличие в брюшной полости гнойного содержимого
- Наличие в брюшной полости содержимого толстого кишечника
- Наличие в излившейся крови гемостатических препаратов на основе коллагена, дистиллированной воды и др.
ПРОТИВОПОКАЗАНИЯ (относительные)
- Наличие у больной злокачественного новообразования.
N.B. При кесаревом сечении с применением ИАРЭ необходимо помнить о наличии тромбопластических субстанций в околоплодных водах и возможности их переноса в сосудистое русло пациентки. Поэтому перед операцией у беременной целесообразно провести амниотомию. Также обязательно использование второго отсоса непосредственно после извлечения плода для аспирации околоплодных вод, сыровидной смазки, мекония.
Для проведения ИАРЭ применяют специальную дорогостоящую высокотехнологичную аппаратуру, с помощью которой хирург собирает из операционной раны изливающуюся кровь, а подготовленный специалист ex tempore приготавливает из нее концентрированные отмытые эритроциты, которые тут же, или в течение ближайших 6 часов возвращают больному. Плазму крови, как правило, утилизируют.
На сегодняшний день различные производители предлагают свои аппараты для проведения реинфузии эритроцитов. В большинстве из них используется принцип «перевернутой чаши»/«колокола» [1], они работают дискретно, «шаг за шагом». При этом этап отмывания начинается только после заполнения всего объема «колокола». В связи с этим, для различных объемов прогнозируемой кровопотери используется определенный объем проточно-сепарационной камеры/«колокола». Объём заполнения проточносепарационной камеры (колокола): 55 мл – пациенты небольшой комплекции, 125 мл – оперативное акушерство, ортопедическая хирургия, 175 мл – массивное кровотечение в ортопедической хирургии, сердечно-сосудистая хирургия, 225 мл – неотложная хирургия, травма, трансплантология. В качестве промывочного раствора используется стерильный 0,9% физиологический раствор. Информация о качестве отмывки поступает на дисплей аппарата в виде цветового индикатора.
Преимущества аппаратов дискретного типа:
- возможность контролирования процесса оператором, возможность повтора процесса при недостаточном качестве отмывки.
Недостатки:
- более медленное функционирование системы; поступление раневой крови и эвакуация готовой эритромассы через один и тот же канал [1].
В своей практике мы используем аппарат CATS®plus (Fresenius) Continuous Auto Transfusion System – система продлённой (непрерывной) аутотрансфузии (рис. 3). В данном аппарате используется непре- рывная поточная система - сепарационная камера в виде спирального канала (сепарация и одновременно отмывка). Таким образом, обеспечивается высокоэффективный процесс обработки эритроцитов вне зависимости от продолжительности и объема поступающей в аппарат крови. Для каждого этапа процедуры используется отдельная магистраль. Эффективно удаляется жир и примесь амниотической жидкости. Перед проведением процедуры необходимо получить информированное согласие пациента Время подготовки аппарата к работе специалистом минимально (4-5 мин.), что позволяет в экстренной ситуации оперативно начать процедуру ИАРЭ при акушерской кровопотере свыше 20% ОЦК.
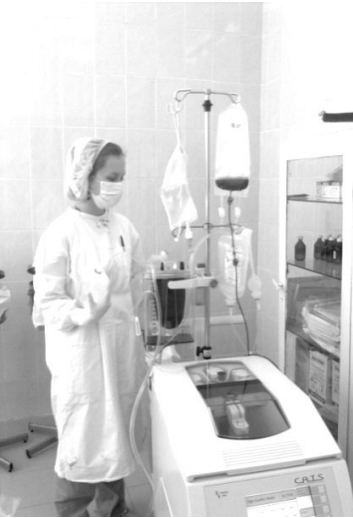
Рис.3. Внешний вид аппарата CATS® plus (Fresenius)
Основные этапы процедуры ИАРЭ с помощью аппарата CATS® plus
Сбор крови из раны производится с помощью стерильной 2-х просветной трубки «Double lumen suction line», один из каналов которой соединен с капельной системой для подачи антикоагулянта (цитрата натрия), по другому каналу аспирируется кровь из раны (рис.5). Таким образом, уже на входе кровь смешивается с антикоагулянтом (цитратом натрия). Предварительная фильтрация стабилизированной крови от сгустков и примесей осуществляется в вакуумном (рис.6) резервуаре (фильтр-120 микрон, максимальный объем 3 л). Давление должно быть не более 0,2 атм (зеленая зона манометра) - иначе разрушаются мембраны эритроцитов (рис.7).
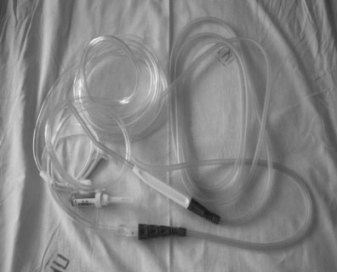
Рис. 5. Двухпросветная трубка «Double lumen suction line”
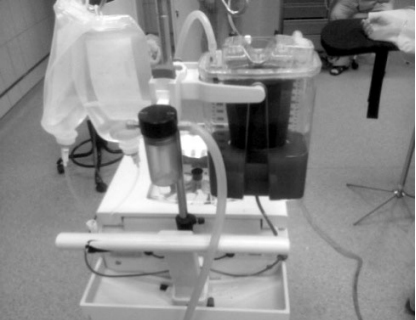
Рис. 6. Вакуумный резервуар

Рис. 7. Допустимая степень разрежения в вакуум - аспираторе
Обработка крови производится в сепарационной камере, конструктивными особенностями которой являются спиральные каналы и три роликовых насоса (рис. 8). В основе механизма сепарации лежит отличие плотности эритроцитов от плотности лейкоцитов, тромбоцитов, плазмы и различных примесей. Изза особого устройства камеры (рис. 9) эритроциты оседают при центрифугировании, в то время как менее плотные клетки крови, плазма с растворенным в ней свободным гемоглобином, детрит и т.п. – всплывают и переводятся в мешок для отходов.
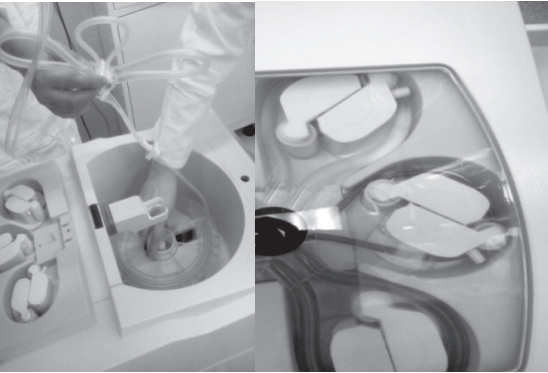
Рис. 8. Сепарационная камера (А) и роликовые насосы (Б)
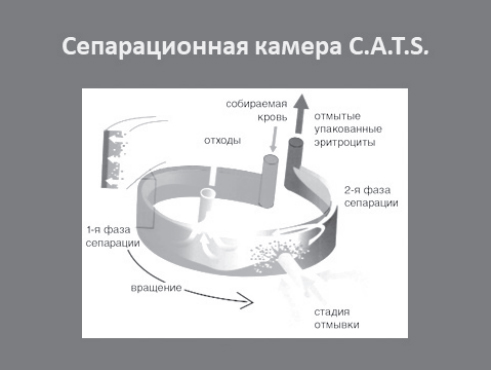
Рис. 9. Принцип работы сепарационной камеры аппарата CATS® plus
При достижении уровня гематокрита 60-65%, что фиксируется специальными датчиками, начинается этап отмывания. С помощью роликового насоса № 2 подается 0,9% раствор натрия хлорида, которым отмываются эритроциты. Путем повторного центрифугирования моющая среда, содержащая плазму, антикоагулянт и свободный гемоглобин отделяется и поступает в мешок для отходов. В зависимости от выбранной программы процедура повторяется от 1 до 7 раз.
Перевод отмытых эритроцитов в гемакон для трансфузии пациентке
Отмытые, концентрированные эритроциты с помощью роликового насоса № 3 поступают в мешок для готового гемокомпонента. На гемакон наклеивается этикетка. Возврат аутоэритроцитов проводится через прикроватный лейкоцитарный фильтр в соответствии с Федеральными клиническими рекомендациями «Интраоперационная реинфузия аутологичных эритроцитов при абдоминальном родоразрешении» [12]. После переливания гемакон с остатками аутоэритроцитов хранится в холодильнике в течение 48 часов (как и в случае трансфузии донорских компонентов крови).
В результате интраоперационной обработки раневой крови получается эритромасса из отмытых эритроцитов, которая представляет собой взвесь аутоэритроцитов в физиологическом растворе (рис.10). Недостатки такой эритромассы: нестабильность из-за отсутствия консервантов и питательных веществ и, соответственно, резкое укорочение срока хранения (максимально 6 час).
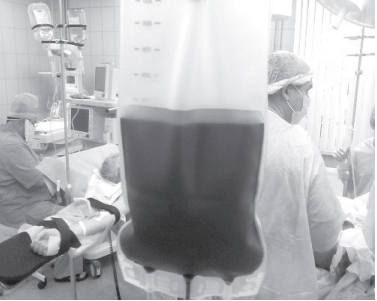
Рис. 10. Готовый аутоэритроконцентрат
Общая схема процедуры ИАРЭ представлена на рисунке 11.
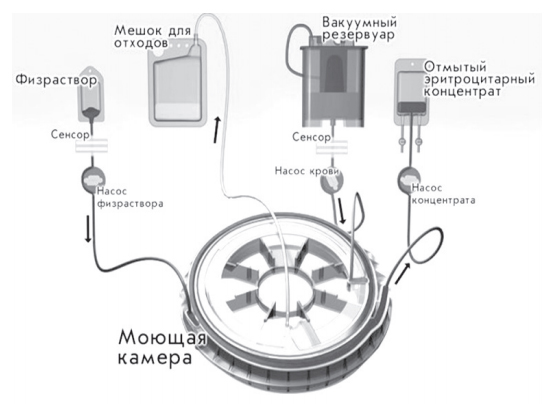
Рис. 11. Схема процедуры ИАРЭ с помощью аппарата CATS® plus (Fresenius)
Спектр режимов аппарата следующий:
- «Высококачественный» (High Quality Wash) тщательная обработка загрязнённой крови. 7 циклов (рис.12).
- «Качественный» (Quality Wash) стандартная программа обработки 5 циклов.
- «Ускоренный» – High Flow Wash для обработки чистой крови при массивной одномоментной кровопотере. 3 цикла. Поток – 30-70 мл/мин.
- «Быстрый» – Ultra Flow Wash для обработки чистой крови при массивной одномоментной кровопотере. 1 цикл. Поток 50-100 мл/мин.
- «Срочный» – Emergency Wash максимальная скорость обработки. 1цикл отмывания. Поток эритромассы 50-100 мл/мин.
- «Экстренный 190» (Blood Transfer 190) – система сбора и фильтрации в ургентных случаях. Поток 100-190 мл/мин. Кровь не отмыта и не концентрирована.
- «Экстренный 350» (BloodTransfer 350) – то же, но скорость 200-350 мл/мин.
- «Малообъёмный» (Low Volume Wash) - для педиатрии. 7 циклов отмывания.

Рис. 12. Выбор программы обработки крови на аппарате CATS® plus
К преимуществам непрерывного процесса обработки крови относятся:
- Возможность сбора, обработки крови с одновременным возвратом аутоэритроцитов.
- Минимальное гравитационное воздействие и короткое время обработки эритроцитов.
- Постоянное высокое качество реинфузата с гематокритом более 60%.
- Высокое качество реинфузата благодаря использованию трех магистралей.
- Обработка материала с низким гематокритом (салфетки).
- Возможность обработки малых объемов крови.
Обработка салфеток из операционного поля
С целью увеличения объема обрабатываемой «раневой» крови был предложен способ элиминации эритроцитов из операционных салфеток, пропитанных кровью. Салфеткипомещали в стерильную емкость, содержащую антикоагулянт и 0,9% раствор хлорида натрия, где их выдерживали в течение 20 - 30 мин. Далее салфетки извлекали, а взвешенные в растворе эритроциты обрабатывали в аппарате и возвращали в кровяное русло больного (рис.13).
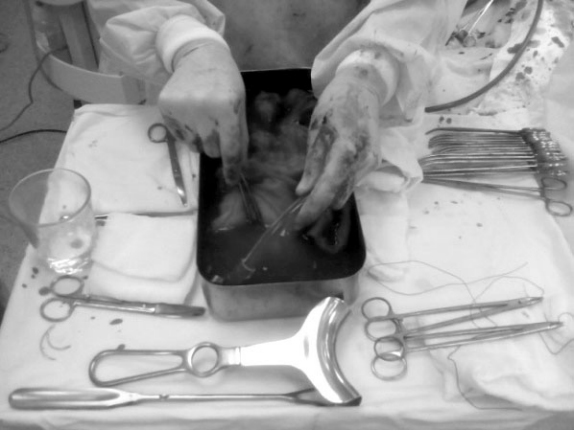
Рис. 13. Обработка операционных салфеток
Согласно данным авторов методики, элиминация из салфеток составляет 25,5±4,0% от величины учтенной кровопотери, выраженной в глобулярном объеме [13]. В настоящее время данный способ (модифицированная ИАРЭ), применяется в НИИ скорой помощи им. Н.В. Склифосовского, в родильных домах и перинатальных центрах Нижнего Новгорода.
Особенности проведения ИАРЭ в акушерстве
Широкому применению ИАРЭ в акушерстве долгое время препятствовала боязнь эмболии околоплодными водами (ЭОВ) вследствие контаминации реинфузата с амниотической жидкостью. С целью профилактики амниотической эмболии необходимо:
- Прекратить аспирацию собираемой крови в момент излития вод.Для этого использовать обычный хирургический отсос и операционное белье с пластиковыми карманами. Целесообразно проведение амниотомии перед операцией КС.
- Использовать режим высококачественной отмывки (7 циклов).
- Во всех случаях возврат аутоэритроцитов необходимо проводить через лейкоцитарный фильтр.
Согласно данным зарубежных коллег, на сегодняшний день сотрудников 80% родильных домов не пугает умозрительная опасность амниотической эмболии, барьером же для более широкого использования ИАРЭ является отсутствие должной подготовки, либо высокотехнологичной аппаратуры [14]. После осуществления возврата аутоэритроцитов с целью профилактики амниотической эмболии рекомендуется использование лейкофильтров (рис.14) с помощью которых эффективно устраняются остаточные элементы амниотической жидкости.
Рис. 14. Лейкоцитарный фильтр «Lipiquard SB»
Так, Ralph, C. еt al. [15] обследовали 70 пациенток, которым аутокровь после аппаратной обработки переливалась через фильтры лейкоредукции PallLeuko Guard RS. Уровень ?-фетопротеинов значительно снижался уже на этапе отмывания после аппаратной реинфузии, то есть до процесса фильтрации. Фильтры RS, согласно инструкции по применению, удаляют лейкоциты, частично – жир и микроагреганты после процедуры автоматической отмывки, однако фетальные чешуйчатые тела значительно снизились только после фильтрации [16].
Остается не полностью изученным вопрос относительно контаминации матери эритроцитами плода при проведении ИАРЭ [16]. Кроме того, не определен критический объем, вызывающий аллоиммунизацию. В недавнем исследовании [17] представлены данные о содержании фетальных эритроцитов в материнском кровотоке до родов, в ближайшем послеродовом периоде, а также определено их содержание в аутоэритромассе, обработанной с помощью Cell-Saver. Так, у 37% женщин были обнаружены плодовые эритроциты: перед родоразрешением - у 16% пациенток, после родов – у 53%. Фетальные эритроциты присутствуют в материнском кровообращении во время беременности и количество их сопоставимо с содержанием в аутоэритромассе при проведении ИАРЭ. Таким образом, исследование специалистов клиники Royal Cornwall подтверждает возможность применения ИАРЭ у всех пациенток, при этом не отмечено увеличения образования антител по сравнению с аллогенной трансфузией [17].
Такое осложнение ИАРЭ как трансфузионно индуцированная гипотония в настоящее время - доказанное явление, но оно возможно и без использования прикроватных лейкофильтров [18].
Cогласно Федеральным клиническим рекомендациям реинфузия эритровзвеси должна осуществляться с использованием лейкоцитарного фильтра [12].
Аппаратная реинфузия эритроцитов при массивной кровопотере после вагинальных родов (Cell Salvage of Vaginal Bleeding)
В настоящее время дискуссионным остается вопрос применения аппаратной обработки крови с помощью селл-сейвера при массивном кровотечении после родов через естественные родовые пути [18]. Очевидно, что такая кровь, может быть контаминирована бактериями. В клинической практике встречаются отдельные случаи успешного использования данной методики [19]. Преимущества возврата аутоэритроцитов в данной ситуации должны всегда сопоставляться с потенциальным риском. В каждом конкретном случае решение остается за лечащим врачом.
Weingarten Michaela et al. [20] приводят клиническое наблюдение 35-летней пациентки Свидетельницы Иеговы с послеродовым кровотечением в анамнезе. Из ее юридически заверенного документа следовало, что она отказывалась от применения крови или компонентов первичной крови, но соглашалась на незначительные доли препаратов крови и аппаратную реинфузию. Факторами риска были: индекс массы тела 43, аллергия на пенициллин. Антенатально получала препараты перорального железа, гемоглобин составлял 13,3 г/дл. В активной фазе родов выполнена эпидуральная анальгезия, родился здоровый ребенок массой 3,8 кг.
Несмотря на первичную профилактику кровопотери окситоцином, потребовалось ручное отделение плаценты, которое осложнилось значительным послеродовым кровотечением. Через 40 минут после родов продолжилась кровопотеря, гемоглобин снизился до 8,3 г/дл. Кровотечение не контролировалось, несмотря на использование Мизопростола, инфузии Синтоцинона, Эргометрина, четырех доз карбопроста, транексамовой кислоты, 4 единиц СЗП и рекомбинантного фактора VII.
Ввиду угрожающей жизни ситуации преимущества аутологичной трансфузии перевесили потенциальный риск заражения и незначительный риск эмболии амниотической жидкостью. Перед ручным отделением плаценты промежность и влагалище были обработаны антисептиками, накрыты стерильными пеленками. Влагалищную кровь извлекали через канюлю с широким отверстием. Большие сгустки крови, полученные вагинально, собирали в стерильной емкости с соблюдением асептики, откуда также проводилась фильтрация и высококачественная отмывка с помощью сэлл-сейвера (Haemonetics). Пациентке перелили 380 мл повторно обработанной крови с применением лейкофильтра. По ходу вмешательства получала цефуроксим и метронидазол.
Гемостаз был достигнут после двух доз криопреципитата и двух доз фактора VII. Гемоглобин составлял 7,4 г/дл, тромбоциты и коагуляция были нормальными. Внутривенный цефуроксим и метронидазол продолжали в течение 48 часов с последующим переходом на пероральной путь введения в течение семи дней. Через час после остановки кровотечения отмечался подъем температуры до 38,2°C, после внутривенного парацетамола - нормотермия. В дальнейшем подъемов температуры не было, бакпосевы крови в течение 48 часов отрицательные. Послеродовых септических осложнений не отмечено, выписана домой с выздоровлением, проинформирована о предпринятом аутологичном переливании крови и риске аллоиммунизации.
Вышеприведенное наблюдение подтверждает, что в случае отказа пациентки от переливания донорских компонентов крови при массивном кровотечении после родов через естественные родовые пути возможно применение аппаратной обработки крови с помощью селл-сейвера. При этом необходимы: соблюдение асептики-антисептики, аппаратная обработка собранной крови в режиме High Quality Wash, обязательное использование лейкоцитарных фильтров и антибиотикопрофилактика.
K.M. Teare et al. [21] был проведен сравнительный анализ качества аутоэритроцитов, обработанных с помощью селл-сейвера при послеродовом кровотечении (ПРК) и реинфузата при обработке крови во время кесарева сечения. Обработка вагинальной крови проводилась только для сравнительного анализа, возврат аутоэритроцитов родильницам при ПРК после вагинальных родов не производился. Как показали авторы, концентрации α-фетопротеина, ЛДГ и альбумина значимо снизились после отмывки. Бактериальная контаминация после обработки на аппарате составила 2 cfu/mL, а средний уровень фетальных эритроцитов 0,15 мл (диапазон 0-19 мл). Несмотря на то, что бактерии были обнаружены во всех образцах после отмывания и лейкофильтрации, остаточная контаминация оказалась аналогичной показателям, полученным при ИАРЭ. Очевидно, что необходимы дальнейшие исследования для обоснования безопасности применения данного метода в клинической практике.
Согласно последним данным Greenawalt, J. Zernell D. [22] необходимо внести некоторые изменения в стандартную операционную процедуру и непрерывное образование в использовании селл-сейвера в акушерстве, которые помогут свести к минимуму негативные последствия при жизнеугрожающем ПРК. Авторами предложен следующий алгоритм проведения аппаратной обработки эритроцитов при массивном ПРК:
- Необходимо собрать мультидисциплинарную бригаду (акушер, анестезиолог, трансфузиолог, акушерка родзала).
- Обработка крови не начинается до тех пор, пока не будет собран соответствующий объем, хотя сбор начинается с момента отделения плаценты.
- Пропитанные кровью салфетки помещают в стерильный гепаринизированный раствор. Принимаются необходимые меры для отделения теряемой крови от загрязняющих веществ.
- Кровь аспирируется 2 отсосами.
- Путем обработки на селл-сейвере удаляется плазма с растворенными в ней примесями, лейкоциты, микроагрегаты, тромбоциты, свободный гемоглобин, циркулирующие антикоагулянтные факторы и большая часть гепарина.
- Обработанная суспензия аутоэритроцитов переводится в инфузионный мешок и возвращается пациентке через лейкофильтр.
- Обработка полного резервуара крови может обеспечить 250 мл аутоэритроцитов гематокритом от 55 до 80%.
Недостатки аппаратной реинфузии
Несмотря на все перечисленные преимущества аппаратной реинфузии крови, в ряде случаев являющейся жизнеспасающей технологией, последняя, как и любая методика, не лишена недостатков, ошибок при использовании и осложнений.
- Высокая стоимость аппаратуры и расходных материалов. Стоимость последних для одной процедуры реинфузии составляет порядка 120-150 американских долларов.
- Невозможность сохранить плазму крови и тромбоциты приводит к потере факторов свёртываемости и нарушениям гемостаза. Вместе с плазмой теряются и иммуноглобулины - Ig G, Ig А и Ig М, альбумин и другие белки крови со всеми вытекающими последствиями.
- Множество различных примесей попадает в раневую кровь и поступает в вакуумный резервуар при сборе ее хирургическим аспиратором: ткани и жидкости организма, частицы материалов из которых сделаны хирургическое белье, расходные принадлежности, инструменты и т.п. Процедура обработки крови в аппарате типа Cell Saver не может полностью гарантировать их удаление при центрифугировании и отмывании, если плотность частиц выше плотности плазмы. К таким примесям относятся микроагрегаты крови, микробы и клетки опухолей. Обычные фильтры систем для переливания крови с порами размером 120-170 мкм их не задерживают. По этой причине рекомендуют использовать тонкие (40 мкм) или «супертонкие» лейкоцитарные фильтры. Надо отметить, что только последние способны полностью предотвратить попадание в кровоток клеток злокачественных опухолей вместе с возвращаемой эритромассой.
Всё вышеперечисленное предоставляет широкое поле деятельности разработчикам усовершенствованной аппаратуры для ИАРЭ.
Типичные осложнения ИАРЭ
Коагулопатии. Возможны серьезные посттрансфузионные нарушения гемостаза, что объясняется присутствием конгломератов из лейкоцитов и тромбоцитов при неправильно выбранном режиме обработки крови. Удлинение АЧТВ или тромбинового времени должно насторожить врача и может быть сигналом для использования антагонистов.
Гемолиз. Механическая обработка крови, пропускание ее через роликовый насос и длинные магистрали всегда чреваты развитием гемолиза, а, следовательно, острой почечной недостаточности. К разрушению эритроцитов может приводить слишком интенсивная работа роликовых насосов при экстренных режимах отмывки. [11]. В акушерстве рекомендован режим High Quality Wash (40 мл/мин). Профилактика гемолиза состоит в тщательном отмывании крови. Следует обратить особое внимание на ограничение степени разрежения в вакуум-аспираторе. Максимальное разрушающее действие на эритроциты наблюдается при использовании ультразвукового аспиратора. Недопустимо применение металлических насадок при аспирации крови из раны. При клинически значимом гемолизе используют осмодиуретики, ощелачивают плазму. Определенное значение имеет и недостаток глюкозы для питания эритроцитов. В связи с этим, целесообразно начинать возврат аутоэритровзвеси как можно раньше.
Объем pеинфузиpованной кpови. Так, pеинфузия 500 мл кpови, собpанной из бpюшной полости, не вызывает выpаженных изменений гемокоагуляции, однако после массивных pеинфузий (более 1000 мл) возможно pазвитие ДВС-синдpома [23].
В то же время, несмотря на наличие определенных рисков и потенциальных осложнений, ИАРЭ при правильном применении является эффективной и безопасной процедурой. Более того, при сочетанном использовании с другими кровесберегающими методиками она позволяет минимизировать применение донорской эритромассы. Последнее особенно важно при необходимости проведения оперативного вмешательства во время беременности с прогнозируемой кровопотерей более 20% ОЦК. Для иллюстрации вышесказанного приводим наш клинический пример.
Клинический пример
Пациентка С., 32 года, поступила в «Дзержинский перинатальный центр» с диагнозом: гигантская миома матки. Беременность 7-8 нед. Анемия тяжелой степени (HB 39 г/л). Миоматозный узел 16х18 см. Жалобы: слабость, головокружение, дизурические расстройства. Применялись препараты парентерального железа (феринжект), эритропоэтин, дюфастон (HB 39 ? 49 ? 78 г/л). Репродуктивная функция не выполнена, категорический отказ от прерывания беременности. На сроке 15 недель матка до 25-26 недель, бугристая. Жалобы на боли внизу живота, дизурию. (HB 82 г/л). УЗИ от 09.09.16 по передней стенке межмышечный узел 23х20х16 см, нижний край на уровне внутреннего зева, с элементами деструкции, 1 живой плод.
Учитывая опыт ведущих учреждений [24], принято решение об оперативном лечении в объеме консервативной миомэктомии с применением командного подхода, кровесберегающих технологий, в том числе ИАРЭ. Операция проведена под эпидуральной анестезией. Превентивно перед кожным разрезом внутривенно введена транексамовая кислота (2000 мг). Гемодинамика стабильная, без вазопрессоров. Послеоперационное обезболивание – эпидуральная анальгезия и НПВС. Программа ИТТ: сбалансированные кристаллоиды 1000 мл, искусственные коллоидные растворы 1500 мл, аутоэритроциты 490 мл (C.A.T.S). Модифицированная ИАРЭ с обработкой салфеток из операционного поля. Возврат аутоэритроцитов через лейкофильтр. Объем ИТТ 2990 мл (интраоперационно). Оценка кровопотери проводилась по данным Cell-Saver(а) и составила 1400 мл. Длительность операции 2 ч. 10 мин. Донорские эритроциты, СЗП и ФСК не потребовались. Динамика лабораторных показателей пациентки С. представлена в таблице 1.
Таблица 1. Лабораторные показатели пациентки С. в периоперационном периоде
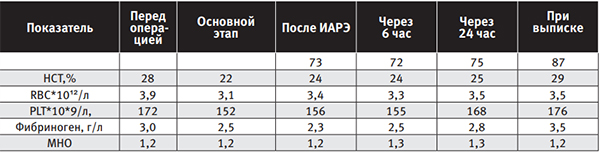
УЗИ-исследование проводилось по окончанию операции, затем через 24 часа, беременность сохранена. В дальнейшем беременность прогрессировала и в сроке 37 недель выполнено плановое кесарево сечение под спинальной анестезией без осложнений. Ребенок 2600 г, 8/8 баллов по шкале Apgar. Исходный гемоглобин 112 г/л после операции 96 г/л, при выписке 97 г/л. Выписана на 6-е сутки домой с ребенком.
У пациентки применялись следующие технологии кровесбережения: предоперационная коррекция анемии, аппаратная реинфузия эритроцитов, регионарная анестезия и антифибинолитики. Таким образом, командный подход, применение комплекса кровесберегающих технологий позволили выполнить рекоструктивно-пластическую операцию при миоме матке во время беременности, что и определило возможность пролонгирования беременности и благополучное родоразрешение.
Заключение
ИАРЭ на сегодняшний заняла прочное место в акушерской практике. Несмотря на определенный «акушерский консерватизм» и риски, связанные с ЭОВ, а также необходимость приобретения и эксплуатации высокотехнологичного оборудования, включая дополнительное обучение специалистов, преимущества ИАРЭ при массивной кровопотере в акушерстве при правильном и своевременном применении бесспорны:
- Аппаратная реинфузия эритроцитов эффективна и безопасна при массивной акушерской кровопотере.
- Аппаратная реинфузия эритроцитов создает лучшие условия с одной стороны, для проведения органосберегающих операций (уменьшение числа гистерэктомий), а в случае необходимости - для расширения объема операции (кесарево сечение и миомэктомия).
- Аппаратная реинфузия эритроцитов способствует сокращению сроков пребывания в стационаре, числа аллогенных гемотрансфузий, медикаментозной нагрузки на пациентку.
- Проведение ИАРЭ диктует необходимость параллельной коррекции гемостаза, использование командного подхода.
Литература
- Лубнин А.Ю., Громова В.В., Ханзен Э. Реинфузия крови в хирургии. Изд-во «Триада», 2013.-432с.
- Blundell,J.(1818). Experimentsonthe transfusionofbloodbythesyringe.Medico-ChirurgicalTransactions,9(Pt1), 56-92. 136.
- Highmore, W. (1874). Practical remarks on an overlooked source of blood supply for transfusion in post-partum haemorrhage. Lancet, 103(2629),
- Duncan J. On re-infusion of blood in primary and other amputations. Br. Med. J., 1886, 1, 192-193
- РФ. Приказ№183-н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов», 2 апреля 2013 г.
- Klebanoff GD, Watkins D. A disposable autotransfusion unit Am. J. Surg., 1968, 116, 475-476.
- Gilcher R.O., Orr M.D. Intraoperative autotransfusion. Transf., 1975, 15, 520.
- Хватов В.Б., Кобзева Е.Н. Реинфузия крови. В кн.: Аутодонорство и аутогемотрансфузии: руководство. Под ред. А.А. Рагимова. М: ГЭОТАР-Медиа 2011; 153-193.
- Струк Ю.В., Замятина Н.А., ЯкушеваО.А., Н.Н. Чайкина Н.Н.Микрореологические свойства эритроцитов после аппаратной обработки. Научно-практический журнал. 2016.- № 65.С. 200-205.
- Замятина Н.А., Струк Ю.В., Якушева О.А. Функциональное состояние эритроцитов после обработки аппаратом Cell-Saver. Вестник совр. науки. 2016.- № 1. С. 135-139.
- Вартанов В.Я., Вартанова И.В., Хуторская Н.Н., Вольгов Л.А. и др. Аппаратная реинфузия крови в лечении острой кровопотери. Тольяттинский мед консилиум. 2011. №3-4. С.43-48.
- Федеральные клинические рекомендации. «Интраоперационная реинфузия аутологичных эритроцитов при абдоминальном родоразрешении» РОАГ, ФГБУ «НЦ АГиП им. В.И. Кулакова» МЗ РФ. М, 2013.С.9.
- Пат. 2232031 РФ. Способ интраоперационной аппаратной реинфузии аутокрови / Ермолов А.С., Сахарова Е.А., КлюквинИ.Ю., Хватов В.Б., Боголюбский Ю.А. / опубл. 10.06.2004, бюл. № 19.
- Guidance forthe provision ofIntraoperative CellSalvage – Appendices AUSICSVersionNo: 1.March 2014. AppendixV. Use of Intraoperative Cell Salvage in Obstetrics.
- Ralph, C., Faulds, J. andSullivan, I. Cell salvage and leucocyte depletion filters. Anaesthesia, 2010.65:1228–1229.doi: 10.1111/j.1365 2044.2010.06547.
- Ralph, C., Sullivan, I., Faulds, J. Intraoperative cell salvaged blood as part of a blood conservation strategy in Caesarean section: is fetal red cell contamination important? BJA.Vol.107, Issue 3, 2011, P.404–408, https://doi.org/10.1093/bja/aer168.
- Sullivan, I.J.&Ralph, C.J. (2018).Obstetric intra-operative cell salvage and maternalfetalred cell contamination:Obstetric ICSand maternal fetal RBC contamination. TransfusionMedicine.10.1111/tme.12510.
- Liumbruno GM, Liumbruno C, Rafanelli D. Autologous blood in obstetrics: where are we going now? BloodTransfusion. 2012;10(2):125-147. doi:10.2450/2011.0010-11.
- Wilson M. J.,& Wrench, I. J. (2015). Cell salvage for vaginal delivery – is ittimewe considered it? International Journal ofObstetric Anesthesia, 24(2), 97-99. http://dx.doi.org/10.1016/j.ijoa.2015.03.002.
- Weingarten M, RaoS., Toop K.,Simpson H. Winnard, J.. (2016). Use ofthe cell salvage forre-infusion of autologous blood retrieved vaginally in a case of major postpartum haemorrhage. European Journal of Obstetrics & Gynecology and Reproductive Biology. DOI: https://doi. org/10.1016/j.ejogrb.2016.11.002.
- Teare, K.M.,Sullivan, I.J., and Ralph, C.J. Is cell salvaged vaginal blood loss suitable forre-infusion? Int. J.Obstet. Anesth. 2015; 24: 103–110.
- Greenawalt, Julia &Zernell, Denise. (2017). Autologous Blood Transfusion for Postpartum Hemorrhage. MCN, The American Journal of Maternal/Child Nursing. 42. 269-275. 10.1097/NMC.
- Селицкая С.С., Хватов В.Б., Тихомиpов H.И. К вопpосу о pеинфузии кpови.- В кн.:Hовое в тpансфузиологии.-М., 1993.-Вып.3.-С. 30-33.
- Буянова С.Н., Гукасян С.А., Юдина Н.В. Миомэктомия во время беременности: показания, особенности хирургической тактики и анестезии, предоперационная подготовка и реабилитация. Клинический случай / РМЖ № 19, 2014. С. 1428-1430.
|

