Гидроксиэтилкрахмалы
Различные препараты – различные эффекты
(часть 1)
Статья опубликована в журнале Anesthesiology 2009; 111:187-202
Появление нового поколения гидроксиэтилкрахмалов (ГЭК) способствовало возобновлению интереса к изучению их потенциала. Применение препаратов ГЭК первого и второго поколения в высоких дозах оказывало отрицательное воздействие на функцию почек, систему свертывания крови и вело к накоплению их в тканях, что ограничивает их применение в клинике. Новые препараты ГЭК имеют меньшую степень молярного замещения и молекулярную массу in vivo , в связи с чем их метаболизм и выведение из крови происходят быстрее. В настоящем обзоре рассматриваются различия между поколениями ГЭК. Особое внимание уделяется более высокой безопасности препаратов третьего поколения, которая достигается без потери эффективности препарата, что противоречит допущению, согласно которому эффективность препаратов ГЭК напрямую связана с их концентрацией в плазме. Также рассматривается влияние источника действующего вещества на структуру и фармакокинетические свойства препарата. Кроме этого, анализируется роль несущего раствора.
В систематическом обзоре RECENT, посвященном рандомизированным клиническим исследованиям по применению инфузионной терапии при различных видах хирургического лечения, не было выявлено убедительных данных, на основании которых можно было бы утверждать, что какой-либо вид инфузионной терапии превосходит другие. Также не было получено достаточных доказательных данных, на основании которых можно было бы определить оптимальный объем инфузионной терапии при плановых хирургических вмешательствах.1 Поэтому был сделан вывод, что для каждого вида хирургического вмешательства должны быть выработаны свои рекомендации по инфузионной терапии, проводимой в периоперационном периоде. В связи с отсутствием убедительных доказательных данных о превосходстве того или иного подхода инфузионная терапия должна быть индивидуализированной и направленной на достижение конкретных целей. В настоящее время представляется, что проведение инфузионной терапии с ограничением ее объема пациентам, подвергающимся колоректальным хирургическим вмешательствам, обеспечивает более благоприятные результаты, чем ее проведение без ограничений. В то же время, у пациентов, у которых развивается системная воспалительная реакция, «агрессивная» инфузионная терапия оказывает более благоприятное действие, что было показано Rivers с сотр.2 и поддерживается в современных рекомендациях по лечению сепсиса.3
Это соответствует выводам Brandstrup , который провел критический анализ имеющихся доказательных данных по стандартной инфузионной терапии и влиянию инфузионной терапии на исходы хирургического лечения.4 Этот автор констатирует, что выбор стандартной инфузионной терапии, как правило, не осуществляется на основе доказательных данных, а методологические недостатки работ, в которых производились попытки ограничения объема инфузионной терапии, привели к тому, что вместо ограничения жидкости проводилось простое восполнение дефицита жидкости. Поэтому, рекомендуется восполнять дефицит жидкости и избегать введения ее в избыточном объеме, что является отголоском более ранних рекомендаций по введению в практику интраоперационной целенаправленной инфузионной терапии.5
Несмотря на отсутствие четких рекомендаций по любым видам инфузионной терапии, широко обсуждаются относительные достоинства кристаллоидов и коллоидов, а также различных видов коллоидов. Как недавно было отмечено Boldt в редакционной статье, «исследователи, которые показывают, что кристаллоиды лучше, всегда получают результаты, свидетельствующие о том, что они лучше, а сторонники коллоидов всегда получают результаты в пользу коллоидов».6 В настоящем обзоре не делается попыток вступить в эти дискуссии. В нем рассматриваются накопленные к настоящему времени знания по одному из видов синтетических коллоидов, а именно – гидроксиэтилкрахмалам (ГЭК), и особое внимание уделяется вопросу их безопасности. В течение последних нескольких лет был достигнут значительный прогресс в этой области. ГЭК нового поколения существенно отличаются по своим свойствам от ранних препаратов. Если индивидуализированная терапия является наиболее эффективной, необходимо иметь представление о том, что может дать пациенту применение различных видов ГЭК.
Эволюция препаратов ГЭК: от гетакрахмала к тетракрахмалу.
Первый препарат ГЭК, Hespan® (ДюПонт Фармасьютикалс, Уиллингтон, шт. Делавэр), появился в США в 1970-х годах. После этого было создано несколько поколений препаратов ГЭК, которые отличались друг от друга по величине средней молекулярной массы (ММ), степени молярного замещения (МЗ) и величине отношения С2/С6. Гидроксиэтилкрахмалы описывают тремя числами, например 10% ГЭК 200/0,5 или 6% ГЭК 130/0,4. Первое число отражает концентрацию раствора, второе – среднюю молекулярную массу, выраженную в килодальтонах (кДа) и третье число, являющееся наиболее важным, - степень молярного замещения. Все эти показатели имеют очень большое значение для фармакокинетики ГЭК (таблица 1).
Таблица 1.
Характеристики препаратов гидроксиэтилкрахмала
| Концентрация и растворитель | Средняя молекуляр. масса, кДа | Степень моляр. замещ-я | Отнош-е С2/С6 | Макс. суточная доза, мл/кг | |
| ГЭК 670/0,75 | 6% сбалансированный раствор | 670 | 0,75 | 4,5:1 | 20 |
| ГЭК 600/0,7 | 6% физиологический раствор | 600 | 0,7 | 5:1 | 20 |
| ГЭК 450/0,7 | 6% физиологический раствор | 480 | 0,7 | 5:1 | 20 |
| ГЭК 200/0,62 | 6% физиологический раствор | 200 | 0,62 | 9:1 | 20 |
| ГЭК 200/0,5 | 6% физиологический раствор 10% физиологический раствор |
200 | 0,42 | 5:1 | 33 20 |
| ГЭК 130/0,42 | 6% физиологический раствор | 130 | 0,42 | 6:1 6:1 | 50 |
| ГЭК 130/0,42 | 6% сбалансированный раствор 10% сбалансированный раствор |
130 | 0,4 | 6:1 | 50 33 |
| ГЭК 130/0,4 | 6% физиологический раствор 10% физиологический раствор |
130 | 0,4 | 9:1 | 50 33 |
| ГЭК 130/0,4 | 6% сбалансированный раствор | 130 | 0,4 | 9:1 | 50 |
| ГЭК 70/0,5 | 6% сбалансированный раствор | 70 | 0,5 | 3:1 | 20 |
Источник: Kozek - Langenecker с сотр. 39 и Boldt с сотр.104
Концентрация
Концентрация влияет, главным образом, на начальное волемическое действие: растворы ГЭК 6% являются изо-онкотическими in vivo ; 1 л раствора замещает около 1 л крови. Растворы с концентрацией 10% являются гиперонкотическими. Увеличение ОЦК при их введении значительно превосходит объем введенного раствора (около 145%). (Краткая характеристика лекарственного средства Hemohes 10%. Представлена на веб-сайте www.fachino.de Доступ 15 мая 2009 г. Краткая характеристика лекарственного средства HAES - Steril 10%. Представлена на веб-сайте www.fachino.de Доступ 15 мая 2009 г.)
Молекулярная масса
Так же как и все другие синтетические коллоиды ГЭК представляют собой полидисперсную систему, содержащую частицы, молекулярные массы которых составляют достаточно широкий диапазон. При определении массы частицы или относительной молекулярной массы в полидисперсной системе получают среднее значение, величина которого зависит от используемого метода расчета. ММ можно представить двумя способами: ММ, усредненная по массе, (Mw) и ММ, усредненная по количеству частиц, (Мn).
ММ, усредненная по количеству частиц, Мn, рассчитывается следующим образом:
Mn=∑niM (i)/∑ni
ММ, усредненная по массе, ( Mw), рассчитывается следующим образом:
Mw=∑ni{M(i)}2/∑niM(i)
где niи M ( i ) – количество частиц i и относительная молекулярная масса частиц i , соответственно .
ММ, усредненная по массе, в большей степени зависит от более крупных молекул в системе и ее величина выше, чем величина ММ, усредненной по количеству частиц. Отношение Mw/ Mn является индексом полидисперсности системы. При введении полидисперсного коллоидного раствора в систему кровообращения малые молекулы, размеры которых ниже величины почечного порога (45-60 кДа7), быстро выводятся, в то время как более крупные молекулы остаются в системе кровообращения в течение более длительного времени, которое зависит от их размеров и скорости распада. Осмотическая эффективность определяется количеством частиц, а не размерами молекулы. В связи с этим экскреция частиц малого размера приводит к непрерывному снижению осмотической эффективности вводимого раствора. Она компенсируется постоянным образованием онкотически активных молекул, образующихся в результате распада более крупных фрагментов. Средняя ММ представленных на рынке препаратов находится в диапазоне от 670 кДа до 70 кДа (таблица 1). Однако, физико-химические свойства, метаболизм и экскреция преимущественно определяются степенью МЗ и характером замещения. In vitro МЗ оказывает слабое влияние на накопление препарата в плазме, однако фармакокинетические свойства препаратов ГЭК с одинаковой ММ и разной степенью МЗ значительно отличаются, например, препараты ГЭК 200/0,62 и ГЭК 200/0,5.8
Степень молярного замещения.
Количество гидроксиэтильных групп, соединенных с частицами безводной глюкозы в полимере ГЭК, варьирует. Это замещение способствует увеличению растворимости крахмала в воде, и, в той или иной степени, обусловливает снижение скорости разрушения полимера крахмала под действием амилазы. Также как и в отношении ММ, имеется два способа расчета степени замещения в полимере крахмала. Посредством первого из них степень замещения, рассчитывается путем деления количества остатков безводной глюкозы, в которых имеются замещающие гидроксиэтильные группы, на общее количество остатков безводной глюкозы:
СЗ= Gs /Gt ,
где СЗ – степень замещения, Gs – количество остатков безводной глюкозы, в которых имеются замещающие гидроксиэтильные группы, и Gt – общее количество остатков безводной глюкозы в полимере. Используя второй способ, получают степень молярного замещения (СМЗ), которую рассчитывают как среднее число гидроксиэтильных групп, прореагировавших с остатками безводной глюкозы, по следующей формуле:
СМЗ= (WH/(1- WH))*162/44
где WH – массовая доля гидроксиэтильных групп в полимере. Числа отражают молекулярную массу гидроксиэтильной группы (44) и остатка безводной глюкозы (162). На каждый остаток безводной глюкозы может приходиться более чем одно замещение; поэтому, в результате такого расчета, как правило, получается, более высокая величина, чем степень замещения. Степень МЗ, таким образом, является средним числом гидроксиэтильных групп, приходящихся на одну молекулу глюкозы. Число 0,7 в описании препарата ГЭК означает, что в среднем на 10 молекул глюкозы приходится 7 гидроксиэтильных остатков. Крахмалы с таким уровнем замещения называют гетакрахмалами. Подобную терминологию используют для обозначения и других уровней замещения: гексакрахмал (СМЗ=0,6), пентакрахмал (СМЗ=0,5), тетракрахмал (СМЗ=0,4). Остатки безводной глюкозы, в которых замещение отсутствует, более доступны ферментативному расщеплению посредством a -амилазы. Гидроксиэтилирование способствует замедлению скорости ферментативного расщепления молекулы ГЭК и увеличению времени ее циркуляции в кровеносном русле. Как будет показано ниже, препараты ГЭК ранних поколений, имеющие высокую степень МЗ, накапливаются в плазме в отличие от тетракрахмалов последнего поколения.
Отношение С2 / С6
Характер гидроксиэтилирования также оказывает значительное влияние на фармакокинетические свойства, однако это может упускаться из вида, так как данные о нем не указываются в обычной характеристике продукта, отражающей лишь ММ и СМЗ. Гидроксиэтилирование субъединиц глюкозы обычно происходит с участием атомов углерода C2 и С6 (рис. 1).
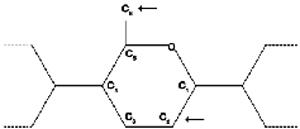 |
| Рис. 1. Замещение гидроксиэтильными группами в субъединицах глюкозы гидроксиэтилкрахмала (ГЭК) происходит преимущественно в положении C2 и С6. |
Гидроксиэтильные группы, находящиеся в положении атома С2, в большей степени препятствуют доступу a -амилазы к субстрату, чем гидроксиэтильные группы, соединенные с атомом C6.9 Исходя из этого, можно ожидать, что препараты ГЭК с высокой величиной отношения С2 / С6 будут распадаться медленней. В исследовании, проведенном Jung с сотр.10, было выполнено сравнение двух растворов ГЭК с одинаковыми ММ и СМЗ (ГЭК 200/0,5) и различающейся величиной отношения С2 / С6 при использовании у 6 добровольцев. Было отмечено, что площадь под кривой концентрации препарата в плазме была больше в группе пациентов, получавших препарат с более высокой величиной отношения С2 / С6, подтверждая, что ее увеличение способствует снижению интенсивности гидролиза посредством a -амилазы. Продолжительность периода, в течение которого сохранялась гемодилюция, в этой группе также была выше.
В исследовании, выполненном Treib с сотр.11, в котором приняли участие пациенты с цереброваскулярными заболеваниями, было проведено сравнение двух пентакрахмалов (10% ГЭК 200/0,5), отличающихся только по величине отношения С2 / С6. В группе, получавшей ГЭК с меньшей величиной отношения С2/С6, концентрация препарата в плазме была ниже, начиная с 3 дня (рис. 2), а ММ in vivo в плазме при использовании этого раствора ГЭК снижалась в гораздо большей степени.
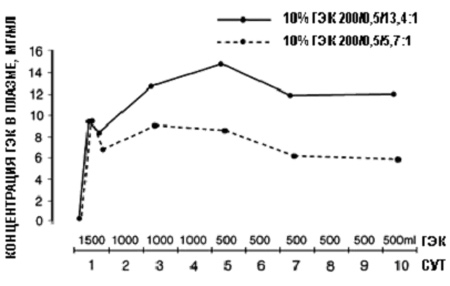 |
| Рис. 2. Концентрация в плазме двух пентакрахмалов с отличающейся величиной отношения С2/С6 при проведении гемодилюционной терапии в течение 10 суток: гидроксиэтилкрахмал (ГЭК) 10% 200/0,5/13,4:1 и ГЭК 10% 200/0,5/5,7:1 (Величина Р для разницы между двумя препаратами ГЭК становится меньше 0,01 с третьей точки на первые сутки). Воспроизведено с разрешения Treib J. с сотр.11 |
В ряде исследований, проведенных с участием добровольцев и пациентов, подвергающихся кардиохирургическим и другим вмешательствам, было отчетливо показано, насколько эти структурные различия между поколениями препаратов оказывают влияние на фармакокинетические свойства.
Исследования фармакокинетики.
Опубликованные данные по фармакокинетике различных видов растворов ГЭК представлены в таблицах 2 и 3 и на рисунке 3.
Таблица 2.
Фармакокинетика различных препаратов гидроксиэтилкрахмала (ГЭК)
после однократного введения здоровым добровольцам (начало).
| Доза, г | Сmax, мг/мл | Т ½α, часы | Т ½β, часы | Т ½ центр, часы | |
| HES 670/0,75 (6%)13 | 0,6/ кг | 13 | 6,3* | 46 ,4† | данных нет |
| HES 450/0,7§ (6%)14 | 30 | 7,8 | данных нет | 300¶ | данных нет |
| HES 200/0,62 (6%)12 | 30 | 5,2 | 5,08 | 69,7 | 44,42 |
| HES 200/0,5 (6%) | 30 | 6 | данных нет | данных нет | данных нет |
| HES 200/0,5 (10%)12 | 50 | 8,0 | 3,35 | 30,6 | 7,12 |
| HES 130/0,4 (6%)19 | 26,3 | 3,7 | 1,39# | 12,0031# | 1,55 |
| HES 130/0,42 (6%)34 | 60 | 10,10 | 12,0142 | ||
| HES 130/0,4 (10%)19 | 44,1 | 6,5 | 1,54# | 12,8# | 1,82 |
Таблица 2.
Фармакокинетика различных препаратов гидроксиэтилкрахмала (ГЭК)
после однократного введения здоровым добровольцам (продолжение).
| ППК (бесконечность), мг*мл-1*ч-1 | Клиренс, мл/мин | Длит-сть введения, мин | |
| HES 670/0,75 (6%)13 | 926,0 | 0,98 | 20‡ |
| HES 450/0,7 § (6%)14 | данных нет | данных нет | 60 |
| HES 200/0,62 (6%)12 | данных нет | 1,23 | 30 |
| HES 200/0,5 (6%) | данных нет | 4,88 | 15 |
| HES 200/0,5 (10%)12 | данных нет | 9,24 | 30 |
| HES 130/0,4 (6%)19 | 14,3 | 31,4 | 30 |
| HES 130/0,42 (6%)34 | 58**†† | 19 | 30 |
| HES 130/0,4 (10%)19 | 28,8 | 26,0 | 30 |
Источники данных: Lehmann c сотр., 34 Jungeinrich с сотр., 138 и Краткая характеристика лекарственного средства Тетраспан (†† Краткая характеристика лекарственного средства Тетраспан 6%; представлено на веб-сайте www. fachinfo.de; доступ – май 2009 г.)
* Среднее значение для периода времени с 0 до 8 часов;
† среднее значение для периода времени 7-10 сут;
‡ рассчитано исходя из массы тела 70 кг;
§ данные этикетки, на самом деле 670/0,75;
¶ для периода с 7 по 28 дней после завершения лечения;
# независимо от модели;
** определялась после введения 1000 мл; во всех других исследованиях использовался объем 500 мл.
ППК- площадь под кривой концентрации препарата в плазме; С max максимальная концентрация в плазме; Т ½α период полураспределения; Т ½β период полувыведения; Т ? центр период полувыведения из центрального компартмента.
Таблица 3.
Фармакокинетика и остаточная концентрация в плазме
различных препаратов ГЭК после многократного введения здоровым добровольцам. (начала)
| Кумулятивная доза, г | Длительность периода лечения, сут | Концентрация в плазме через 24 ч после последнего введения мг/мл | Клиренс, мл/мин | |
| ГЭК 450/0,715 | 90 | 3 (3 × 30 г) | 9,6 | <1 |
| ГЭК 200/0,62† 8 | 150 | 5 (5 × 30 г) | 7,8 | 0,983‡ |
| ГЭК 200/0,5† 8 | 250 | 5 (5 × 50 г) | 3,4 | 4,86‡ |
| ГЭК 200/0,5139 | 250 | 5 (5 × 50 г) | 3,4 | н/д |
| ГЭК 130/0,42140 | 250 | 5 (5 × 50 г) | 0,7 | н/д |
| ГЭК 130/0,420 | 500 | 10 (10 × 50 г) | <0,5 | 22,8§ |
| ГЭК 70/0,57 | 250 | 5 (5 × 50 г) | 3,0 | н/д |
Таблица 3.
Фармакокинетика и остаточная концентрация в плазме различных препаратов ГЭК
после многократного введения здоровым добровольцам. (продолжение)
| Т ½;α, часы | Т ½β, часы | Т ½ центр, часы | ППК, мг*мл-1*ч-1 | ||
| Сутки 1 | Последние сутки* | ||||
| ГЭК 450/0,715 | н/д | н/д | н/д | н/д | >>сут 1 |
| ГЭК 200/0,62† 8 | 0,568 | 11,6 | 211 | 508 | >>сут 1 |
| ГЭК 200/0,5† 8 | 0,389 | 6,98 | 113 | 171 | >>сут 1 |
| ГЭК 200/0,5139 | н/д | н/д | н/д | 62,6 | 96,2 |
| ГЭК 130/0,42140 | 3,81** | н/д | н/д | 28,41 | 36,57 |
| ГЭК 130/0,420 | 1,14 | 9,1¶ | н/д# | 32,8 | 35,7 |
| ГЭК 70/0,57 | н/д | н/д | н/д | н/д | >>сут 1 |
* Сутки 3, 5 или 10 соответственно длительности лечения;
† трех-компартментная модель;
‡ принимая в рассмотрение сутки с 1 по 5;
§ сутки 1: 23,7; сутки 10: 21,8;
¶ средние величины суток 1 и 10;
# неприменимо в использованной двух-компартментной модели, при использовании трех-компартментной модели было бы получено значение 33 ч;
** представлена только одна величина для периода полувыведения в первые сутки; на пятые сутки длительность периода полувыведения возросла до 4,72 ч.
ППК- площадь под кривой концентрации препарата в плазме;
Сmax максимальная концентрация в плазме;
н/д – величина в источнике не указана,
Т ½α период полураспределения;
Т ½β период полувыведения;
Т ½ центр период полувыведения из центрального компартмента
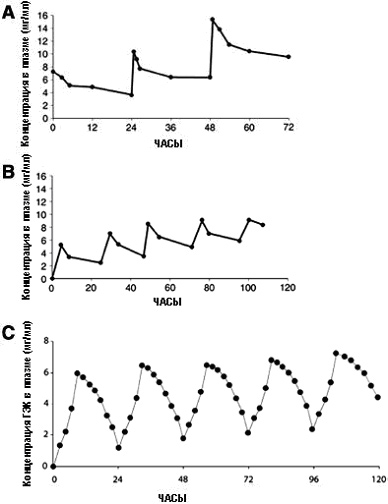 |
| Рис. 3. Кумуляция в плазме после повторного введения (А) 6% гидроксиэтилкрахмала (ГЭК) 450/0,7 (500 мл/сут в течение 3 суток); воспроизведено с разрешения Jungheinrich с сотр.138 (В) 6% ГЭК 200/0,62 (500 мл/сут в течение 5 суток); воспроизведено с разрешения Asskali с сотр.8 (С) 6% ГЭК 70/0,5; воспроизведено с разрешения Lehmann с сотр.7 |
Исследования показали, что препараты ГЭК с более высокой степенью замещения кумулируют в гораздо большем количестве, чем тетракрахмалы. Клиренс препаратов ГЭК ранних поколений происходит медленно. Полная элиминация препаратов ГЭК первого и второго поколения из крови превышает 24 часа.8,12 Повторное введение препарата ведет к стабильному накоплению ГЭК в плазме.
В исследовании, в котором здоровым добровольцам препараты вводились однократно, 13 был ярко показано влияние высокой степени МЗ (0,75) на клиренс препарата из плазмы. Величина клиренса ГЭК 670/0,75 (Hextend O ; Хоспира корп., Лейк Форест, шт. Иллинойс) составила 0,98 мл/мин; длительность периода полувыведения сначала составила 6,3 ч, а в течение первых 7 дней она возросла до 46,4 ч. Сходные характеристики были описаны Yacobi с сотр., который использовали гетакрахмал, растворенный в физиологическом растворе.
Кумуляция гетакрахмала в плазме после повторного его введения здоровым добровольцам была описана Mishler с сотр. 15 После трехкратного введения относительно небольшой дозы, равной 30 г (6% ГЭК 450/0,7), через 24 часа после последнего введения концентрация ГЭК в плазме была выше, чем максимальная концентрация препарата в плазме после первого введения (рис. 3А).
Исследования фармакокинетики гексакрахмалов и пентакрахмалов.
После однократного введения дозы 500 мл добровольцам длительность периода полувыведения из плазмы пентакрахмала (10% ГЭК 200/0,5), метаболизм которого осуществляется с большей скоростью, составила 3,35 часа, а длительность периода полувыведения из плазмы гексакрахмала (6% ГЭК 200/0,62) – 5,08 часа.12 Величина клиренса составила 1,23 мл/мин для гексакрахмала и 9,24 мл/мин для пентакрахмала. Она была выше, чем величина клиренса гетакрахмала (ГЭК 670/0,75) в опубликованной ранее работе13, которая составляла 0,98 мл/мин. Также отмечались значительные различия в длительности конечного периода полувыведения: 70 ч для гексакрахмала (ГЭК 200/0,62) и 31 ч для пентакрахмала (ГЭК 200/0,5).
Asskali и Forster выполнили работу по изучению тех же препаратов, в которой их вводили добровольцам ежедневно в течение 5 дней в объеме 500 мл. Они отметили, значительную кумуляцию обоих препаратов в плазме, начиная со второго дня. Гексакрахмал накапливался в большей степени (рис. 3В). Через 20 дней после введения концентрация пентакрахмала в плазме была ниже 0,5 мг/мл, в то время как концентрация гексакрахмала через 30 дней после введения составила 1,3 мг/мл.8
Lehmann с сотр.7 провели работу, посвященную изучению свойств низкомолекулярного пентакрахмала 6% ГЭК 70/0,5. Они обнаружили, что уровень кумуляции препарата в плазме был близок к тому, который зарегистрировали Asskali и Forster8 для ГЭК 200/0,5 после повторного введения добровольцам в течение 5 дней. Это подтверждает значение СМЗ для фармакокинетических свойств ГЭК.
Koltringer с сотр.16 выполнили клиническое исследование, в котором участвовали пациенты с заболеваниями периферических артерий. Они наблюдали рост концентрации 6% ГЭК 200/0,62 на протяжении 12 суток. В другом исследовании, в котором 30 пациентам, страдающим цереброваскулярными заболеваниями, ежедневно вводился ряд препаратов (гексакрахмал 6% ГЭК 200/0,62, пентакрахмал 10% ГЭК 200/0,5 и пентакрахмал 6% ГЭК 40/0,5), отмечалась внутрисосудистая кумуляция всех видов использованных ГЭК после повторного введения.17 Kromer с сотр.18 также сообщили о кумуляции пентакрахмала ГЭК 200/0,5 (10%) после его повторного введения на протяжении 10 дней пациентам, страдающим ишемическим инсультом.
Исследования фармакокинетики тетракрахмалов.
Препараты третьего поколения ГЭК, тетракрахмалы, имеют меньшую степень МЗ (0,4), что способствует увеличению скорости их распада и снижению их накопления в кровеносном русле и в тканях.
Waitzinger с сотр.19 провели исследование, в котором 12 добровольцам однократно вводилось 500 мл ГЭК 130/0,4. Они зарегистрировали высокую величину клиренса препарата из плазмы, равную 31,4 мл/мин для раствора 6%, и 26,0 мл/мин для раствора 10% (при этом по сообщению Wilkes с сотр.13 величина клиренса для гетакрахмала составила 0,98 мл/мин). Длительность периода начального полувыведения составила 1,39 и 1,54 ч соответственно, а длительность периода конечного полувыведения - 12,1 и 12,8 ч соответственно. Для сравнения длительность периода начального полураспределения гексакрахмала, зарегистрированная Asskali и Forster8 в проведенном ими исследовании с многократным введением препарата, составила 8,58 ч.
После ежедневного введения на протяжении 10 дней 500 мл 10% ГЭК 130/0,4 20 кривые начальной и конечной элиминации были практически идентичными, чего не наблюдалось при введении гетакрахмала (6% ГЭК 450/0,7)15 и гексакрахмала (6% ГЭК 200/0,62).8 Максимальная концентрация в плазме, площадь под кривой концентрации и клиренс были практически одинаковыми после первого и после последнего введения, что указывает на то, что значительной кумуляции 10% ГЭК 130/0,4 в плазме не происходит.
В целом результаты этих исследований по изучению дозирования свидетельствуют о том, что клиренс тетракрахмала (10% ГЭК 130/0,4), по крайней мере, в 23 раза превышает клиренс гексакрахмала (6% ГЭК 200/0,62) или гетакрахмала (6% ГЭК 450/0,7) и почти в 5 раз - клиренс пентакрахмала (10% ГЭК 200/0,5 21 ). Эти данные были подтверждены при введении этих препаратов пациентам, подвергающимся ортопедическим хирургическим вмешательствам. 22 К концу первых суток после проведения операции концентрация 6% ГЭК 130/0,4 составила 1,0 мг/мл, в то время как концентрация 6% ГЭК 200/0,5 - 2,6 мг/мл.
Влияние молекулярной структуры на эффективность.
На первый взгляд может показаться странным, что более продолжительное пребывание препарата в системе кровообращения не обязательно означает наличие волемического эффекта. Хотя в исследованиях была зарегистрирована значительная концентрация препаратов ГЭК с высокой степенью замещения,13,14 волемического действия через 24 часа после введения не наблюдалось.13,15,23,24 Хотя накопление тетракрахмала (ГЭК 130/0,4) в плазме минимально, во многих исследованиях было установлено, что продолжительность его действия сопоставима с таковым пентакрахмала (ГЭК 200/0,5)25-28 и гетакрахмала при сходных концентрациях (6% ГЭК 650/0,7, Hextend O или 6% ГЭК 670/0,75 в физиологическом растворе).29,30
Эти результаты были подтверждены в ряде проспективных рандомизированных двойных слепых исследований по сравнению объема 6% ГЭК 130/0,4 и 6% ГЭК 200/0,522,31,32 или 6% ГЭК 670/0,7530, необходимого для стабилизации гемодинамики во время и после проведения кардиохирургических и других хирургических вмешательств. Во всех этих исследованиях оценка необходимости проведения инфузии проводилась путем сравнения с исходными гемодинамическими параметрами, а клинические показатели, на основании которых принималось решение о применении препарата, и сами препараты предоставлялись участникам исследования в слепом порядке. Следует отметить, что объем ГЭК, необходимый для стабилизации гемодинамики, не отличался достоверно у пациентов, подвергающихся кардиохирургическим вмешательствам,31 и у пациентов, подвергающихся ортопедическим вмешательствам.22,30,32 Клинические исходы во всех группах были сопоставимы.
Клиренс и остаточная концентрация ГЭК тесно связаны с СМЗ и величиной отношения С2/С6, в то время как коллоидное онкотическое давление зависит от количества онкотически активных частиц, а не напрямую от концентрации раствора ГЭК.21 В одинаковом объеме раствора препарата ГЭК с меньшей молекулярной массой содержится большее количество молекул, чем в растворе ГЭК с более высокой молекулярной массой. То есть препарат с меньшей молекулярной массой, по-видимому, будет оказывать более выраженное действие на коллоидно-осмотическое давление при одинаковых концентрациях в плазме (рис. 4А). Молекулярная масса ГЭК 130/0,4 значительно меньше in vivo, чем молекулярная масса ГЭК 200/0,5. Поэтому в 1 г ГЭК 130/0,4 содержится большее количество макромолекул, обеспечивающих волемическое действие.
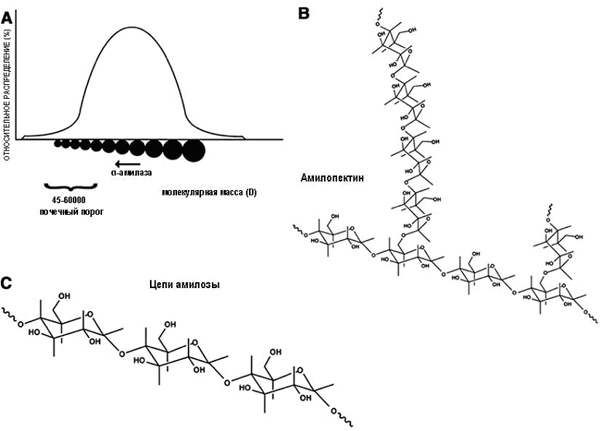 |
| Рис. 4. (А) Молекулы гидроксиэтилкрахмала (ГЭК) со временем постепенно уменьшаются в размерах в связи с ферментативным расщеплением под действием амилазы. В любой точке времени размер молекул представлен целым диапазоном. (В) Различия в структуре амилопектина (разветвленные цепи) и амилозы (С) (длинные цепи). |
После внутривенного введения молекулы ГЭК, размеры которых ниже почечного порога (45-60 кДа), выводятся с мочой, а более крупные молекулы под действием α-амилазы постепенно расщепляются на фрагменты меньшего размера, что происходит до тех пор, пока не будет достигнут почечный порог, и не начнется их выведение. ГЭК, имеющие меньшую степень МЗ расщепляются быстрее, в результате чего быстрее образуется большее количество онкотически активных частиц. Небольшое количество ГЭК выходит в интерстициальное пространство, перераспределяется и выводится. Некоторую его часть поглощает ретикулоэндотелиальная система, где происходит его медленное расщепление. Таким образом, накопление препарата в плазме и тканях в значительной степени зависит от структуры и вида конкретного ГЭК, а также от его физико-химических свойств.
Влияние на безопасность при использовании в клинике.
Следует рассматривать данные конкретных препаратов и не экстраполировать данные по свойствам одного вида ГЭК на другие виды. В клинических исследованиях были обнаружены значительные различия между поколениями ГЭК в отношении влияния на свертываемость, накопление в тканях и функцию почек. Они рассматриваются подробно в следующем разделе.
ГЭК третьего поколения: тетракрахмал.
Созданию нового плазмоэкспандера на основе крахмала способствовала потребность в повышении безопасности и улучшении фармакологических свойств с сохранением волемического действия препаратов ГЭК предшествующих поколений. Путем уменьшения ММ и СМЗ были получены препараты, имеющие менее продолжительный период полувыведения и лучшие фармакокинетические и фармакодинамические свойства, неблагоприятные реакции при использовании которых возникают реже.33 Хотя препараты более ранних поколений являлись производными амилопектина, выделяемого из крахмала кукурузы восковой зрелости, было бы ошибочным рассматривать ГЭК как однородную группу препаратов, так как модификация ММ и степени и характера замещения вносит выраженные различия в препараты ГЭК различных поколений.
То же самое можно сказать и о крахмалах сходной структуры, которые были получены из различных источников: кукурузы восковой зрелости и картофеля. В настоящее время имеется два крахмала третьего поколения, полученные из этих двух источников. Эти крахмалы входят в состав ряда препаратов. Согласно данным одного исследования растворы ГЭК, созданные на основе картофеля и кукурузы восковой зрелости не являются биоэквивалентными.34 В связи с этим, может быть неправомерным переносить данные, полученные в исследовании, в котором был использован один тип крахмала, на другой его тип.
Структурные различия и биоэквивалентность.
Крахмал кукурузы восковой зрелости (ГЭК 130/0,4) главным образом состоит (приблизительно 98%) из амилопектина, разветвленного в высокой степени (рис. 4В), а крахмал картофеля (ГЭК 130/0.42) представляет собой гетерогенную смесь амилопектина (приблизительно 75%) и линейных цепей амилозы. То есть степень разветвления в картофельном крахмале ниже (рис. 4С).35
Картофельный крахмал содержит эстерифицированные фосфатные группы, количество которых составляет несколько тысяч на миллион, в то время как в крахмале восковой кукурузы они не определяются. 36 Эти различия относятся и к очищенному препарату (таблица 4). Оба вида крахмала имеют сравнимую СМЗ (0,4 у крахмала восковой кукурузы и 0,42 у крахмала картофеля), хотя Sommermeyer с сотр. высказали предположение, что СМЗ в препарате, полученном из картофельного крахмала, на самом деле достигает 0,45.33
Таблица 4.
Физико-химические различия гидроксиэтилкрахмала (ГЭК) 130/0,4,
полученного из кукурузы восковой зрелости, и ГЭК 130/0,42, полученного из картофеля.
| ГЭК 130/0,4 на основе крахмала восковой кукурузы | ГЭК 130/0,42* на основе крахмала картофеля | |
| Степень молярного замещения | 0,41 | 0.45-0,46 |
| Величина отношения С2/С6 | 9,05:1 | 6,9-7,7 |
| Степень разветвленности | 6,6 мол% | 4,8-5,1 мол% |
| Свободный фосфат | - | 34-84 ppm |
| Общий фосфат | 15 ppm | 205-290 ppm |
| Вязкость | К=2,29 х 10-3 | К=2.73-3,52 х 10-3 |
| (константы Марка-Хаувинка) | А=0,353 | А=0,329-0,348 |
*Диапазоны отражают значения, полученные в различных партиях
Источник данных: Sommermeyer с сотр.33
ppm количество частей на миллион
В ГЭК 130/0,4 (Волювен®; Фрезениус Каби; Бад Хомбург, Германия), полученных на основе крахмала кукурузы восковой зрелости величина соотношения С2 / С6 приблизительно составляет 9:1, а в крахмалах, полученных на основе картофельного крахмала - Венофундин® ( Б Браун Мельзунген, Германия), Vitahes® (Зерумверк Бернбург; Бернбург, Германия) или PlasmaVolume Redibag® (Бакстер Унтершляйсхайм, Германия) 6:1. Как было показано для препаратов ГЭК ранних поколений, более высокая величина отношения C2 / C6 частично препятствует гидролизу, осуществляемому α-амилазой.
Sommermeyer с сотр. также установили, что препараты ГЭК, полученные на основе картофельного крахмала, имеют более высокую внутреннюю вязкость, чем препараты, полученные на основе крахмала кукурузы восковой зрелости с такой же ММ,33 что наиболее вероятно обусловлено различиями в степени разветвленности. К сожалению, не так много известно о значении этого увеличения вязкости. Его влияние на клиническое применение пока неясно; необходимо проведение дальнейших исследований.
Эти структурные различия могут оказывать влияние на фармакокинетические свойства. В этом контексте Lehmann с сотр. обнаружили значительные различия в общем кажущемся клиренсе этих двух препаратов. У препарата, полученного на основе крахмала кукурузы восковой зрелости (ГЭК 130/0,4), площадь под кривой концентрации в плазме была большей. Все это говорит о том, что эти препараты не являются биоэквивалентными.34 Разрушение и выведение полимера с меньшей СМЗ (т. е. препарат ГЭК 130/0,4) должно происходить быстрее, однако Lehmann предположил, что гидроксиэтилирование второго атома углерода, обусловливающее высокую величину соотношения C 2 / C6, равную 9:1, препятствует доступу α-амилазы, и, следовательно, замедляет разрушение препарата.

